2. 济宁市第一人民医院医学检验科, 济宁 272011
2. Medical Laboratory Department of Jining First People's Hospital, Jining 272011, China
作为一类重要的含氮杂环化合物,喹啉及其衍生物在药物合成[1-7],化学分析[8-9]及染料工业[10]等领域的关键研究价值受到化学工作者的关注。随着新型合成手段的发展,众多结构新颖、药效作用显著的喹啉类药物被开发出来。然而,传统方法构建喹啉衍生物存在工艺复杂、条件严苛、原子经济性低、环境污染严重等弊端。因此,绿色、高效的喹啉衍生物官能团化方法的开发及其功能化改造一直都是研究热点。
近年来,C-H官能团化策略因其良好的原子经济性、区域选择性等优势被广泛应用于有机物的合成与修饰当中。基于此手段,化学工作者成功实现了对8-氨基喹啉的C-C键[11-12]、C-X键[13-14]、C-N键[15]、C-S键[16-17]及C-P键[18-19]构建,然而其C-O键[20-21]构建目前仍是一个挑战。
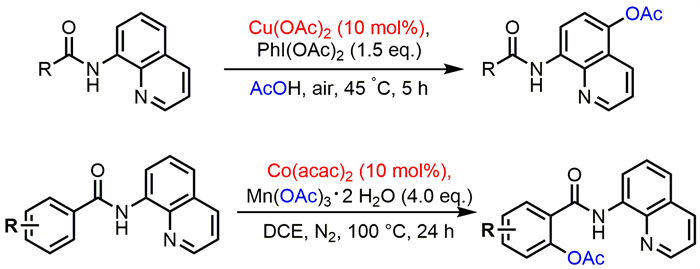
2017年,夏成才课题组以Cu(OAc)2为催化剂实现了8-氨基喹啉酰胺C5选择性C-O偶联反应[20](图 1)。2018年,Deb课题组使用Mn(OAc)3·2H2O作为氧化剂和乙酰氧基源,在Co(acac)2催化下实现了8-氨基喹啉酰胺苯环C-O键构建(图 1)[21]。尽管过渡金属催化C-O键构建已经取得较大成功,但反应通常在均相体系中展开,其催化剂回收困难,造成极大浪费,且残留的微量金属会对产物品质造成污染。因此,开发一种高效、实用、清洁且易分离的催化剂实现选择性C-O键构建尤为关键。
为解决上述问题,具有高经济性的非均相催化剂被应用于化学合成当中[22]。基于以上研究成果,我们拟开发一种酞菁铜催化8-氨基喹啉酰胺选择性C-O偶联方法。
1 方法 1.1 反应条件的优化首先,以N-(苯基)喹啉酰胺(1a)为起始底物,碘苯二乙酸为氧化剂,在酞菁铜催化下于乙酸中加热至50℃反应5h,成功以75%的收率得到了目标产物(表 1,条目1)。由于金属催化剂在C-H官能团化中的关键作用,因此对酞菁铁、酞菁锌及酞菁镍进行了筛选,结果表明酞菁铜的催化活性要优于其他金属催化剂(条目2-4)。接下来,对双三氟乙酸碘苯、羟基(对甲苯磺酰氧)碘苯和过氧乙酸等氧化剂进行筛选,其产率均有不同程度下降(条目7-9)。而不使用催化剂及氧化剂反应均不能发生,且提升催化剂用量对收率没有明显影响(条目5-6、10)。此外,反应温度对收率影响显著,而气体氛围几乎没有影响(条目11-13)。
| 表 1 C-O偶联反应条件筛选a, b |
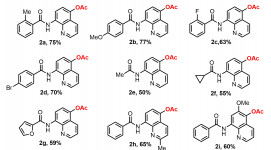
在确定最优反应条件之后,我们进一步考察了该方法的底物适用范围(表 2)。当酰胺苯环上带有取代基时,吸电子基或供电子基均能以中等以上收率(63%~77%)得到目标产物,且供电子基的酰胺收率要高于吸电子基的收率。同时,取代基位置对收率没有明显影响,表明位阻效应对反应无影响(2a~2d)。当苯基被烷基或呋喃基取代时收率略有下降(2e~2g)。同时,喹啉上带有取代基时收率变化不明显(2h~2i)。
| 表 2 C-O偶联反应底物范围a, b |
基于在反应中底物及产物与催化剂溶解性差异,通过简单的过滤分离产物和催化剂是一种十分有效的方法。
在催化剂循环实验中,将催化过一次反应的催化剂分离,经洗涤干燥后再次加入含有新底物的反应器中进行下一次催化。该催化剂催化循环5次之后,依然保持着较好的催化活性。在第4次和第5次催化循环实验中,该C-O偶联反应收率分别为65%和61%。
2 结果为了能够进一步地明确该反应所经历过程,我们通过以下控制实验对反应机理展开研究。首先,当体系中加入3.0当量2,2,6,6-四甲基哌啶氧化物(TEMPO)或2,6-二叔丁基对甲酚(BHT)时反应被完全抑制,表明该反应可能经历了自由基历程。随后以1,1-二苯基乙烯作为自由基捕捉剂成功得到相应产物3(图 2)。

|
图 2 机理验证实验 |
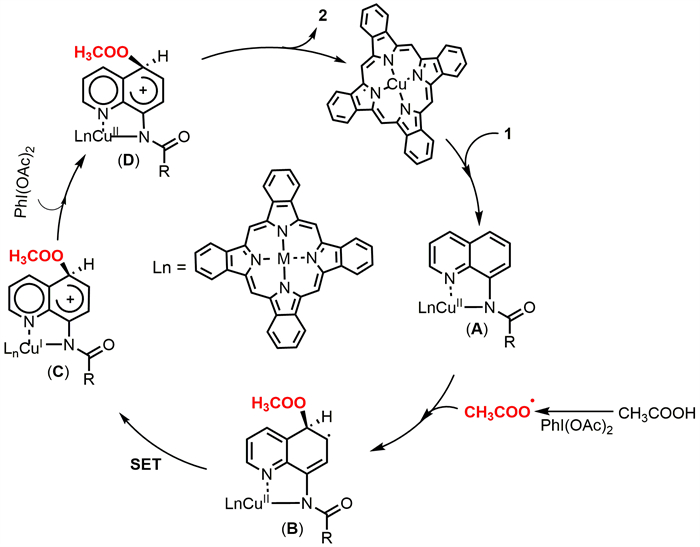
基于以上结果及相关研究报道,我们提出以下反应机理:首先,酞菁铜与1配位形成配合物(A)。随后,(A)与经碘苯二乙酸的氧化作用生成的乙酰氧基自由基偶联得到中间体(B),(B)通过单电子转移(SET)得到配合物(C),继而配合物(C)被氧化成配合物(D)。最后(D)与金属配合物解离得到目标产物2并释放催化剂完成催化循环(图 3)。
|
图 3 可能的反应机理 |
本文报道了一种以酞菁铜作为催化剂实现喹啉酰胺区域选择性C(sp2)-O偶联的方法。反应以易于获得、安全稳定且易于与产物分离的酞菁铜作为催化剂,碘苯二乙酸为氧化剂,在乙酸中成功实现了8-氨基喹啉选择性C-O键构建。该方法条件简单,选择性好,产率较高,且所使用催化剂可回收利用,是一种高效绿色的C-H官能团化手段。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Romero JA, Acosta ME, Gamboa ND, et al. Optimization of antimalarial, and anticancer activities of (E)-methyl-2-(7-chloroquinolin-4-ylthio)-3-(4-hydroxyphenyl) acrylate[J]. Bioorg Med Chem, 2018, 26(4): 815-823. DOI:10.1016/j.bmc.2017.1-2.022 |
| [2] |
Kalita J, Chetia D, Rudrapal M. Design, synthesis, antimalarial activity and docking study of 7-chloro-4-(2-(substituted benzylidene)hydrazineyl)qui-nolines[J]. Med Chem, 2019, 16(7): 928-937. DOI:10.2174/1573406415666190806154722 |
| [3] |
Ma X, Zhou W, Brun R. Synthesis, in vitro antitrypanosomal and antibacterial activity of phenoxy, phenylthio or benzyloxy substituted quinolones[J]. Bioorg Med Chem Lett, 2009, 19(3): 986-989. DOI:10.1016/j.bmcl.2008.11.078 |
| [4] |
Boateng CA, Eyunni SVK, Zhu XY, et al. Benzothieno[3,2-b] quinolinium and 3-(phenylthio) quinolinium compounds: synthesis and evaluation against opportunistic fungal pathogens[J]. Bioorg Med Chem, 2011, 19(1): 458-470. DOI:10.1016/j.bmc.2010.11.008 |
| [5] |
Solomon VR, Lee H. Quinoline as a privileged scaffold in cancer drug discovery[J]. Curr Med Chem, 2011, 18(10): 1488-1508. DOI:10.2174/0929867117-95328382 |
| [6] |
Adsule S, Barve V, Chen D, et al. Novel schiff base copper complexes of quinoline-2-carboxaldehyde as proteasome inhibitors in human prostate cancer cells[J]. J Med Chem, 2006, 49(24): 7242-7246. DOI:10.1021/jm060712l |
| [7] |
Fakhfakh MA, Fournet A, Prina E, et al. Synthesis and biological evaluation of substituted quinolines: potential treatment of protozoal and retroviral co-infections[J]. Bioorgan Med Chem, 2003, 11(23): 5013-5023. DOI:10.1016/j.bmc.2003.09.007 |
| [8] |
Rueping M, Theissmann T, Stoeckel M, et al. Direct enantioselective access to 4-substituted tetrahydroquinolines by catalytic asymmetric transfer hydrogenation of quinolines[J]. Org Biomol Chem, 2011, 9(19): 6844-6850. DOI:10.1039/c1ob05870c |
| [9] |
Khot NP, Mahato P, Sajeev TK, et al. Rh(Ⅲ)-catalyzed C(7)-H alkylation of quinolines in the synthesis of angular π-extended pyrroloquinolines for single-component white-light emission[J]. Org Lett, 2022, 24(11): 2186-2191. DOI:10.1021/acs.orglett.2-c00503 |
| [10] |
Zaitsev VG, Shabashov D, Daugulis O. Highly regioselective arylation of sp3 C-H bonds catalyzed by palladium acetate[J]. J Am Chem Soc, 2005, 127(38): 13154-13155. DOI:10.1021/ja054549f |
| [11] |
Kouznetsov VV, Mendez LYV, Galvis CEP, et al. The direct C-H alkenylation of quinoline N-oxides as a suitable strategy for the synthesis of promising antiparasitic drugs[J]. New J Chem, 2020, 44(1): 12-19. DOI:10.1039/c9nj05054j |
| [12] |
Grigorjeva L, Daugulis O. Cobalt-catalyzed, aminoquinol-line-directed C(sp2)-H bond alkenylation by alkynes[J]. Angew Chem Int Ed, 2014, 53(38): 10209-10212. DOI:10.1002/anie.201404579 |
| [13] |
Wang Y, Wang Y, Jiang K, et al. Transition-metal-free oxidative C5 C-H-halogenation of 8-aminoquinoline amides using sodium halides[J]. Org Biomol Chem, 2016, 14(43): 10180-10184. DOI:10.1039/c-6ob02079h |
| [14] |
Rao NS, Reddy GM, Sridhar B, et al. Copper-mediated remote highly site-selective C-H bond bromination and chlorination of quinolines at the C5 position that is geometrically difficult to access[J]. Eur J Org Chem, 2017, 2017(3): 438-442. DOI:10.1002/ejoc.201601151 |
| [15] |
Li ZX, Sun SY, Qiao HJ, et al. Palladium-catalyzed regioselective C8-H amination of 1-naphthylamine derivatives with aliphatic amines[J]. Org Lett, 2016, 18(18): 4594-4597. DOI:10.1021/acs.orglett.6b02243 |
| [16] |
Sun MM, Sun SY, Qiao HJ, et al. Silver(Ⅰ)-promoted C5-H phosphonation of 8-amino-quinoline amides with H-phosphonates[J]. Org Chem Front, 2016, 3(12): 1646-1650. DOI:10.1039/c6qo00379f |
| [17] |
Qiao HJ, Sun SY, Zhang Y, et al. Merging photoredox catalysis with transition metal catalysis: site-selective C4 or C5-H phosphonation of 8-aminoquinoline amides[J]. Org Chem Front, 2017, 4(10): 1981-1986. DOI:10.1039/c7qo00305f |
| [18] |
Qiao HJ, Sun SY, Yang F, et al. Copper(Ⅰ)-catalyzed sulfonylation of 8-aminoquinoline amides with sulfonyl chlorides in air[J]. Org Lett, 2015, 17(24): 6086-6089. DOI:10.1021/acs.orglett.5b03114 |
| [19] |
Wang Y, Wang Y, Zhang Q, et al. Site-selective oxidative C-H sulfonylation of 8-acylaminoquinolines and anilides under metal-free conditions[J]. Org Chem Front, 2017, 4(4): 514-518. DOI:10.1039/c6q-o00730a |
| [20] |
Xia CC, Wang K, Xu J, et al. Selective remote esterification of 8-aminoquinoline amides via copper(Ⅱ)-catalyzed C(sp2)-O cross-coupling reaction[J]. Org Biomol Chem, 2017, 15(3): 531-535. DOI:10.1039/c-6ob02375d |
| [21] |
Sarkar W, Bhowmik A, Mishra A, et al. Cobalt-catalyzed directed sp2 C-H acetoxylation of arenes employing Mn(OAc)3.2H2O as acetoxy source[J]. Adv Synth Catal, 2018, 360(17): 3228-3232. DOI:10.1002/adsc.201800398 |
| [22] |
Azarifar D, Khatami SM, Nejat-Yami R. Nano-titania-supported preyssler-type hetero-polyacid: an efficient and reusable catalyst in ultrasound-promoted synthesis of 4H-chromenes and 4H-pyrano[2,3-c]pyrazoles[J]. J Chem Sci, 2014, 126(1): 95-101. DOI:10.1007/s12039-013-0548-x |