2. 沈阳医学院中医药学院, 沈阳 110032
2. College of Traditional Chinese Medicine of Shenyang Medical University, Shenyang 110032, China
结直肠癌(colorectal cancer, CRC)是所有癌症中排名第三的消化道恶性肿瘤,其发病与遗传、环境、感染和菌群失衡等多种因素有关,其中肠道菌群失调为肿瘤的生长提供了有利的微环境[1-3]。肿瘤相关成纤维细胞(cancer associated fibroblasts,CAFs)在肿瘤微环境中扮演着重要角色,CAFs中的微小RNA(microRNA,miRNA)失调以及肿瘤细胞和微环境之间的外泌体miRNA迁移与信号通路激活、癌症进展密切相关[4-5]。目前,关于肿瘤微环境中的miRNA能否通过影响肠道菌群引起肿瘤细胞表型改变知之甚少。我们前期研究发现,miR-625-3p与肿瘤侵袭、转移、耐药等恶性行为密切相关[6]。本研究将进一步验证miR-625-3p基因沉默对肠道微生物群的影响,旨在明确CAFs递送的miR-625-3p与肠道菌群失调之间的关联,为基因治疗及肠道菌群调节对CRC防治的临床应用提供理论基础。
1 材料与方法 1.1 材料 1.1.1 细胞株与动物SW620细胞购于赛百慷(上海)生物技术股份有限公司,货号iCell-h206。选用雌性SPF级BALB/C小鼠,体重(14±1)克,购于北京华阜康生物科技有限公司。由济宁医学院动物伦理委员会审核批准使用(JNMC-2021-DW-028)。
1.1.2 药物与试剂Oxaliplatin (阿拉丁公司);CD63,TSG101,内参抗体β-actin,全蛋白提取试剂盒,TUNEL试剂盒(沈阳万类生物科技公司);PVDF膜(美国Millipore公司,批号IPVH00010);DAPI(上海Aladdin生化科技股份有限公司);抗荧光淬灭剂,2×Taq PCR MasterMix, SYBR Green(北京索莱宝科技有限公司);TRIpurer(北京百泰克生物技术有限公司);磁珠法提取试剂盒(Qiagen公司)。
1.1.3 仪器德国Leica RM2235石腊切片机,日本OLYMPUS BX53显微镜,湖南湘仪H-2050R超速冷冻离心机,美国BIOTEK ELX-800酶标仪;北京六一生物DYCZ-24DN双垂直蛋白电泳仪,美国Thermo公司NANO 2000紫外分光光度计,韩国Bioneer公司Exicycler96荧光定量PCR仪,美国Illumina公司NovaSeq 6000测序仪。
1.2 方法 1.2.1 外泌体的提取与鉴定构建miR-625-3p沉默的慢病毒载体/阴性对照(miR-625-3p-Si/SiNe), CAFs细胞按每孔5×104个接种于12孔板中。待细胞贴壁后, 使用移液器吸取准确体积(MOI值为100)的病毒液加入准备好的培养基中, 将细胞上清液弃去更换为带病毒的培养基, 置于37℃ 5% CO2的培养箱内培养, 感染48h后收集各组细胞上清,离心提取外泌体(exo-miR-625-3p-Si/SiNe)。
1.2.2 实验造模、干预与取材将5×106个SW620细胞注射到小鼠的前肢皮下,随机分为模型(A)组,奥沙利铂(Oxaliplatin, B)组,Oxaliplatin+exo-miR-625-3p-Si(C)组和Oxaliplatin+exo-miR-625-3p-SiNe(D)组,基于3R原则,每组3只。其中,B、C、D组腹腔注射Oxaliplatin,0.005g/kg,1次/3d,A组腹腔注射等量PBS。C、D组分别将exo-miR-625-3p-Si/SiNe注入皮下肿瘤,100μg/次,2次/周。建模35d后处死小鼠,收集肿瘤组织。于小鼠处死前48h,将其直肠中粪便收集并标记冻存于-80℃冰箱,以供进一步行菌群分析。
1.2.3 Western blot检测外泌体CD63、TSG101蛋白表达裂解液置于室温融化, 低温离心, 分离蛋白质, BCA反应测定蛋白浓度。40μg蛋白在凝胶上电泳,然后放置在PVDF膜上1h。用5%脱脂奶粉稀释CD63、TSG101一抗至1∶500,4℃孵育过夜。洗膜后,加入二抗,37℃下孵育45min。加入ECL化学发光试剂,曝光。用凝胶图象处理系统分析目标条带的光密度值。
1.2.4 肿瘤体积观察每日观察小鼠状态,包括进食量、活动量等。自建模第3天始,每隔3d,以游标卡尺对瘤体长、短径分别进行测量,计算小鼠肿瘤体积并记录。肿瘤体积(mm3)计算公式=长径(Length)×短径2(Width2)×1/2。
1.2.5 PCR检测miR-625-3p的表达分离纯化提取总RNA,利用生工miRNA第一链cDNA合成(加尾法)试剂盒将上述的RNA进行反转录。has-miR-625-3p F上游引物由金斯瑞生物科技有限公司根据设计合成,序列为GACTATAGAACTTTCC CCCTCA。以人U6 snRNA为内参,U6 F以及通用R均为加尾法试剂盒自带。荧光定量统计数据结果采用2-△△Ct方法分析。
1.2.6 Tunel检测细胞凋亡肿瘤组织常规包埋,梯度酒精脱水,切片,烘干。TUNEL反应液(Enzyme solution及Label Solution按1∶9配制)滴加50μL,DAPI复染5min,滴加荧光淬灭剂封片。×400倍显微镜下观察染色效果,并拍照。
1.2.7 直肠内容物菌群丰度及多样性检测按照天根磁珠法说明提取样本基因组DNA,进行细菌PCR扩增,通用引物forward primer(5’-3’)序列:CCTAYGGGRBGCASCAG(341F)reverse primer(5’-3’)序列:GGACTACNNGGGTATCTAAT(806R),扩增细菌核糖体RNA基因V3~V4区,得到片段。PCR反应条件:95℃预变性3min;98℃变性25s,58℃退火15s,72℃延伸20s,重复30个循环,72℃延伸5min。对PCR产物进行测序数据处理。根据97%的一致性将序列聚类成为OTUs(Operational Taxonomic Units),应用Qiime软件和R软件进行样本复杂度分析和多样本比较分析。
1.3 统计学方法采用SPSS22.0统计分析,正态分布的计量资料采用x±s表示, 组间比较采用one-way ANOVA, 组间两两比较用LSD法, 以P<0.05为差异有统计学意义。
2 结果 2.1 外泌体的标记和鉴定Western blot检测外泌体标志蛋白CD63、TSG101的表达情况,证实外泌体分离成功。见图 1。
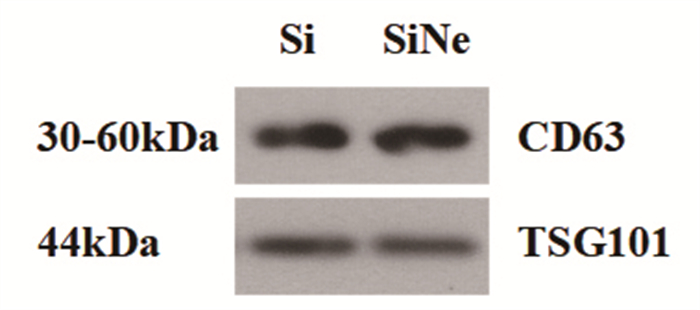
|
图 1 外泌体CD63、TSG101的蛋白表达情况 |
与D组比较,C组miR-625-3p基因表达显著降低(t=-4.057, P<0.05),证实miR-625-3p基因沉默处理可以引起肿瘤组织miR-625-3p基因低表达。
2.3 各组小鼠肿瘤体积与A组比较,B、C、D组肿瘤体积均显著降低,证实奥沙利铂化疗对于结直肠癌的肿瘤生长有干预效果;与D组比较,C组肿瘤体积较小(t=-2.331, P=0.08),表明miR-625-3p基因沉默对CRC荷瘤小鼠肿瘤的生长具有一定的抑制作用。
2.4 各组小鼠肿瘤细胞凋亡情况与D组比较,C组肿瘤细胞凋亡明显增加(t=2.945, P<0.05),表明miR-625-3p基因沉默促进CRC荷瘤小鼠肿瘤细胞凋亡。见图 2。
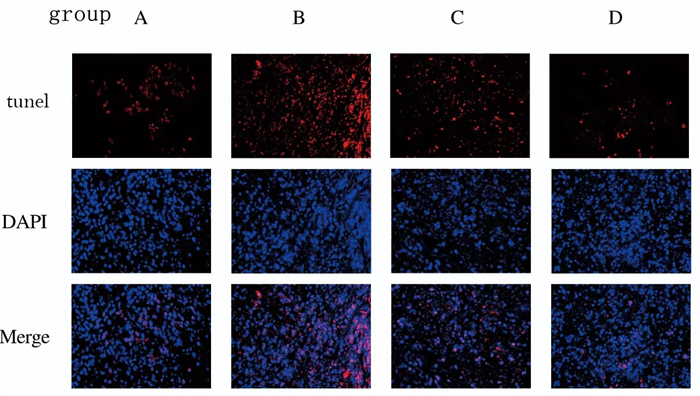
|
图 2 miR-625-3p基因沉默对小鼠肿瘤细胞凋亡的影响 |
通过测序生成7.98×105条Raw Data后,过滤、拼接、去除嵌合体总共得到5.98×105条Effective Tags。在97%的相似水平下聚类生成OTU,利用分组Venn图分析组间菌群OTU数量和其种类交叉情况,各组特异性/总共的OTU数目分别为:A组7/1246、B组12/1316、C组11/1269、D组25/1350,各组共检测OTU 1454个,其中共有OTU 1040个,为总OTU数的71.53%。与A组比较,B组的总OTU数量升高,表明Oxaliplatin化疗后肠道菌群的整体水平和多样性有所增加;与D组比较,C组的总OTU数量降低,这一结果表明miR-625-3p基因沉默可能降低了肠道菌群的整体水平和多样性。见图 3。
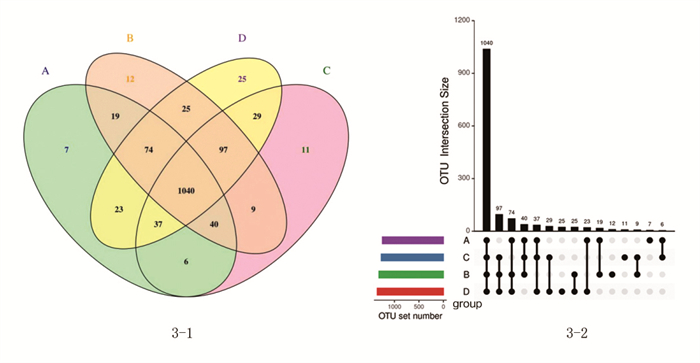
|
图 3 各组小鼠肠道菌群OTU分析 注:3-1.分组Venn分析;3-2.基于OTU的UpSet图。 |
物种累积曲线趋于平缓,可以判断测序样本量充分;物种多样性曲线(Rank-Abundance曲线)宽度适中、光滑平缓,可以判断物种丰富且分布均匀,可有效反映出样本中群落结构的情况;微生物覆盖率分析(Good′s Coverage指数)接近1,测序深度对样品物种全覆盖。各组小鼠肠道菌群丰富程度(包括observed_species、Chao1、Ace指数)和均匀程度(包括shannon、simpson指数)显示,与A组比较,B组丰富程度和均匀度均升高;与D组比较,C组丰富程度和均匀度均降低,但均无统计学意义(P>0.05)。见图 4。
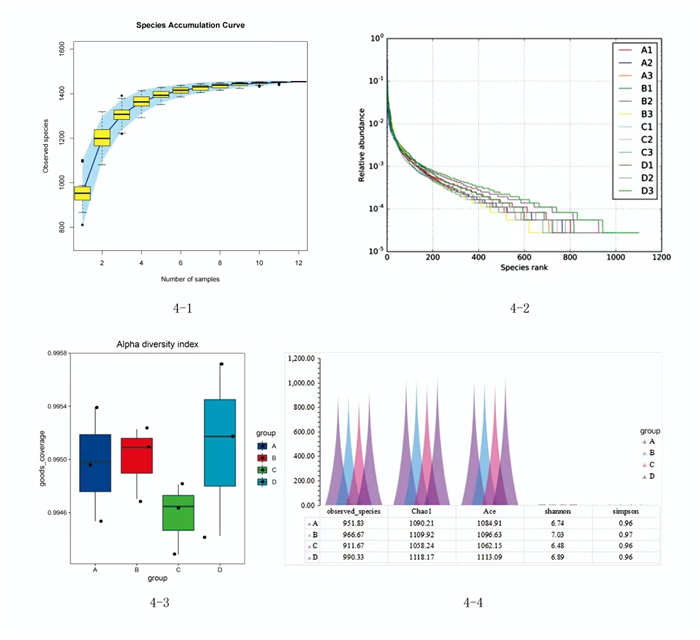
|
图 4 Alpha Diversity多样性分析 注:4-1.物种累积曲线;4-2.Rank-Abundance曲线;4-3.微生物覆盖率分析;4-4.各组小鼠肠道菌群丰富程度和均匀程度比较。 |
除去未检测出的菌门,各组小鼠肠道菌群拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)的丰度在检测出的菌门中比例均达到90%以上。与A组比较,B组小鼠肠道中Bacteroidetes丰度降低(t=-2.886, P<0.05),Firmicutes丰度升高;与D组比较,C组Bacteroidetes丰度升高(t=3.590, P<0.05),Firmicutes丰度降低(t=-3.608, P<0.05)。表明Oxaliplatin化疗会改变肠道菌群的菌门水平和结构组成,miR-625-3p基因沉默后可将肠道菌群的菌门水平和结构回调。见图 5。
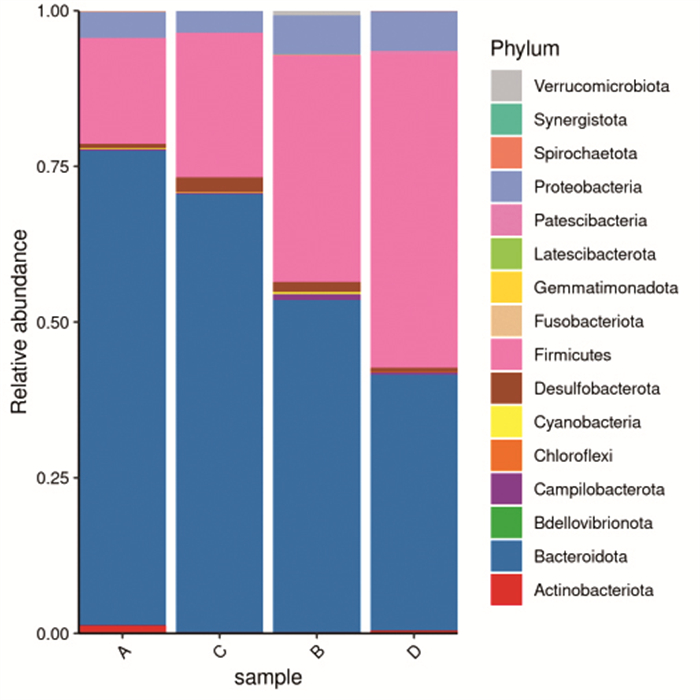
|
图 5 各组小鼠肠道菌群在门水平上的组成 |
LDA值分布柱状图展示了LDA Score大于设定值的菌门,即组间具有统计学差异的Biomarker,柱状图的长度代表差异菌门的影响大小。在进化分支图中,由内至外辐射的圆圈代表了由门至属(或种)的分类级别。在不同分类级别上的每一个小圆圈代表该水平下的一个分类,其直径大小与相对丰度呈正比。无显著差异的Biomarker为黄色,差异Biomarker跟随组进行着色,红色、绿色节点分别表示在红色、绿色组别中起到重要作用的菌种。筛选C与D两组间丰度存在显著差异的菌种,共29种。其中,在C组起到重要作用的菌种共3种,在D组起到重要作用的菌种共26种。见图 6,表 1。
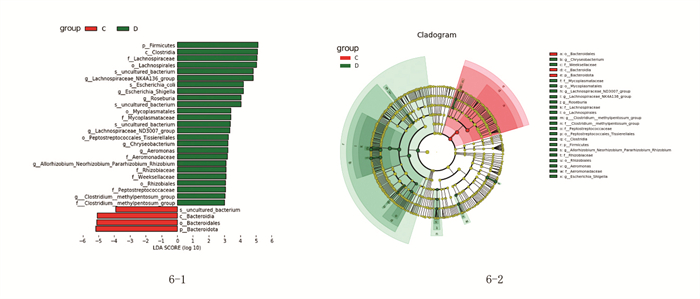
|
图 6 LEfSe分析组间丰度存在显著差异的菌种 注:6-1.LDA值分布柱状图;6-2进化分枝图。 |
| 表 1 LEfSe分析组间丰度存在显著差异的菌种biomarker |
CRC作为我国常见消化道恶性肿瘤,其临床治疗多采用外科手术、化疗等方法。然而外科手术具有易引起并发症的风险,而化疗药物在提高患者生存率的同时也伴随着体重减轻、恶心、呕吐、免疫力降低等不良反应,故而CRC的治疗效果并不理想[7]。因此,全面了解CRC的发病机制有助于寻找特异性的治疗策略和药物靶标,深入探讨其发病机理对其防治具有重要意义。CRC发病机制复杂,受遗传、环境、感染和菌群失衡等多种因素的影响[8]。
肠道拥有人体最大的微生物群,CRC肠道微生物群失调可能导致细胞因子活性改变、炎症信号通路激活,致使肠道屏障功能减弱,进而导致肿瘤微环境(tumor microenvironment,TME)改变为利于肿瘤生长的炎性微环境[9]。
肿瘤相关成纤维细胞(cancer associated fibroblasts,CAFs)作为TME中最重要的间质细胞,目前在临床中被视作抗癌治疗的重要靶点[10]。CAFs分泌的外泌体在促进炎症反应、组织再生及促进肿瘤发展中扮演着重要角色[11]。
存在于TEM中的外泌体通过蛋白质、脂质和核酸以对细胞进行调节,其为一类30~120nm的小囊泡,可影响肿瘤细胞的增殖、侵袭、转移及耐药等[12]。本课题组前期研究发现,miR-625-3p在CRC中存在高表达情况,其能够促进结肠癌细胞增殖迁移和侵袭,发挥促癌作用[6]。基于肠道微生物群在CRC治疗中的重要作用,本研究在前期基础上进一步探讨了CAFs源外泌体递送miR-625-3p对肠道微生物群的影响。本研究中,首先进行了CAFs源外泌体的分离和鉴定,证实外泌体提取成功,并将进一步用于对小鼠的干预。干预后结果显示,与D组比较,C组肿瘤体积和miR-625-3p基因表达均降低,肿瘤细胞凋亡明显增加,证实miR-625-3p基因沉默处理可以干预CRC荷瘤小鼠肿瘤的生长,促进肿瘤细胞凋亡。接下来,我们通过16s rRNA测序进行菌群分析,并着重对比miR-625-3p基因沉默及其阴性对照组数据,结果显示,与D组比较,C组的总OTU数量、丰富程度和均匀度均降低,表明miR-625-3p基因沉默可能降低了肠道菌群的整体水平和多样性,但差异不显著;C组Bacteroidetes丰度升高,Firmicutes丰度降低,表明miR-625-3p基因沉默可将Oxaliplatin化疗引起的肠道菌群的菌门水平和结构降低进行回调;与D组比较,C组小鼠丰度存在显著差异的菌种有29种。
综上所述,肠道菌群引起肿瘤微环境改变在CRC的发生、发展中起到重要作用。CAFs作为肿瘤微环境中最重要的组分,基因沉默其所递送的miR-625-3p,能抑制CRC的发展,促进肿瘤细胞的凋亡,改善小鼠肠道微生态环境,可将miR-625-3p作为CRC基因治疗的切入点,展开进一步研究以应用于临床。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65(2): 87-108. DOI:10.3322/caac.21262 |
| [2] |
Pu J, Zhou X, Liu J, et al. Therapeutic potential and deleterious effect of glucocorticoids on azoxymethane/dextran sulfate sodium-induced colorectal cancer in mice[J]. Am J Cancer Res, 2021, 11(10): 4866-4883. |
| [3] |
Li D, Feng Y, Tian M, et al. Dietary barley leaf mitigates tumorigenesis in experimental colitis-associated colorectal cancer[J]. Nutrients, 2021, 13(10): 3487. DOI:10.3390/nu13103487 |
| [4] |
Shao X, Sun S, Zhou Y, et al. Bacteroides fragilis restricts colitis-associated cancer via negative regulation of the NLRP3 axis[J]. Cancer Lett, 2021, 523: 170-181. DOI:10.1016/j.canlet.2021.10.002 |
| [5] |
Zhang L, Zhang S, Yao J, et al. Microenvironment-induced PTEN loss by exosomal microRNA primes brain metastasis outgrowth[J]. Nature, 2015, 527(7576): 100-104. DOI:10.1038/nature15376 |
| [6] |
Zhang Y, Yin CJ, Wei C, et al. Exosomal miR-625-3p secreted by cancer-associated fibroblasts in colorectal cancer promotes EMT and chemotherapeutic resistance by blocking the CELF2/WWOX pathway[J]. Pharmacol Res, 2022, 186: 106534. DOI:10.1016/j.phrs.2022.106534 |
| [7] |
Luo Q, Huang S, Zhao L, et al. Chang qing formula ameliorates colitis-associated colorectal cancer via suppressing IL-17/NF-κB/STAT3 pathway in mice as revealed by network pharmacology study[J]. Front Pharmacol, 2022, 13: 893231. |
| [8] |
Ding PP, Xu YQ, Li LY, et al. Intracellular complement C5a/C5aR1 stabilizes β-catenin to promote colorectal tumorigenesis[J]. Cell Rep, 39, 1108, 51: 110851. DOI:10.1016/j.celrep.2022.110851 |
| [9] |
Liu LS, Shah Khalid. The potential of the gut microbiome to reshape the cancer therapy paradigm: A review[J]. JAMA Oncol, 2022, 8(7): 1059-1067. DOI:10.1001/jamaoncol.2022.0494 |
| [10] |
Chen Y, McAndrews KM, Kalluri R. Clinical and therapeutic relevance of cancer-associated fibroblasts[J]. Nat Rev Clin Oncol, 2021, 18(12): 792-804. DOI:10.1038/s41571-021-00546-5 |
| [11] |
Zhang HY, Deng T, Liu R, et al. CAF secreted miR-522 suppressesferroptosis and promotes acquired chemo-resistance in gastric cancer[J]. Mol Cancer, 2020, 19(1): 43. DOI:10.1186/s12943-020-01168-8 |
| [12] |
Milane L, Singh A, Mattheolabakis G, et al. Exosome mediated communication within the tumor microenvironment[J]. J Control Release, 2015, 219: 278-294. DOI:10.1016/j.jconrel.2015.06.029 |



