2. 山东理工职业学院能源与材料工程学院, 济宁 272067;
3. 济宁医学院基础医学院, 济宁 272067
2. School of Energy and Materials Engineering, Shandong Polytechnic College, Jining 272067, China;
3. College of Basic Medicine, Jining Medical University, Jining 272067, China
海藻酸钙(calcium alginate, CA) 水凝胶网络形成能力较强,具有生物相容性、生物降解性、非抗原性等,在药物传递和控制释放领域受到了广泛的关注及应用[1]。海藻酸钠(sodium alginate, SA)与Ca2+离子交联很容易形成CA水凝胶[2]。SA作为线形聚阴离子多糖,其分子是由β-D-甘露糖醛酸(M单元)和α-L-古洛糖醛酸(G单元)通过1,4-糖苷键连接而成的共聚物,一个Ca2+离子可以与SA链上的两个G单元进行配位结合形成“蛋盒”结构[2]。但CA水凝胶网络容易收缩导致脱水[3],所载的活性成分也会随之排出而使活性降低。若利用透明质酸(hyaluronic acid, HA)钠盐与CA构筑复合凝胶,可以弥补上述CA水凝胶的不足。HA具有较强的吸水保水作用[4],其分子是由β-D-葡萄糖醛酸和β-D-N-乙酰氨基葡萄糖分子之间分别通过β-1,3-糖苷键和β-1,4-糖苷键相连形成双糖重复单元的长链多糖。HA水凝胶具有多孔性、水膨胀性、生物相容性、可生物降解性和抗非特异性细胞黏附性等[5]。在CA/HA凝胶体系中,加入羟丙基-β-环糊精(hydroxypropyl-β-cyclodextrin, HPCD)[6],利用其大环空腔对抗菌药物左氧氟沙星的包合作用,可更好地实现药物运转和控制释放。
1 资料与方法 1.1 试剂与仪器SA(天津市科密欧化学试剂有限公司);HPCD(上海源叶生物科技公司),其平均分子量为1541.54g/mol;无水氯化钙(天津市凯通化学试剂有限公司);透明质酸钠(上海源叶生物科技公司);Mueller-Hinton琼脂(杭州微生物试剂有限公司),大肠杆菌(ATCC25922)和金黄色葡萄球菌(ATCC25923)由济宁医学院病原生物学实验室提供。乳酸左氧氟沙星(北京亚赛尔科技有限公司),其它试剂均为分析纯。
JCM-7000 NeoScope TM台式扫描电子显微镜;Olympus BX51光学显微镜;PE/Frontier铂金埃尔默(英国)傅里叶红外光谱仪;RheoStress 6000 rheometer流变仪;German Bruker/D8ADVANCE X射线衍射仪。
1.2 复合凝胶的制备称取SA 0.1224g,透明质酸钠0.1020g,HPCD 0.06120g放入比色管中,加蒸馏水5ml,超声,于75℃下恒温搅拌3h,冷却到室温;再向比色管中滴加1ml 0.1mol/L CaCl2溶液,边滴边搅拌,直至凝胶形成。按上述程序操作,不加透明质酸钠,得到CA/HPCD凝胶样品,备用。将上述所得凝胶,置于冰箱内5℃冷藏24h,置于真空干燥箱内,保持低温-5℃减压干燥7d,得干凝胶样品。
1.3 复合凝胶的表征使用光学显微镜,观察凝胶样品的结构与形貌,拍照得到OM图片。将干凝胶进行喷金后,用电子扫描显微镜观察结构与形貌,拍照得SEM图。采用流变仪,在25℃进行动态应变扫描,在线性黏弹性范围内对凝胶样品扫频分析,平行测定3次结果求平均值。采用KBr压片法,使用红外光谱仪测定,得干凝胶样品红外光谱图。将干凝胶样品置于样品池,用X射线衍射仪扫描,记录谱图。
1.4 载药凝胶的制备配制一定浓度左氧氟沙星溶液,稀释成16μg/ml和4μg/ml两种稀溶液,然后分别加入0.06120g HPCD,溶解后放置暗处24h,形成包合液。称取SA 0.1224g和透明质酸钠0.1020g放入比色管中,搅拌下加入上述(16μg/ml或4μg/ml)包合液5ml,于75℃下恒温搅拌3h,冷却到室温;向比色管中滴入1ml 0.1mol/L CaCl2溶液,边滴边搅,直至载药凝胶形成。
1.5 载药凝胶的抑菌测试采用牛津杯法测试左氧氟沙星水凝胶的抑菌效果。左氧氟沙星载药量16μg/ml凝胶用于金黄色葡萄球菌抑菌测试,而载药量4μg/ml凝胶用于大肠埃希氏菌。将100μL药物凝胶、100μL空白对照凝胶和同浓度左氧氟沙星溶液(阳性对照)分别注入含有105CFU/ml测试菌株的有盖培养皿,在37℃下培育24h。测量凝胶斑点区的抑菌圈直径,3次平行测定求平均值。
2 结果与讨论 2.1 凝胶的微观形貌CA/HPCD鲜凝胶具有一些长条带状构成的网络结构(图 1a),带状宽度在1~25μm,长度可达560μm;CA/HA/HPCD鲜凝胶,同样是一些长条带状的网络结构(图 1b),其宽度变小,凝胶网络不那么致密,说明HA加入妨碍了SA与Ca2+的配位结合。CA/HPCD干凝胶的不规则长形块状结构(图 1c),其宽度从8μm到40μm左右不等,应该是鲜凝胶带状结构在冷冻干燥中受挤压造成的;而CA/HA/HPCD干凝胶,有一些更小的不规则碎薄片状结构(图 1d),形成更多的缝隙和空洞,可能是HA加入体系后吸收了更多水分,从而分隔了凝胶网络未能大量聚集。因此,在新型CA/HA/HPCD凝胶体系中,HA可能未能与Ca2+配位结合,反而是妨碍SA与Ca2+的配位结合,分隔其凝胶网络。
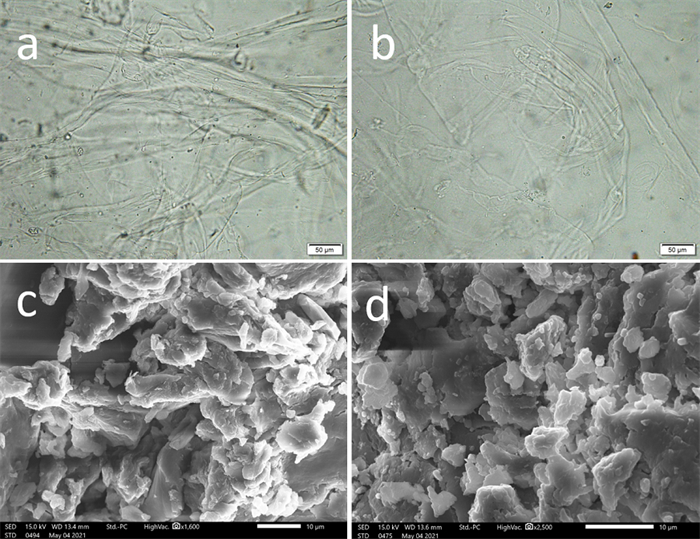
|
图 1 复合凝胶的光学显微镜照片(a, b)与电子扫描电镜图(c, d) 注:a和c,CA/HPCD凝胶;b和d,CA/HA/HPCD凝胶。 |
如图 2a所示,在1Pa外加应力下频率扫描测试,CA/HPCD水凝胶和CA/HA/HPCD水凝胶的G’和G”值并不随频率变化而变化(图 2a),且都保持G’>G”不变。这说明体系加入HA前后都具有正常的凝胶特性[7]。在频率1Hz下以指数形式施加应力,对上述两个水凝胶体系进行振幅扫描(图 2b),发现加入HA后,复合凝胶结构的应力屈服值从45Pa下降到了25Pa,CA/HA/HPCD水凝胶的G’值也有所降低,说明加入HA使得凝胶的黏弹性网络变弱[8],凝胶网络结构变得疏松。
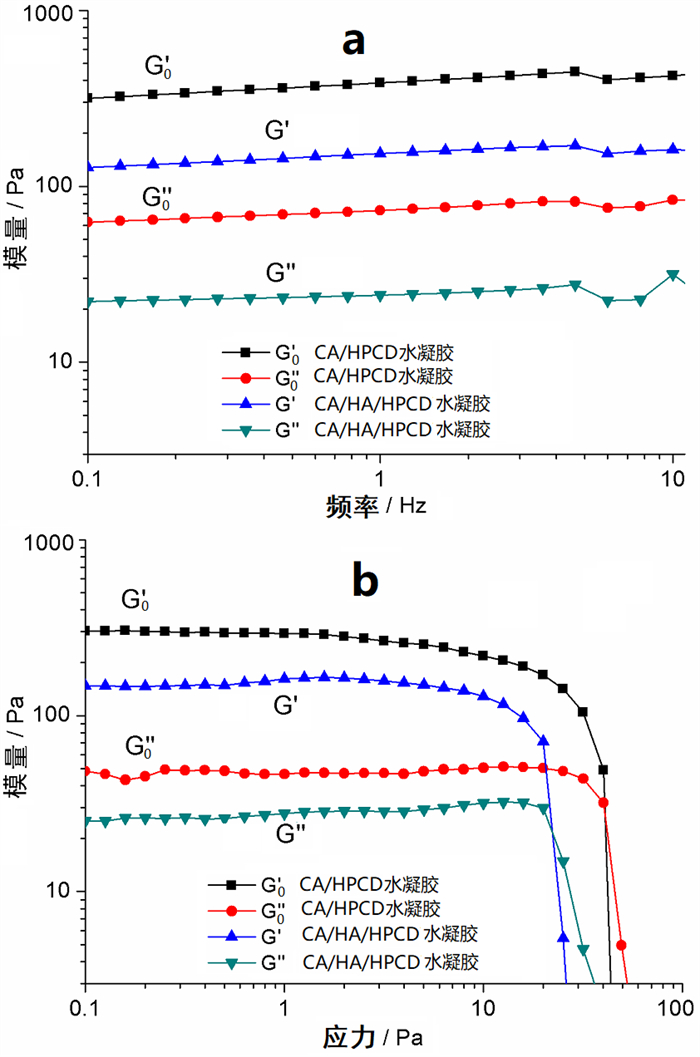
|
图 2 复合凝胶的动态流变图 注:a.频率扫描图;b.振幅扫描图。 |
一般地,红外光谱3100cm-1~3500cm-1吸收带归属为多糖分子O-H键伸缩振动吸收[5, 9],或N-H键伸缩振动吸收。如图 3a所示,CA/HA/HPCD复合凝胶在3415cm-1和3160cm-1处呈现一双谷宽峰,反映多糖分子O-H键振动吸收,与HA分子N-H键振动发生吸收峰交叠。其中,凝胶的3415cm-1处宽峰(图 3a)是原料SA(图 3c)分子O-H键3435cm-1吸收红移所致;而3160cm-1处宽峰(图 3a)是原料HA(图 3d)分子O-H键3393cm-1吸收和原料HPCD分子(图 3e)O-H键3412cm-1吸收红移所致。这说明凝胶内部多糖分子之间发生了O-H之间的氢键相互作用。对照CA/HPCD凝胶特征吸收3314cm-1处的宽峰(图 3b), 它是原料SA分子的O-H键3435cm-1吸收(图 3c)和原料HPCD分子O-H键3412cm-1吸收(图 3e)红移所致。观察图 3d发现,原料HA分子并未出现C=O的振动吸收(1730cm-1附近),不排除乙酰基已水解掉的可能[10]。
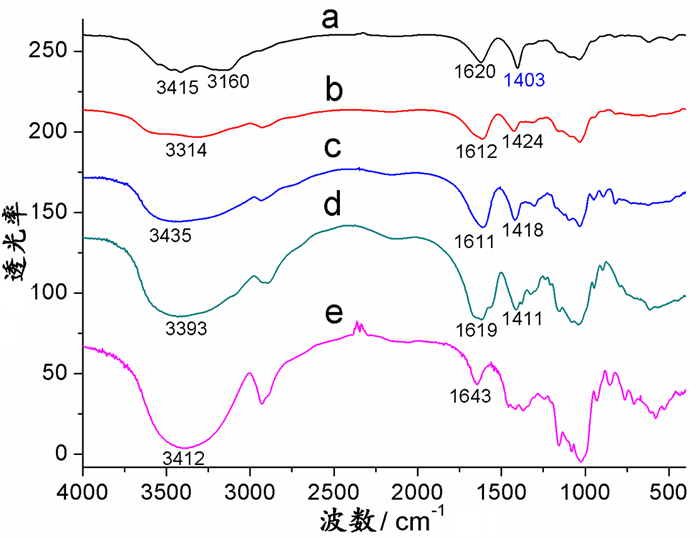
|
图 3 复合凝胶及其原料的红外光谱 注:a. CA/HA/HPCD干凝胶;b. CA/HPCD干凝胶;c. SA原料;d. HA原料;e. HPCD原料。 |
CA/HA/HPCD凝胶(图 3a)中1620cm-1和1403cm-1吸收峰,分别归属为羧基基团-C=O不对称伸缩振动和C-O对称振动吸收,对应着原料SA分子羧基中1611cm-1和1418cm-1(图 3c)吸收峰或原料HA分子羧基中1619cm-1和1411cm-1(图 3d)吸收改变所致。这说明凝胶内部SA分子羧基与Ca2+发生了配位结合,因SA分子与Ca2+发生配位竞争能力远大于HA分子的能力[11-12];另从流变学结果看,HA分子羧基与Ca2+未发生配位结合的可能性大。同样对比图 3b,CA/HPCD凝胶显出的1612cm-1和1024cm-1吸收峰,是原料SA分子羧基中1611cm-1和1418cm-1(图 3c)吸收峰的变化而来,说明凝胶内部SA分子羧基与Ca2+发生了强的配位结合。
2.4 X射线粉末衍射(XRD)谱图分析如图 4所示,CA/HA/HPCD凝胶在2θ值为19.0°处呈现一个较宽泛的峰(图 4a),CA/HPCD凝胶(图 4b)在20.95°处呈现一个较宽泛的峰,说明二者都具有无定形结构。而原料XRD图谱中,SA在13.8°和21.9°附近出现稍尖的衍射峰(图 4c),HA在12.3°和19.7°附近出现尖锐衍射峰(图 4d),HPCD在10.6°和18.4°处出现强的衍射峰(图 4e),表明这些原料均具有一定的晶体或半晶体性质[13]。形成凝胶后,原料失去了晶体性质,多糖分子相互纠缠在一起,生成无定形结构的凝胶。
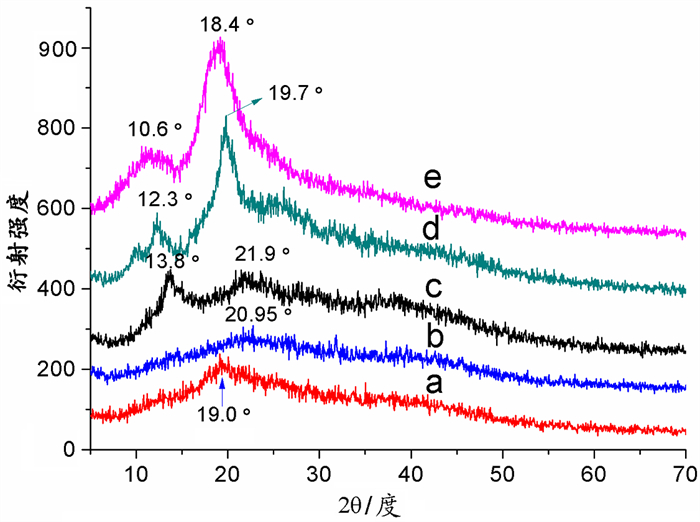
|
图 4 复合凝胶及其原料的XRD图谱对比 注:a. CA/HA/HPCD干凝胶;b. CA/HPCD干凝胶;c. SA原料;d. HA原料;e. HPCD原料。 |
采用抑菌圈法判定凝胶载药左氧氟沙星的抑菌效果。对于金黄色葡萄球菌和大肠埃希氏菌,其载药凝胶周围均出现清晰的抑菌圈,而空白凝胶周围均具有密集的细菌菌落。将抑菌圈相对大小(%)进行定量计算(图 5),对于金黄色葡萄球菌,CA/HA/HPCD载药凝胶斑点周围呈现的抑菌圈直径,相对于阳性对照达到了85.2%(图 5a);对于大肠埃希氏菌,CA/HA/HPCD载药凝胶斑点周围的抑菌圈直径,相对达到了91.7%(图 5b);这表明凝胶本身无抑菌作用,而装载左氧氟沙星的凝胶对细菌显示出显著的生长抑制作用。因此,CA/HA/HPCD复合水凝胶,可应用于抗菌药物制剂的工业生产。

|
图 5 CA/HA/HPCD载药凝胶和空白凝胶抑制菌株的抑菌圈定量分析 注:a. 金黄色葡萄球菌;b. 大肠埃希氏菌;将与载药凝胶中相同浓度左氧氟沙星作阳性对照,37℃下培育24h。 |
HA的生物兼容性和强亲水性,改善了新型CA/HA/HPCD水凝胶的微结构和性能。研究表明,原料SA与Ca2+离子配位结合形成CA的多糖链状和网状凝胶结构,而强吸水性的原料HA被困于其中而形成更多的空隙,使得复合水凝胶富含水分、硬度降低、黏弹性良好;同时利用了HPCD包合作用对药物分子进一步控制,有利于药物和活性成分的装载与运转;新型CA/HA/HPCD水凝胶应用于左氧氟沙星药物制剂,抑菌效果十分显著。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Shilova SV, Mirgaleev GM, Barabanov VP. Chitosan-Modified calcium alginate microspheres for cefotaxime immobilization[J]. Russ J Appl Chem, 2022, 95(3): 401-407. DOI:10.1134/S1070427222030090 |
| [2] |
Zhang X, Wang X, Fan W, et al. Fabrication, property and application of calcium alginate fiber: A review[J]. Polymers, 2022, 14: 3227. DOI:10.3390/polym14153227 |
| [3] |
Oerther S, Gall HL, Payan E, et al. Hyaluronate-alginate gel as a novel biomaterial: mechanical properties and formation mechanism[J]. Biotechnol Bioeng, 1999, 63(2): 206-215. DOI:10.1002/(SICI)1097-0290(19990420)63:2<206::AID-BIT9>3.0.CO;2-8 |
| [4] |
袁枝花, 刘有停, 曲召辉, 等. 基于透明质酸超分子特性对中药小分子化合物功能改进的研究进展[J]. 药学学报, 2022, 57(5): 1245-1251. DOI:10.16438/j.0513-4870.2021-1222 |
| [5] |
Vasi AM, Popa MI, Butnaru M, et al. Chemical functionalization of hyaluronic acid for drug delivery applications[J]. Mat Sci Eng C, 2014, 38: 177-185. DOI:10.1016/j.msec.2014.01.052 |
| [6] |
Tan J, Meng N, Fan Y, et al. Hydroxypropyl-β-cyclodextrin-graphene oxide conjugates: Carriers for anti-cancer drugs[J]. Mat Sci Eng C, 2016, 61: 681-687. DOI:10.1016/j.msec.2015.12.098 |
| [7] |
Shuai F, Zhang Y, Yin Y, et al. Fabrication of an injectable iron (Ⅲ) crosslinked alginate-hyaluronic acid hydrogel with shear-thinning and antimicrobial activities[J]. Carbohyd Polym, 2021, 260: 117777. DOI:10.1016/j.carbpol.2021.117777 |
| [8] |
Farrés IF, Norton IT. Formation kinetics and rheology of alginate fluid gels produced by in-situ calcium release[J]. Food Hydrocolloid, 2014, 40: 76-84. DOI:10.1016/j.foodhyd.2014.02.005 |
| [9] |
Mohan R, Mohan N, Vaikkath D. Hyaluronic acid dictates chondrocyte morphology and migration in composite gels[J]. Tissue Eng Part A, 2018, 24(19-20): 1481-1491. DOI:10.1089/ten.TEA.2017.0411 |
| [10] |
Zhou Z, Yang Z, Huang T, et al. Effect of chemical cross-linking on properties of gelatin/hyaluronic acid composite hydrogels[J]. Polym-Plast Technol, 2013, 52: 45-50. DOI:10.1080/03602559.2012.718400 |
| [11] |
Winter WT, Arnott S. Hyaluronic acid: the role of divalent cations in conformation and packing[J]. J Mol Biol, 1977, 117(3): 761-784. DOI:10.1016/0022-2836(77)90068-7 |
| [12] |
Yang Y, Campanella OH, Hamaker BR, et al. Rheological investigation of alginate chain interactions induced by concentrating calcium cations[J]. Food Hydrocolloid, 2013, 30: 26-32. DOI:10.1016/j.foodhyd.2012.04.006 |
| [13] |
Jeong SH, Koh YH, Kim SW, et al. Strong and biostable hyaluronic acid-calcium phosphate nanocomposite hydrogel via in situ precipitation process[J]. Biomacromolecules, 2016, 17(3): 841-851. DOI:10.1021/acs.biomac.5b01557 |



