2. 浙江中医药大学药学院,杭州 310053
2. College of Pharmacy, Zhejiang Chinese Medicine University, Hangzhou 310053, China
姜黄素(curcumin, CUR)是在姜科植物姜黄根茎中发现的天然活性成分,具有抗肿瘤、抗菌、抗炎与抗氧化等多种药理作用[1],但存在水溶性差、理化性质不稳定、生物利用度低等特点,应用领域受到限制。姜黄素药物制剂如水凝胶[2]、微凝胶[3]、核壳结构[4]、纳米纤维[5]等可有助于保持姜黄素的理化性质并提升药效。近年来,以颗粒稳定的Pickering乳液包载姜黄素对保持体系结构完整性、高效靶向性并完成特定药效功能具有明显优势[6-7]。不同于传统由小分子表面活性剂和单纯大分子稳定的乳液,大分子颗粒乳化剂稳定的Pickering乳液可在油水界面上排列、堆积、组装成为多样态的颗粒膜及三维桥架结构,而软颗粒可弯曲、堆叠、变形形成的动态空间更易于为姜黄素提供紧密的界面吸附层,特别是生物大分子胶体颗粒稳定的Pickering乳液,具有良好的生物相容性,极其适用于生物医药领域。本文从生物大分子软胶体颗粒界面自组装膜结构及其对包载姜黄素理化性质的影响,以及姜黄素Pickering乳液性质对其药效影响的研究进展做一综述。
1 生物相容性胶体颗粒膜结构对姜黄素Pickering乳液理化性质的影响蛋白质、多糖等生物大分子自组装形成的软胶体颗粒,在乳液的油水界面上可定向排列成紧密的单层/多层颗粒膜,界面膜的黏弹性、厚度可适当调控,从而使得乳液液滴在运动、碰撞、絮凝时不易崩溃而提升体系稳定性[8]。界面吸附层的厚度、黏弹性、柔软性、变形性与刺激响应性都能够影响包载姜黄素乳液的理化性质与靶向给药性。生物相容性软颗粒膜结构可提供良好的界面保护层,以增强Pickering乳液中姜黄素的生物利用度与药效活性。因此,由生物相容性胶体颗粒稳定的Pickering乳液能够为增强姜黄素的药效提供优良保障。
1.1 蛋白质颗粒稳定的乳液对姜黄素理化性质的影响蛋白质已经广泛用于医药包覆和生物医学工程材料,改性后可兼具亲水亲油性,能够组装成双亲性团聚体,而且蛋白质颗粒稳定的Pickering乳液具有稳定性高、生物相容性好等优点。醇溶性植物蛋白与水溶性球蛋白等分子之间,可通过特异性相互作用自组装成丰富的界面层结构,如球形、棒形、纤维、微凝胶以及中空结构的颗粒[9](图 1),更有利于包载水溶性较差的姜黄素,包封率达15%~17%。因此,由蛋白质胶体颗粒稳定的Pickering乳液包载姜黄素后使其性能更稳定。
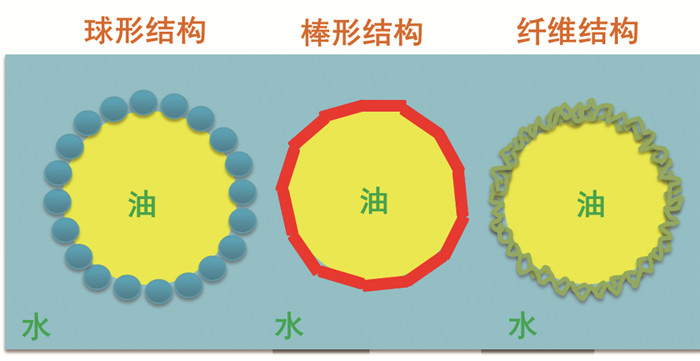
|
图 1 不同结构形态蛋白质稳定的Pickering乳液 |
将蛋白质适当改性可提升其双亲性能,比如:琥珀酰化与糖基化的乳清蛋白(WPH),在油水界面上的自组装体具有更强的空间位阻效应与静电斥力作用,可形成高弹性的三维网状结构,降低液滴之间的聚并程度,可使姜黄素的生物利用度达到65.57%[10],显著提升了其药效作用。同时,琥珀酰化与糖基化结合还可降低WPH的表面疏水性,增加分子的柔韧性,有利于提高界面膜的黏弹性与空间结构以更好地提升包载性能[11]。
不同形态、刚度和尺寸的α-乳蛋白自组装胶体颗粒对姜黄素的定向靶标性具有不同的影响,管形颗粒形成刚性颗粒膜结构,而球形纳米颗粒在油/水界面上有序堆积形成具有高黏弹性界面膜,这种柔韧性高的界面膜更有利于细胞的吞噬,从而提高细胞摄取率,能够促使姜黄素展现更高的生物利用度由游离姜黄素的1.22%提升到6.55%,提升了5倍多[12]。Pickering乳液中颗粒之间作用力使油水界面颗粒膜具有多个样态的排列,在等电点(4.5~5.0)下,乳清分离蛋白(WPI)凝胶颗粒在油水界面上絮凝、聚结形成具有高黏弹性的Pickering乳液凝胶状结构,对姜黄素包载率高达90.3%,且这类Pickering乳液凝胶具有紧密的类固相颗粒膜结构,有利于减缓姜黄素的释放,对胃蛋白酶的水解也具有更好的抗性[13]。由此可见,采用生物大分子形成的软胶体颗粒双亲性乳化剂,用于Pickering体系中开发具有适宜界面性质的颗粒膜来包载姜黄素可起到屏障与保护层作用,能够显著提高姜黄素的包封效率与生物利用度。
1.2 多糖稳定的乳液对姜黄素理化性质的影响多糖是自然界中特别丰富的生物大分子,具有环境友好、生物相容性好等优势,同时多糖药物剂型可为不宜使用蛋白的人群提供选择。常用作Pickering乳化剂的多糖包括淀粉、纤维素、壳聚糖、海藻酸钠、阿拉伯胶、甜菜果胶等,这些多糖在油水界面上自组装成球形、链状、棒状等各种颗粒膜空间结构,可发生可逆弯曲及折叠以稳定Pickering乳液,是姜黄素优良的包载体系[14]。
1.2.1 陆生植物源多糖稳定的乳液对姜黄素理化性质的影响淀粉和纤维素是来源于陆生植物的多糖。由于淀粉颗粒具有糊化特性,通过温度变化可调控两亲性淀粉颗粒的界面膜结构与形貌,从而调控姜黄素的包封率。热处理使可变性的淀粉分子呈链状彼此缠绕,并与相邻颗粒重叠或相互渗透(糊化),形成更致密的、高黏弹性的界面吸附层,从而增强其屏障效应。因此,经热处理后的淀粉颗粒Pickering乳液对姜黄素的封装稳定性优于未经过热处理的Pickering乳液[7]。以纤维素纳米晶和纤维素纳米纤丝协同稳定的Pickering乳液也可作为生物活性物质递送系统,包载姜黄素后明显延缓了其释药速率,短时间内的总释放率由40%降低至25%左右[14-15]。
1.2.2 动物源多糖稳定的乳液对姜黄素理化性质的影响壳聚糖(CS)是来源于低等动物如虾、蟹等外壳成分的多糖,其分子链上含有大量氨基,可与含醛基的分子发生化学反应,反应后的大分子界面自组装可形成具有高表面活性的醛-壳聚糖软胶体,通过调控氨基与醛基的相互作用,也可调节姜黄素乳液的包封率。比如,壳聚糖与香草醛(CA)偶联具有很强的共轭程度,表现出高的界面活性,可增强壳聚糖的界面覆盖率以形成更厚的界面吸附层,因此,CS/CA两亲性组装体使得姜黄素的释药减缓了42%[16],延长了可控释药周期。
1.2.3 水生植物源多糖稳定的乳液对姜黄素理化性质的影响海藻酸钠是从海洋褐藻类植物中提取的亲水性多糖,为聚阴离子线性分子结构。通过双丙酮丙烯酰胺对海藻酸钠进行疏水改性并与Ca2+交联,形成改性海藻酸钙颗粒负载姜黄素Pickering乳液,实现具pH响应的口服药物缓释制剂[17]。将海藻酸盐分子骨架中改性引入环糊精可构建光刺激响应性的超两亲性分子药物控释体系,以此用以包封姜黄素,通过紫外光照射可实现Pickering乳液中姜黄素的可控释放行为,紫外光照后,姜黄素的释放率从20%提升到50%[18]。
由此可见,多糖界面自组装稳定的Pickering乳液有助于提升姜黄素的负载率,并能够实现可控缓释。
1.3 蛋白、多糖复合体稳定的乳液对姜黄素理化性质的影响蛋白/多糖、多糖/多糖分子间的相互作用包括共价相互作用、静电相互作用、疏水相互作用、氢键、范德华力和空间排斥力等,这些相互作用可使蛋白质-多糖、多糖-多糖复合物体系表现为凝聚行为,此为设计具有特定结构和功能的多尺度蛋白质-多糖、多糖-多糖复合物提供帮助,对定向构建特殊功能性药物剂型以及精确调控药物活性也具有重要意义,还能拓宽天然生物医药载体的应用范围。因此,使用蛋白质-多糖、多糖-多糖复合纳米颗粒在油水界面上排列,形成多层界面膜空间结构包封姜黄素,为其提供更加致密的界面保护层,并表现出可控的动力学释放行为[19]。
通过明胶蛋白与阿拉伯胶多糖之间层层静电沉积的方式可调控界面膜的结构特性,多层界面吸附膜结构越厚,界面黏弹性越好,越能降低液滴之间的团聚与崩塌程度,可见多层界面膜稳定的Pickering乳液能够增强姜黄素的抗氧化活性。
带相反电荷的多糖聚合物之间,可通过静电相互作用形成具有更高的界面活性的软胶体颗粒,同样可以提高姜黄素Pickering乳液的稳定性。羧甲基纤维素(CMC)与季铵化壳聚糖(QCS)分子间通过静电作用力形成软胶体颗粒,其稳定的Pickering乳液表现凝胶状的流变行为,释放50%含量的姜黄素用时约160h。且在pH、温度等多种环境压力下,界面膜结构具有一定的抗压与抗皱性,能够高效抵抗液滴的崩塌与聚集,延缓释放姜黄素[6]。
具有复杂组成的界面膜结构对姜黄素乳液也具有更好的屏障效应。相对于乳清蛋白(CUR-EWPN)、葡聚糖/乳清蛋白复合物纳米凝胶颗粒(CUR-DxS+EWPN),由蛋白-葡聚糖偶联的微凝胶胶体(CUR-EWPDxM)稳定的姜黄素Pickering乳液具有更高的稳定性[20]。因为DxS+EWPN与EWPDxM在油滴表面形成更致密的界面膜结构,防止液滴之间的碰撞与聚结,增强Pickering乳液滴在胃环境下抗聚结的动力学稳定性。在pH为3~4.5下,酪蛋白(CN)与大豆多糖(SSPS)在水溶液中通过静电和疏水相互作用形成致密的复合聚集体,同时在油水界面上也可形成致密的CN/SSPS多层界面膜结构,由此软胶体稳定的载姜黄素乳液生物利用度比CUR/Tween20悬浊液高11倍[21]。玉米蛋白/羧甲基葡聚糖纳米颗粒(ZCPs)稳定的高内相Pickering乳液比单独的玉米蛋白纳米颗粒稳定乳液的效果更好,乳液表现为剪切稀释行为和弹性凝胶状结构,不仅在油滴周围形成了密集的包裹层,而且颗粒膜与连续相中的颗粒桥架连接形成高弹性的空间三维网状结构和高度多孔的界面膜结构,阻隔液滴间的接触聚并,使其保持姜黄素的结构完整性及抗氧化活性。因此,具有凝胶三维网状空间结构的高内相Pickering乳液能为姜黄素的理化性质稳定性提供更理想的剂型策略。
2 姜黄素Pickering乳液自身性能对药效的影响姜黄素的Pickering乳液性质对其药效活性具有重要影响。生物相容性胶体颗粒在油水界面上分配、排列、堆叠成高弹性界面膜,可以通过弯曲及折叠支撑各向异性的应力与应变,空间结构具有一定程度的柔韧性与变形性,能够增大Pickering乳液液滴与细胞膜之间的接触表面积,有利于两者之间的相互作用,增强其细胞渗透率[22]。因此,生物相容性胶体颗粒稳定的Pickering乳液具有增强姜黄素的药效活性,有效提高其抗癌、抗菌与抗炎等多种药理作用。
Pickering乳液本身凹凸不平的表面也有利于液滴与靶向细胞膜的相互作用,抑制细胞增殖和转移,而且还可以通过调节多种炎症因子、肿瘤坏死因子、转录因子、生长因子、蛋白激酶等诱导细胞凋亡以达到高效药理作用[23]。此外,连续相中胶体颗粒能形成三维空间网络结构,Pickering乳液表现剪切变稀行为,因此,Pickering乳液即使在高静态黏度时也可以喷雾给药,使药液与伤口部位的紧密贴合和长时间作用,达到良好的伤口外敷药效[24]。生物相容性颗粒稳定的Pickering乳液载药体系具有更高的皮肤渗透性,装载姜黄素的药物可以快速穿过角质层,然后进入真皮和皮下组织,防止皮肤进一步感染,提高姜黄素的生物利用度,展示高效的抗炎作用。
2.1 姜黄素Pickering乳液抗癌活性姜黄素可以通过抑制肿瘤细胞增殖、侵袭与转移,诱导肿瘤细胞凋亡、自噬、免疫调节等多重药理作用及分子机制达到抗癌药效[25]。酶解木质素/壳寡糖(EHL/COS-x)分子间静电自组装并负载亲水性阿糖胞苷(Ara-C)化疗药物的复合纳米颗粒,可以形成高弹性、高内相Pickering乳液(HIPEs)凝胶结构,乳液液滴具有应变力以增强与细胞膜的相互作用,对姜黄素高效靶向作用肿瘤细胞,并在肿瘤环境中表现良好的pH刺激响应性。在肿瘤微环境中,pH=7.4磷酸盐缓冲液120h后,从HIPEs中累积释放姜黄素的比例为35%;pH=6.0时,15h后累积释放率提高至93.0%[26]。多相Pickering乳液结构具有双层界面膜结构,具有更大的界面膜接触面积,可增强甜菜素与姜黄素对A549癌细胞的协同抗肿瘤作用[27]。因此,生物相容性胶体颗粒稳定的多相Pickering乳液有望成为姜黄素的新型药物载体有效增强药效药理作用。
2.2 姜黄素Pickering乳液抗菌活性姜黄素具有抑制金黄色葡萄球菌、链球菌、乳酸杆菌等多种细菌和某些致病真菌生长的潜力。生物相容性的赖氨酸改性酶解木质素(EHL-Lys-2.0)对20mg/mL的金黄色葡萄球菌和大肠杆菌的杀菌效果分别为93%和50%,因为EHL-Lys-2.0与细菌之间增加的静电相互作用可促进其吸附量和黏附力,提高了EHL-Lys-2.0的抗菌活性。利用EHL-Lys-2.0与烷基糖苷(APG)结合稳定含姜黄素的高内相Pickering乳液(HIPEs-cur),具有高黏弹性的凝胶状结构,可增强姜黄素的生物利用度。该HIPEs中姜黄素残留量是经紫外光照射处理后的60倍,热发射处理后的3倍,储存处理后的5倍。HIPEs-cur对金黄色葡萄球菌和大肠杆菌的最低抑菌浓度分别为1.56和6.25mg/mL,远高于纯EHL-Lys-2.0抑菌浓度[28]。细菌感染会引起伤口发炎、延缓伤口愈合以及造成慢性伤口等问题,革兰氏阴性大肠杆菌、革兰氏阳性金黄色葡萄球菌和革兰氏阳性耐甲氧西林金黄色葡萄球菌是伤口感染中的常见菌种。在5h后,空白对照组的大肠杆菌和金黄色葡萄球菌形态依然饱满光滑,而壳聚糖胶体颗粒稳定的姜黄素Pickering乳液处理的大肠杆菌和金黄色葡萄球菌的菌体表面出现凹陷或皱缩,形态遭到破坏,表明姜黄素Pickering乳液可以清除细菌生物膜,对大肠杆菌和金黄色葡萄球菌均具有破坏性,干扰细菌的正常生长,抗菌效果显著。可见,生物相容性胶体颗粒稳定的姜黄素Pickering乳液本身兼具一定的抗菌能力,能与姜黄素协同作用,抗菌效果得到增强。
2.3 姜黄素Pickering乳液抗炎与抗氧化性姜黄素具有很好的抗炎抗氧化效果[29]。在肠道炎症性疾病中,姜黄素Pickering乳液展现更好的应变学形变,可增强其与细胞膜的相互作用。在姜黄素/羧甲基纤维素Pickering乳液处理的小鼠中,肠道外植体培养物中,促炎细胞因子释放量显著减少,证明在白细胞介素(IL-10)基因缺陷体系中,姜黄素可通过减少促炎黏膜细胞因子的产生而显现优越的抗炎作用[30]。同时,姜黄素具有酚羟基和羰基结构,可以作为质子供体,阻断氧化反应中自由基链式反应,所以姜黄素具有抗氧化活性。以蛋清蛋白微凝胶颗粒为乳化剂制备的载姜黄素高内相Pickering乳液,当姜黄素浓度为300mg/L时,乳液的DPPH自由基清除率为76.7%,说明姜黄素在高内相乳液中的抗氧化性能比纯油中的姜黄素体系的更优。这可能是因为高内相乳液的黏弹性、凝胶性更好,更易于形成三维网状的凝胶结构,呈现出良好的稳定性。因此,Pickering乳液界面膜包埋不仅可以保护姜黄素免于降解,还可以提升其抗氧化活性。
3 小结与展望为提升姜黄素的药效及扩展应用,不断开发新剂型非常必要,同时如何在体内精准靶向传递姜黄素,并进行乳液载体的结构,形态与功能一体化的设计也将是值得思索,探究的科学问题。本文总结了生物相容性软胶体颗粒膜的形成、结构及对姜黄素的理化性质与药效影响的研究进展,阐述了界面膜结构与姜黄素的理化性质及与药效的关系。相比于具有高强度的刚性颗粒排列的界面膜结构,生物基软颗粒弯曲、堆叠、变形形成的柔性动态空间结构更易于为姜黄素提供紧密的界面屏障,以及增强其与细胞之间的相互作用力。因此,生物大分子软胶体颗粒排列而成的Pickering乳液制剂为胶体与界面科学,与生物医学建立了一座新的桥梁,为提升姜黄素的理化性质和药效作用提供了一种优异的技术途径。综合来看,已有研究也存在着一些不足之处,如:生物大分子组装的界面膜的结构调控机制及其对姜黄素生物活性的影响规律有待进一步揭示;Pickering乳液剂型有待进一步优化以更高地提升姜黄素的药效;纳米技术等多项新技术有待与姜黄素Pickering乳液进一步融合,以提高姜黄素在体内的靶标定向性,为此应深入开展体外和体内实验研究。期望这些疑问逐步揭示,能够进一步发展生物相容性颗粒稳定的负载姜黄素或其他药物的兼具靶向等多重功能的Pickering乳液,拓展其在生物医学领域的应用。近年来,大量病原体,如病毒、致病菌以及肿瘤细胞等都是具备黏弹性或易发生应力性形变的软物质,弥漫全球,如何增强其与细胞的接触面积,从而强化免疫细胞识别是未来值得探究的科学问题。若将生物基大分子自组装的软胶体颗粒稳定的乳液为“底盘”进行柔性佐剂的构建,可优化其免疫激活性能。形成一种结构可调、免疫活性高的新型疫苗,以应对疫苗产业发展和疫情防控应急预案等需求,同时可满足国家对于科研创新发展的顶层设计与产学研一体化发展的战略布局。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
王海英, 张宇琪, 孙昊天, 等. 姜黄素及其衍生物的作用及机制[J]. 生理科学进展, 2022, 53(4): 271-275. |
| [2] |
Sood A, Dev A, Das SS, et al. Curcumin-loaded alginate hydrogels for cancer therapy and wound healing applications: a review[J]. Int J Biol Macromol, 2023, 232: 123283. DOI:10.1016/j.ijbiomac.2023.123283 |
| [3] |
Kulkarni AS, Tapase SR, Kodam KM, et al. Thermoresponsivepluronic based microgels for controlled release of curcumin against breast cancer cell line[J]. Colloid Surface B, 2021, 205: 111834. DOI:10.1016/j.colsurfb.2021.111834 |
| [4] |
Lin D, Xiao L, Qin W, et al. Preparation, characterization and antioxidant properties of curcumin encapsulated chitosan/lignosulfonate micelles[J]. Carbohydr Polym, 2022, 281: 119080. DOI:10.1016/j.carbpol.2021.119080 |
| [5] |
Liu Y, Chen X, Gao Y, et al. Electrospun core-sheath nanofibers with variable shell thickness for modifying curcumin release to achieve a better antibacterial performance[J]. Biomolecules, 2022, 12: 1057. DOI:10.3390/biom12081057 |
| [6] |
Zhu X, Chen J, Hu Y, et al. Tuning complexation of carboxymethyl cellulose/cationic chitosan to stabilize Pickering emulsion for curcumin encapsulation[J]. Food Hydrocoll, 2020, 110: 106135. DOI:10.1016/j.foodhyd.2020.106135 |
| [7] |
Marefati A, Bertrand M, Sjoo M, et al. Storage and digestion stability of encapsulated curcumin in emulsions based on starch granule Pickering stabilization[J]. Food Hydrocoll, 2016, 63: 309-320. DOI:10.1016/j.foodhyd.2016.08.043 |
| [8] |
Cui F, Zhao S, Guan X, et al. Polysaccharide-based Pickering emulsions: formation, stabilization and applications[J]. Food Hydrocoll, 2021, 119: 106812. DOI:10.1016/j.foodhyd.2021.106812 |
| [9] |
Wang Z, Zhang N, Chen C, et al. Rapeseed protein nanogels as novel Pickering stabilizers for oil-in-water emulsions[J]. J Agric Food Chem, 2020, 68(11): 3607-3614. DOI:10.1021/acs.jafc.0c00128 |
| [10] |
Pan Y, Li XM, Meng R, et al. Investigation of the formation mechanism and curcumin bioaccessibility of emulsion gels based on sugar beet pectin and laccase catalysis[J]. J Agric Food Chem, 2021, 69(8): 2557-2563. DOI:10.1021/acs.jafc.0c07288 |
| [11] |
Pan Y, Li XM, Meng R, et al. Exploration of the stabilization mechanism and curcumin bioaccessibility of emulsions stabilized by whey protein hydrolysates after succinylation and glycation in different order[J]. J Agric Food Chem, 2020, 68(2): 623-632. DOI:10.1021/acs.jafc.9b07350 |
| [12] |
Liu B, Liu B, Wang R, et al. α-Lactalbumin self-assembled nanoparticles with various morphologies, stiffnesses, and sizes as Pickering stabilizers for oil-in-water emulsions and delivery of curcumin[J]. J Agric Food Chem, 2021, 69(8): 2485-2492. DOI:10.1021/acs.jafc.0c06263 |
| [13] |
Lv P, Wang D, Dai L, et al. Pickering emulsion gels stabilized by high hydrostatic pressure-induced whey protein isolate gel particles: characterization and encapsulation of curcumin[J]. Food Res Int, 2020, 132: 109032. DOI:10.1016/j.foodres.2020.109032 |
| [14] |
Yang Y, Jiao Q, Wang L, et al. Preparation and evaluation of a novel high internal phase Pickering emulsion based on whey protein isolate nanofibrils derived by hydrothermal method[J]. Food Hydrocoll, 2022, 123: 107180. DOI:10.1016/j.foodhyd.2021.107180 |
| [15] |
罗钰湲, 张欢, 陈媛, 等. 柠檬籽纤维素纳米晶/纳米纤丝协同稳定Pickering乳液包埋姜黄素研究[J]. 食品与发酵工业, 2021, 9: 1-9. DOI:10.13995/j.cnki.11-1802/ts.028953 |
| [16] |
Chen H, Zhao R, Hu J, et al. One-step dynamic imine chemistry for preparation of chitosan-stabilized emulsions using a natural aldehyde: acid trigger mechanism and regulation and gastric delivery[J]. J Agric Food Chem, 2020, 68(19): 5412-5425. DOI:10.1021/acs.jafc.9b08301 |
| [17] |
孙肖. 基于海藻酸钠的Pickering乳液及其释药行为[D]. 大连: 大连理工大学, 2017.
|
| [18] |
Zhao XY, Fang XQ, Yang SJ, et al. Light-tuning amphiphility of host-guest Alginate-based supramolecular assemblies for photo-responsive Pickering emulsions[J]. Carbohydr Polym, 2021, 251: 117072. DOI:10.1016/j.carbpol.2020.117072 |
| [19] |
Zhao T, Huang K, Luo Y, et al. Preparation and characterization of high internal phase Pickering emulsions stabilized by hordein-chitosan composite nanoparticles[J]. Colloid Surface A, 2023, 659(20): 130766. DOI:10.1016/j.colsurfa.2022.130766 |
| [20] |
Araiza-Calahorra A, Wang Y, Boesch C, et al. Pickering emulsions stabilized by colloidal gel particles complexed or conjugated with biopolymers to enhance bioaccessibility and cellular uptake of curcumin[J]. Current Res Food Sci, 2020, 3: 178-188. DOI:10.1016/j.crfs.2020.05.001 |
| [21] |
Xu G, Wang C, Yao P, et al. Stable emulsion produced from casein and soy polysaccharide compacted complex for protection and oral delivery of curcumin[J]. Food Hydrocoll, 2017, 71: 108-117. DOI:10.1016/j.foodhyd.2017.05.010 |
| [22] |
Xia Y, Wu J, Wei W, et al. Exploiting the pliability and lateral mobility of Pickering emulsion for enhanced vaccination[J]. Nat Mater, 2018, 17: 187-194. DOI:10.1038/NMAT5057 |
| [23] |
Duncan B, Li X, Landis RF, et al. Nanoparticle stabilized capsules for the treatment of bacterial biofilms[J]. ACS Nano, 2015, 9(8): 7775-7782. DOI:10.1021/acsnano.5b01696 |
| [24] |
Asfour MH, Elmotasem H, Mostafa DM, et al. Chitosan based Pickering emulsion as a promising approach for topical application of rutin in a solubilized form intended for wound healing: In vitro and in vivo study[J]. Inter J of Pharma, 2017, 534: 325-338. DOI:10.1016/j.ijpharm.2017.10.044 |
| [25] |
李琼, 贺延苓, 张志敏. 姜黄素的抗癌生物学机制研究进展[J]. 药物生物技术, 2021, 28(2): 217-220. DOI:10.19526/j.cnki.1005-8915.20210220 |
| [26] |
Chen K, Qian Y, Wang C, et al. Tumor microenvironment-responsive, high internal phase Pickering emulsions stabilized by lignin/chitosan oligosaccharide particles for synergistic cancer therapy[J]. J Colloid Interface Sci, 2021, 591: 352-362. DOI:10.1016/j.jcis.2021.02.012 |
| [27] |
Tang XY, Wang ZM, Meng HC, et al. Robust W/O/W emulsion stabilized by genipin-cross-linked sugar beet pectin-bovine serum albumin nanoparticles: co-encapsulation of betanin and curcumin[J]. J Agric Food Chem, 2021, 69(4): 1318-1328. DOI:10.1021/acs.jafc.0c05212 |
| [28] |
Chen K, Yuan SR, Wang D, et al. Curcumin-loaded high internal phase emulsions stabilized with lysine modified lignin: a biological agent with high photothermal protection and antibacterial properties[J]. Food Funct, 2021, 12: 7469-7479. DOI:10.1039/D1FO00128K |
| [29] |
赵容山, 梁伟坚, 邓炜聪, 等. 姜黄素通过抗氧化应激保护成骨细胞功能的作用机制研究[J]. 天然产物研究与开发, 2022, 34(8): 1311-1318. DOI:10.16333/j.1001-6880.2022.8.005 |
| [30] |
Ung VYL, Foshaug RR, Macfarlane SM, et al. Oral administration of curcumin emulsified in carboxymethyl cellulose has a potent anti-inflammatory effect in the IL-10 gene-deficient mouse model of IBD[J]. Dig Dis Sci, 2010, 55(5): 1272-1277. DOI:10.1007/s10620-009-0843-z |



