下咽癌是头颈肿瘤中预后较差的恶性肿瘤,易发生颈淋巴结转移和远处转移,转移是下咽癌患者死亡的主要原因,5年生存率仅为15%~45%[1]。缺氧在实体肿瘤中普遍存在,并在肿瘤转移中发挥重要作用[2]。HIF-1α是调控细胞对缺氧反应的重要因子,可促进肿瘤的增殖、迁移和侵袭[3]。本研究拟探讨HIF-1α基因沉默对缺氧环境人下咽癌FaDu细胞增殖、迁移和侵袭的影响及其机制,为下咽癌的预防和靶向治疗提供理论依据。
1 材料与方法 1.1 材料 1.1.1 细胞人下咽癌FaDu细胞系购于美国菌种保藏中心。
1.1.2 试剂六水合二氯化钴(CoCl2·6H2O)(美国Sigma公司);胎牛血清(FBS),胰蛋白酶(美国Gibico公司);BCA蛋白浓度检测试剂盒,SDS-PAGE凝胶试剂盒(上海碧云天生物技术有限公司);Transwell小室,MatrigelTM基质胶(美国BD公司);Lipofectamine-RNA MAX转染试剂(美国Invitrogen公司);HIF-1α siRNA(上海吉玛制药技术有限公司);鼠抗人HIF-1α单克隆抗体(美国Cell Signaling公司);基质金属蛋白酶-2(MMP-2)抗体(美国Proteintech公司);β-actin抗体(北京中杉金桥生物技术有限公司);DMEM/F-12(1∶1)培养基,Opti-MEM优化培养基(美国Gibco公司)。
1.2 方法 1.2.1 细胞培养及缺氧模型建立将冻存的人下咽癌FaDu细胞复苏后,放入含有10% FBS的DMEM培养基的培养皿中,37℃ 5%CO2培养箱中培养。
应用200μmol/L CoCl2诱导人下咽癌FaDu细胞缺氧,建立化学缺氧模型[4]。人下咽癌FaDu细胞随机分为对照组(常氧)、CoCl2组(缺氧)、CoCl2+Cki组(缺氧+转染空质粒)和CoCl2+HIF-1αi组(缺氧+转染HIF-1α siRNA),每组设平行3个孔,所有实验重复3次。
1.2.2 siRNA转染在6孔板中种植3×105细胞数/孔,待细胞融合达到60%~80%时进行HIF-1α siRNA转染;将HIF-1αsiRNA与Lipofectamine-RNA MAX转染试剂的混合液缓慢加入细胞培养基中,放置于37℃培养箱中培养;待细胞继续培养24~72h后,收集细胞备用。
1.2.3 划痕实验常规细胞培养,待处于对数生长期时用200μl枪尖轻轻划铺满培养皿底部的细胞,造成划痕空白区,加入含1% FBS的DMEM培养基,倒置显微镜下观察拍照,并标记位置,37℃培养箱中继续培养24h,倒置显微镜下观察拍照各组划痕空白区的变化来判断细胞的运动能力。
1.2.4 Transwell迁移实验取各组人下咽癌FaDu细胞制成细胞悬液;取4.0×106/ml浓度的细胞悬液250μl加入Transwell小室的上室,下室加入含20% FBS的DMEM培养基750μl作为化学引诱物,每组设置3个复孔,放入37℃孵箱中继续培养24h,将小室放入500μl 4%多聚甲醛溶液中固定,室温放置15min,将小室放入500μl 0.1%结晶紫溶液中染色,室温放置25min,将小室置于正置光学显微镜下观察,随机抓取5个视野(×100)拍照并观察各组穿透细胞数。
1.2.5 Transwell侵袭实验Transwell小室的上室加入21μl Matrigel基质胶稀释液,放入37℃培养箱中,孵育30min,以下步骤同迁移实验。
1.2.6 Western blot检测收集各组人下咽癌FaDu细胞,RIPA细胞裂解缓冲液裂解细胞,提取细胞的总蛋白,BCA法测定蛋白浓度,蛋白变性,经SDS-PAGE凝胶电泳分离蛋白并转至PVDF膜,5%脱脂奶粉封闭蛋白,分别加入一抗稀释液HIF-1α (1∶500)、MMP-2(1∶1000)和β-actin (1∶20000) 孵育,4℃冰箱过夜,加入二抗稀释液室温孵育,ECL发光,暗室胶片显影,扫描胶片后应用Image J图像分析软件进行图像分析。
1.3 统计学方法数据分析采用GraphPadPrism7软件进行统计分析,正态分布的计量资料以x±s表示,两组间比较采用Bonferroni校正t检验,多组间比较采用方差分析。以P<0.05为差异有统计学意义。
2 结果 2.1 HIF-1α基因沉默对缺氧环境人下咽癌FaDu细胞增殖的影响与对照组相比,CoCl2组人下咽癌FaDu细胞增殖显著增加(t=4.477, P=0.011);与CoCl2组相比,CoCl2+Cki组人下咽癌FaDu细胞增殖差异无统计学意义(t=2.081, P>0.05);与CoCl2组相比,CoCl2+ HIF-1αi组人下咽癌FaDu细胞增殖显著减小(t=7.040,P=0.0021)。见图 1。

|
图 1 各组人下咽癌FaDu细胞增殖情况(×100) 注:与对照组相比,*P<0.05;与CoCl2组相比,#P>0.05;与CoCl2组相比,**P<0.01 |
与对照组相比,CoCl2组人下咽癌FaDu细胞迁移数显著增加(t=3.814,P=0.0189);与CoCl2组相比,CoCl2+Cki组人下咽癌FaDu细胞迁移数差异无统计学意义(t=1.194,P>0.05);与CoCl2组相比,CoCl2+HIF-1αi组人下咽癌FaDu细胞迁移数显著减小(t=8.100,P=0.0013)。见图 2。

|
图 2 各组人下咽癌FaDu细胞迁移情况(×100) 注:与对照组相比,*P<0.05;与CoCl2组相比,#P>0.05;与CoCl2组相比,**P<0.01 |
与对照组相比,CoCl2组人下咽癌FaDu细胞侵袭数显著增加(t=3.392,P=0.0275);与CoCl2组相比,CoCl2+Cki组人下咽癌FaDu细胞侵袭数差异无统计学意义(t=2.441, P>0.05);与CoCl2组相比,CoCl2+HIF-1αi组人下咽癌FaDu细胞侵袭数显著减小(t=7.938,P=0.0014)。见图 3。

|
图 3 各组人下咽癌FaDu细胞侵袭情况(×100) 注:与对照组相比,*P<0.05;与CoCl2组相比,#P>0.05;与CoCl2组相比,**P<0.01 |
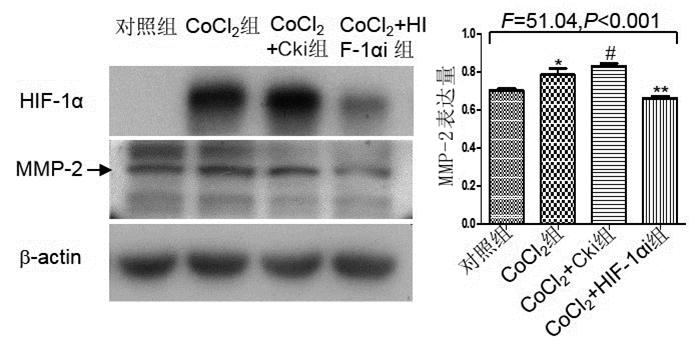
与对照组相比,CoCl2组人下咽癌FaDu细胞MMP-2表达显著增加(t=4.424, P<0.05);与CoCl2组相比,CoCl2+Cki组人下咽癌FaDu细胞MMP-2表达差异无统计学意义(t=2.352, P>0.05);与CoCl2组相比,CoCl2+HIF-1αi组人下咽癌FaDu细胞MMP-2表达显著减小(t=6.496,P=0.0029)。见图 4。
|
图 4 各组人下咽癌FaDu细胞MMP-2表达情况 注:与对照组相比,*P<0.05;与CoCl2组相比,#P>0.05;与CoCl2组相比,**P<0.01 |
缺氧微环境是实体肿瘤发展过程中常见的肿瘤微环境,是由于肿瘤的过度生长和血液中氧的供应不足引起的[5]。HIF-1是缺氧微环境中起主要作用的转录因子,可调节细胞适应缺氧状态,并参与多种与肿瘤增殖、迁移、侵袭和转移相关靶基因的调控[3]。细胞外基质降解是肿瘤侵袭和转移重要步骤,主要由基质金属蛋白酶如MMP-2和MMP-9等参与完成[6-7]。
缺氧可通过活化Rab5促进肿瘤的迁移、侵袭和转移[8]。缺氧可通过HIF-1α-MTDH环路促进肿瘤的迁移和侵袭[3]。本研究缺氧可显著增加人下咽癌FaDu细胞的增殖、迁移细胞数和侵袭细胞数,说明缺氧促进人下咽癌FaDu细胞的增殖、迁移和侵袭。本研究也发现,缺氧环境人下咽癌FaDu细胞MMP-2表达明显升高,说明缺氧可上调人下咽癌FaDu细胞中MMP-2表达,促进人下咽癌FaDu细胞的迁移和侵袭。
HIF-1α表达沉默可明显降低细胞的迁移和侵袭能力,并可降低细胞中MMP-2、MMP-9表达[9]。本研究发现,HIF-1α沉默可降低缺氧环境人下咽癌FaDu细胞的增殖、迁移和侵袭能力,HIF-1α沉默可降低缺氧环境人下咽癌FaDu细胞中MMP-2表达,说明缺氧可通过HIF-1α上调人下咽癌FaDu细胞中MMP-2表达。
综上所述,缺氧微环境在下咽癌的增殖、迁移和侵袭中发挥重要作用,HIF-1α基因沉默可抑制缺氧环境人下咽癌FaDu细胞增殖、迁移和侵袭,并降低人下咽癌FaDu细胞MMP-2表达,HIF-1α有可能成为阻断下咽癌侵袭和转移的新靶点。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Takes RP, Strojan P, Silver CE, et al. Current trends in initial management of hypopharyngeal cancer: the declining use of open surgery[J]. Head Neck, 2012, 34(2): 270-281. DOI:10.1002/hed.21613 |
| [2] |
Li Y, Zhao L, Li XF. Hypoxia and the tumor microenvironment[J]. Technol Cancer Res Treat, 2021, 20: 1-9. DOI:10.1177/15330338211036304 |
| [3] |
Zhu G, Peng F, Gong W, et al. Hypoxia promotes migration/invasion and glycolysis in head and neck squamous cell carcinoma via an HIF 1α MTDH loop[J]. Oncol Rep, 2017, 38(5): 2893-2900. DOI:10.3892/or.2017.5949 |
| [4] |
Bu M, Liu X, Liu X, et al. Upregulation of fascin-1 is involved in HIF-1α-dependent invasion and migration of hypopharyngeal squamous cell carcinoma[J]. Int J Oncol, 2019, 55(2): 488-498. DOI:10.3892/ijo.2019.4827 |
| [5] |
Shay JE, Celeste Simon M. Hypoxia inducible factors: Crosstalk between inflammation and metabolism[J]. Semin Cell Dev Biol, 2012, 23(4): 389-394. DOI:10.1016/j.semcdb.2012.04.004 |
| [6] |
Buttacavoli M, Di Cara G, Roz E, et al. Integrated multi-omics investigations of metalloproteinases in colon cancer: focus on MMP2 and MMP9[J]. Int J Mol Sci, 2021, 22(22): 12389. DOI:10.3390/ijms222212389 |
| [7] |
Gilkes DM, Semenza GL, Wirtz D. Hypoxia and the extracellular matrix: Drivers of tumour metastasis[J]. Nat Rev Cancer, 2014, 14(6): 430-439. DOI:10.1038/nrc3726 |
| [8] |
Silva P, Mendoza P, Rivas S, et al. Hypoxia promotes Rab5 activation, leading to tumor cell migration, invasion and metastasis[J]. Oncotarget, 2016, 7(20): 29548-29562. DOI:10.18632/oncotarget.8794 |
| [9] |
Fujiwara S, Nakagawa K, Harada H, et al. Silencing hypoxia-inducible factor-1alpha inhibits cell migration and invasion under hypoxic environment in malignant gliomas[J]. Int J Oncol, 2007, 30(4): 793-802. |

