肝纤维化(hepatic fibrosis,HF)是各种慢性致病因素引起的肝脏损伤和炎症后组织修复代偿的病理过程。肝细胞外基质(extra cellular matrix,ECM)成分的异常沉积造成纤维化,纤维化致使肝脏结构的破坏和肝功能的丧失[1],如果不及时干预将导致肝脏结构严重不可逆的改变,最后演变为肝硬化,增加患肝癌等重大疾病的风险[2]。
早期肝纤维化是可逆的[3],因此,在肝纤维化演变为肝硬化甚至肝癌之前治疗尤为重要[4]。目前,有多种临床药物用于治疗肝纤维化[5]。然而,临床药物大多为西药,西药往往只针对单个基因/蛋白,而且会诱发许多不良反应。由于肝纤维化复杂的病理生理学机制,临床实践中尚缺乏特异有效的西药[6-7],因此, 寻找低毒性、高效的药物尤为迫切。现阶段已在天然产物中发现了大量的活性成分,这些成分表现出结构多样性和较低的不良反应,为肝纤维化的治疗提供了新的思路[8]。
槐米(Flos Sophorae Immaturus,FSI)为豆科植物槐Sophora japonica L.的干燥花蕾,它的主要成分有芦丁、槲皮素等黄酮类化合物。具有凉血止血,清肝泻火的功效,在体外的药理研究中,槐米提取物对于肝脏组织的抗脂质过氧化作用明显高于其他中药提取物[9]。从天然物质中提取的许多黄酮类化合物如:橙皮素类,木樨草素等对肝纤维化具有显著的抑制效果[10-12]。因此, 根据槐米提取物药理特点,推测槐米提取物对于肝纤维化具有治疗作用,本研究设计实验将槐米的提取物用以肝纤维化小鼠的治疗,探讨其对肝纤维化的影响。
1 材料与方法 1.1 材料 1.1.1 仪器生物显微镜B204LED(重庆奥特光学仪器有限责任公司);电热恒温水浴锅DK-S24(上海精宏实验设备有限公司);Leica切片机RM2016 (leica显微系统有限公司);超高速冷冻离心机20161996 (Thermo Fisher科技有限公司); 多功能微孔板检测仪Synergy H1 (BioTek Instruments, Inc);微孔板振荡器MIX-1500 (杭州米欧仪器有限公司);电热恒温干燥箱202-OB (绍兴力诚仪器科技有限公司);电子天平BS224-S (北京赛多利斯仪器有限公司);Haier低温保存箱DW-86L578ST (海尔生物医疗股份有限公司)。
1.1.2 试剂水合氯醛(天津市大茂化学试剂厂,20211115);中性树胶(国药集团化学试剂有限公司,20160222);磷酸氢二钠(天津市凯通化学试剂有限公司,20190914);磷酸二氢钠(上海广诺化学科技有限公司,20190322);二甲苯(天津市富宇精细化工有限公司,20210801);高效切片石蜡(上海华灵康复器械厂,20210618);无水乙醇(天津市富宇精细化工有限公司,20210906);苏木素-伊红染色液(南京建成科技有限公司);Masson染色液(南京建成科技有限公司);天狼猩红染色液(南京建成科技有限公司);GOT试剂盒(微板法,南京建成生物工程研究所);GPT试剂盒(微板法,南京建成生物工程研究所);丙二醛测定试剂盒(TBA法,南京建成生物工程研究所);还原性谷胱甘肽测定试剂盒(分光光度法,南京建成生物工程研究所); 槐米提取物(天健绿源植物有限公司,20210410)。
1.1.3 动物健康成年昆明小鼠,6~8周,重量(20±2)g,由青岛大任富城畜牧有限公司提供。常规饲养,自由摄食、饮水,维持室温22℃~26℃,相对湿度40%~60%。本实验所有动物实验符合动物伦理学要求(批准编号:2019-YX-011)。
1.2 方法 1.2.1 动物分组与处理方法适应性喂养小鼠7d后,随机抓取平均分成3组,正常组、模型组、槐米提取物治疗组(FSI组),每组6只。模型组:对小鼠麻醉、脱毛、开腹后暴露胆总管后,于胆总管十二指肠汇合部及次级胆管交汇处分别用4~0丝线结扎后关腹。定时观察造模后小鼠健康状态。FSI组进行胆管结扎手术后,第21天开始给药,每只小鼠灌胃相同药物槐米提取物,给药剂量每只每天100mg/kg,模型组给予相同剂量生理盐水,连续灌胃10d。末次干预6h后,腹腔注射水合氯醛麻醉小鼠,内眦静脉取血3ml,3500rpm/min、10min、4℃离心,吸取血浆并标记。血液采集完毕后,颈椎脱臼处死,分离肝脏组织,4%多聚甲醛固定。
1.2.2 HE、Masson、天狼猩红染色取经4%多聚甲醛固定24h后的肝组织,经石蜡包埋,进行石蜡切片,切取3组5μm厚片进行二甲苯脱蜡、梯度乙醇脱水后,一部分切片经常规HE染液染色,另外两部分按照说明书经Masson染色与天狼猩红染色,最后滴加中性树胶封片,光学显微镜下观察、拍照,用于组织病理学分析。
1.2.3 血清生化检测使用收集好的血浆,参照试剂盒说明书应用微板法,酶标仪检测510nm波长下血清谷草转氨酶(AST)和谷丙转氨酶(ALT)水平,按照TBA法和可见分光光度法,测定532nm波长下丙二醛(MDA)和420nm处血清还原型谷胱甘肽(GSH)水平。
1.3 统计学方法所有统计数据均由GraphPad Prism 8.0分析软件完成, 实验数据使用x±s的形式表示,计量资料符合正态分布,组间比较采用方差分析,两两比较采用Bonferroni校正t检验,以P < 0.05为有统计学意义。
2 结果 2.1 一般情况正常组小鼠性情温和,皮毛柔顺,反应敏捷,食欲正常,解剖后小鼠肝脏表面光滑,无粘连,颜色鲜红(见图 1A)。模型组小鼠毛发粗糙,性情暴躁,食欲下降,尿液发黄,解剖后小鼠肝脏表面有深黄色斑点,并伴有颗粒感,整个肝脏颜色暗淡发黄,胆囊肿大(见图 1B)。FSI组小鼠毛发较模型组小鼠柔顺,食欲较好,解剖肝脏表面颗粒感较模型组轻(见图 1C)。
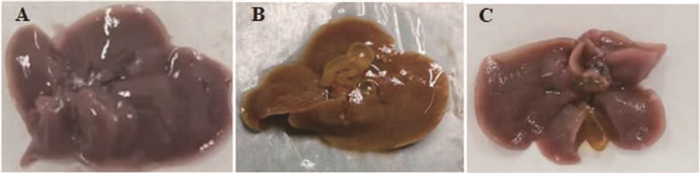
|
图 1 各组小鼠肝解剖形态 注:A.正常组;B.模型组;C.FSI组。 |
正常组小鼠肝小叶结构清晰可见,肝索呈有序排列,细胞结构正常;模型组小鼠肝小叶结构混乱,并且在门管区可明显观察到纤维化现象,大量炎性细胞浸润、细胞空泡、坏死;FSI组肝小叶结构较完整,炎性细胞较少,细胞坏死、空泡现象明显减少,纤维化程度降低(图 2A)。Masson染色结果中,正常组小鼠肝脏结构基本完整,没有明显的纤维组织增生;模型组小鼠肝小叶被破坏明显,胶原纤维增生(病理切片图中蓝色部分), 表明模型制作成功;FSI组小鼠肝小叶结构较模型组完整,纤维组织过度增生现象减少(图 2B)。天狼星红染色结果中,模型组小鼠出现了明显的胶原纤维沉积,而槐米提取物组小鼠在灌胃干预后纤维化减轻(图 2C)。
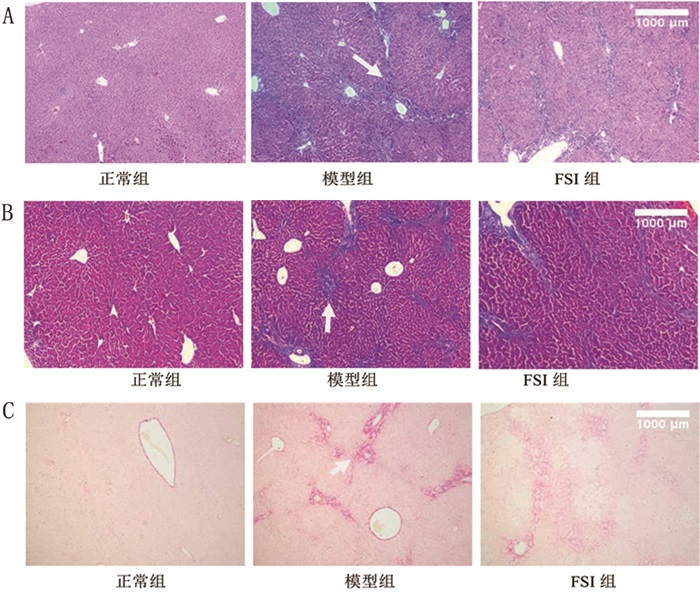
|
图 2 各组小鼠肝脏光镜下病理学切片染色 注:A.HE染色(40×;白色箭头指示为纤维化部位);B.Masson染色(40×;白色箭头指示为纤维化部位);C.天狼猩红(40×;白色箭头指示为纤维化部位)。 |
模型组小鼠AST、ALT水平明显高于正常组(t=16.28, P < 0.001;t=7.076, P < 0.01),提示其肝细胞损伤严重, 肝功能明显下降。相较模型组,FSI组小鼠AST、ALT血清水平呈下降趋势(t=3.775, P < 0.05;t=2.98, P < 0.05), 说明槐米提取物对于阻塞性肝细胞损伤有治疗作用(见图 3)。
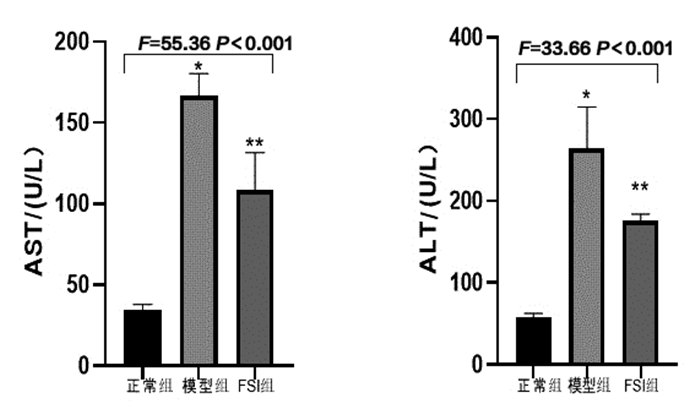
|
图 3 各组小鼠血清AST和ALT水平 注:*P < 0.05 vs正常组,**P < 0.05 vs模型组。 |
与正常组相比较,模型组MDA水平明显升高(t=12.14, P<0.001),表明模型组小鼠肝组织过氧化程度高,FSI组MDA水平相较模型组水平降低约15%(t=3.412, P < 0.05)(见图 4)。GSH通过清除自由基对抗肝细胞内的氧化应激作用,由于肝细胞被破坏,GSH内源生成减少、消耗过多(t=3.421, P < 0.05),血清GSH水平会降低; 正常组与模型组比较,模型组血清GSH下降(t=7.117,P < 0.01),导致其抗氧化能力下降,而FSI组血清GSH水平恢复至正常水平(t=4.681, P < 0.01)(见图 4)。
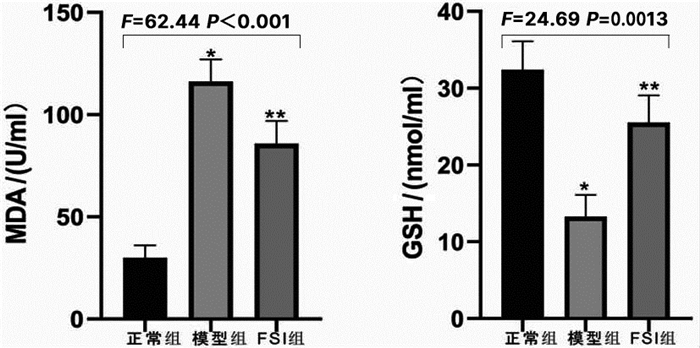
|
图 4 各组小鼠血清MDA与GSH水平 注:*P < 0.05 vs正常组,**P < 0.05 vs模型组。 |
肝纤维化是指肝细胞被反复破坏和再生,导致肝脏中细胞外基质成分过度沉积的过程,是慢性肝病发展的基础。胆总管结扎模型引起胆汁淤积,胆汁酸的毒性作用不断破坏肝细胞,引起细胞炎症反应产生炎症因子,活化肝星状细胞,造成纤维化[13]。胆汁淤积模型具有操作简单、效果稳定、快速等优点,被广泛用于肝脏进行性疾病的研究。ALT主要存在于肝细胞胞浆中,AST则主要存在肝细胞线粒体内。目前认为在排除肝外脏器病变的情况下,这两种酶的升高可直接反映肝细胞的损伤情况[14]。本研究小鼠造模后,肝功能皆出现了不同程度的降低,AST、ALT水平明显高于正常组,并出现肝纤维化,经过槐米提取物的治疗,病症减退,肝功能恢复,AST、ALT血清水平显著降低,表明槐米提取物对于胆管阻塞性肝病具有治疗作用。
体内氧化应激失衡是造成肝损伤的重要因素,细胞内的自由基产生过多持续的氧化因子改变细胞的通透性,导致活性氧外泄,进而诱导肝星状细胞(hepatic Stellate Cells, HSCs)表达转化生长因子-β1(transforming growth factor-β1, TGF-β1),促进HSC的增殖、活化,诱发肝纤维化[15]。自由基作用于脂质发生过氧化反应,通过测定MDA可反映组织过氧化程度。在本研究中槐米提取物能明显提高血清GSH水平, 降低血清MDA水平, 提示槐米提取物具有明显的抗氧化应激作用。而且槐米提取物中的芦丁和槲皮素具有肝靶向性[16],其中芦丁能够抑制TBHP引起的PI3K、p-PI3K、Akt和p-Akt蛋白表达水平降低,下调NF-κB的活化水平及p53蛋白的表达[17-18],所以槐米提取物治疗肝纤维化可能与PI3K/Akt和NF-κB等信号通路有关。综上所述,本研究应用了血液生化检测和病理学切片初步证明了槐米提取物对肝纤维化模型小鼠的治疗作用, 对临床肝纤维化提供了更多的治疗思路和选择。未来我们可致力于提取分离槐米提取物中的有效成分,研究其抗氧化和抗细胞损伤的信号通路,明确槐米提取物的治疗机制等方面的研究。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Yang Y, Yang F, Wu XJ, et al. EPAC activation inhibits acetaldehyde-induced activation and proliferation of hepatic stellate cell via Rap1[J]. Can J Physiol Pharm, 2016, 94: 498-507. DOI:10.1139/cjpp-2015-0437 |
| [2] |
Iredale JP. Models of liver fibrosis: Exploring the dynamic nature of inflammation and repair in a solid organ[J]. Clin Investig, 2007, 117: 539-548. DOI:10.1172/JCI30542 |
| [3] |
Roehlen N, Crouchet E, Baumert TF, et al. Liver fibrosis: Mechanistic concepts and therapeutic perspectives[J]. Cells, 2020, 9(4): 875. DOI:10.3390/cells9040875 |
| [4] |
Bataller R, David AB. Liver fibrosis[J]. J Clin Investig, 2005, 2: 209-218. DOI:10.1172/JCI24282 |
| [5] |
Ibraheim ZZ, Ahmed AS, Gouda YG, et al. Phytochemical and biological studies of Adiantum capillus-veneris L[J]. Saudi Pharm J, 2011, 19(2): 65-74. DOI:10.1016/j.jsps.2011.01.007 |
| [6] |
Wang JN, Li L, Li LY, et al. Emerging role and therapeutic implication of Wnt signaling pathways in liver fibrosis[J]. Gene Vol, 2018, 674: 57-69. DOI:10.1016/j.gene.2018.06.053 |
| [7] |
Shan L, Liu Z, Ci L, et al. Research progress on the anti-hepatic fibrosis action and mechanism of natural products[J]. Int Immunopharmacol, 2019, 75: 105765. DOI:10.1016/j.intimp.2019.105765 |
| [8] |
Chen SR, Chen XP, Lu JJ, et al. Potent natural products and herbal medicines for treating liver fibrosis[J]. Chin Med, 2015, 10: 7. DOI:10.1186/s13020-015-0036-y.eCollection2015 |
| [9] |
侯广月, 郑重, 宋凤瑞, 等. 基于紫外及荧光光谱方法的中药抗氧化应激作用研究[J]. 光谱学与光谱分析, 2015, 35(3): 680-683. DOI:10.3964/j.issn.1000-0593(2015)03-0680-04 |
| [10] |
Lin X, Kong LN, Huang C, et al. Hesperetin derivative-7 inhibits PDGF-BB-induced hepatic stellate cell activation and proliferation by targeting Wnt/β-catenin pathway[J]. Int Immunopharmacol, 2015, 25(2): 311-320. DOI:10.1016/j.intimp.2015.02.009 |
| [11] |
Li JJ, Lu XY, Jia P, et al. O-alkyl and o-benzyl hesperetin derivative-1L attenuates inflammation and protects against alcoholic liver injury via inhibition of BRD2-NF-κB signaling pathway[J]. Toxicology, 2022, 466: 153087. DOI:10.1016/j.tox.2021.153087 |
| [12] |
Shakeel F, Alamer MM, Alam P, et al. Hepatoprotective effects of bioflavonoid luteolin using self-nanoemulsifying drug delivery system[J]. Molecules, 2021, 26(24): 7497. DOI:10.3390/molecules26247497 |
| [13] |
肖程, 康权, 罗庆. 胆总管结扎胆汁淤积性肝硬化动物模型的建立与评价[J]. 临床小儿外科杂志, 2020, 19(1): 74-80. DOI:10.3969/j.issn.1671-6353.2020.01.015 |
| [14] |
毛会娟, 王卫芳, 姚佳, 等. 肝纤维化指标在乙型肝炎肝硬化及进展程度中的意义[J]. 中华医院感染学杂志, 2021, 31(17): 2561-2565. DOI:10.11816/cn.ni.2021-203582 |
| [15] |
成嘉祁, 龚芸芸, 谢海静, 等. 青蒿总黄酮联合有氧间歇运动训练抑制肝纤维化小鼠模型炎症反应[J]. 动物医学进展, 2018, 39(11): 52-57. DOI:10.3969/j.issn.1007-5038.2018.11.010 |
| [16] |
孙艳涛, 王冰. 中药槐米提取物中黄酮类成分在大鼠五脏中的靶向效率差异研究[J]. 现代中药研究与实践, 2017, 31(4): 37-40. DOI:10.13728/j.1673-6427.2017.04.011 |
| [17] |
金芳多, 张天, 张钊, 等. 芦丁对肝细胞氧化应激损伤的保护作用及其机制[J]. 吉林大学学报(医学版), 2020, 46(6): 1117-1123, 1345. DOI:10.13481/j.1671-587x.20200602 |
| [18] |
Yin L, Yu X. Arsenic-induced apoptosis in the p53-proficient and p53-deficient cells through differential modulation of NFkB pathway[J]. Food Chem Toxicol, 2018, 118: 849-860. DOI:10.1016/j.fct.2018.06.053 |



