2. 济宁市第一人民医院,济宁 272011;
3. 联影智能医疗科技(北京)有限公司,北京 100094
2. Jining First People's Hospital, Jining 272011, China;
3. United Imaging Intelligence Medical Technology (Beijing) Co.Ltd, Beijing 100094, China
在世界范围内,女性乳腺癌的发病率已成为发病率最高的癌症[1]。淋巴结状况(淋巴结阴性与阳性/切除的淋巴结数量)是乳腺癌局部或区域复发、远处转移及存活率的重要预测因子[2]。乳腺癌治疗包括根治性乳房切除术、腋窝淋巴结清扫术(axillary lymph node dissection,ALND)以及术后的放化疗等[3]。传统认为,ALND时所切除淋巴结组织学是评估疾病转移到局部区域淋巴结的最准确的方法。然而,ALND可能会导致淋巴水肿、神经损伤、肩部功能障碍等并发症,这极大地降低了患者的生活质量[4]。一般认为,前哨淋巴结(sentinel lymph node,SLN)是腋窝淋巴(ALN)转移的前一站。前哨淋巴结活检(sentinel lymph node biopsy,SLNB)侵入性较ALND小,在不影响诊断准确性和预后的情况下避免了ALND的发病率,但SLNB却有着较高的假阴性率[4-5]。体格检查、钼靶、超声检查和常规MRI检查都是诊断乳腺癌的常用方法,但它们评估淋巴结转移的能力不及SLNB[6]。与其他检查方法相比,乳腺MRI具有更高检测灵敏度和较强血流动力学评估能力的优点,越来越受临床医生的青睐。影像组学可以定量提取出肉眼观察不到的图像内部特征,识别肿瘤的异质性,反映其生物学行为[7],在乳腺癌的分子分型、良恶性鉴别、化疗疗效评价等方面已经展现出了一定的优势[8],并且在多种肿瘤淋巴结转移预测中有了一定的研究发现[9-12]。近期开始有学者对基于多期相动态对比增强磁共振(dynamic contrast-enhanced magnetic resonance imaging,DCE-MRI)的影像组学在预测乳腺癌的淋巴结转移中的价值进行了探究[13-16],但这些研究多是基于单期相如增强早期或增强峰值期的DCE-MRI,而基于多期相DCE-MRI影像组学预测乳腺癌SLN转移的研究报道尚较少。本研究利用动态对比增强磁共振的早期、峰值期、末期及三期联合期相的图像与影像组学结合,探究多期相DCE-MRI在预测乳腺癌SLN转移中的价值。
1 资料与方法 1.1 一般资料回顾性收集2018年11月-2021年9月于济宁市第一人民医院行乳腺磁共振扫描,并经术后病理或穿刺活检证实的150例乳腺癌患者的临床、病理及MRI资料。纳入标准:1)原发单发病灶,直径>10mm;2)手术或穿刺活检前在同一台仪器行乳腺DCE-MRI扫描,扫描参数及序列相同;3)乳腺SLN经病理活检。排除标准:1)图像质量差影响观察;2)既往有乳腺手术、化疗、放疗或激素治疗史;3)DCE-MRI表现为非肿块强化者。本研究经济宁市第一人民医院伦理委员会批准(2023伦审研第006号),获得受试者知情同意。依据病理结果,将患者分为SLN转移阳性组和阴性组,其中,转移阳性者61例,阴性者89例,将数据集以8 ∶2的比例随机划分为训练集(n=120)与测试集(n=30)。
1.2 设备与扫描所有患者使用Philips 3.0T超导MRI扫描仪并配备乳腺专用16通道相控阵表面线圈。患者取俯卧位,足先进方位,双乳自然悬垂。本研究使用序列及参数:动态对比增强扫描序列,TR 3.9ms,TE 1.97ms,视野(FOV)280mm×339mm,体素1mm×1mm×2.4mm,矩阵280×338,层厚2.4mm,间隔-1.2mm,125层,激励次数1次。注射对比剂之前先进行一期平扫,加上平扫共采集9个期相,每期时长57s,然后使用高压注射器经手背静脉团注对比剂钆喷酸葡胺注射液(Gd-DTPA),速率2.5ml/s,剂量0.2mmol/kg,再以相同速率注射20ml生理盐水,注射对比剂后行动态对比增强扫描。最强早期即注射造影剂后第一期,最强末期即扫描的最后一期。然后经后处理得到时间信号强化曲线确定增强最强期相,即增强峰值期。
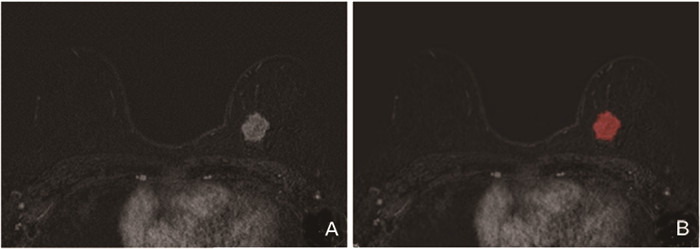
1.3 VOI勾画将DCE-MRI三期图像(增强早期、增强峰值期、增强末期)导入uAI Research Portal平台(上海联影智能医疗科技有限公司),沿病灶边缘逐层手动勾画感兴趣区(图 1),平台自动生成三维体积兴趣区(volume of interest,VOI)。所有MRI图像均由医师1(2年放射学诊断经验)和医师2(15年放射学诊断经验)进行VOI分割,医师1在1周后进行重复分割。使用组内相关系数(intraclass correlation coefficient,ICC)来判断影像组学特征在观察者内和两名观察者之间的一致性,ICC>0.75表示一致性良好。
|
图 1 感兴趣区勾画示 注: A.横断位DCE-MRI图示左乳肿瘤;B.红色区域为手动勾画病灶三维感兴趣区的其中一个层面。 |
由uAI Research Portal平台自动提取VOI的影像组学特征,包括形状特征、纹理特征、灰度统计量特征以及高阶特征(在原始图像上对前3类特征进行多种滤波处理后得到)。每个序列提取出2600个特征,联合后共提取7800个特征,通过平台分别进行特征选择。首先采用Z-Score方法对特征进行归一化,把数据按比例缩放,将其落入(0,1)之间,得到归一化的数据;其次,利用Select K Best方法选出方差分析中P < 0.05的特征;最后,再使用LASSO选出最优特征。
1.5 影像组学模型构建使用筛选后的特征进行机器学习模型的构建,整理筛选出的特征建立logistic回归(logistic regression,LR)机器学习模型。采用ROC曲线评估LR模型在训练集和测试集中的预测效能,并且计算AUC、准确度、敏感度以及特异度。
1.6 统计学方法采用SPSS 27.0软件分析数据。对于符合正态分布的计量资料,两组间比较采用独立样本t检验,以x±s表示,不符合正态分布的计量资料则采用Mann-Whitney U检验。对于计数资料,组间的比较采用χ2检验,以例来表示。用Delong检验对模型的ROC曲线进行比较。预测模型的临床价值评估则使用决策曲线分析(decision curve analysis,DCA)。以P < 0.05为差异具有统计学意义。
2 结果 2.1 一般资料患者年龄29~76岁,平均(50.28±9.58)岁。训练集与验证集的年龄、病理分级及分子分型比较差异均无统计学意义(P>0.05)。见表 1。
| 表 1 训练集和测试集的临床特征 |
使用组内相关系数检验,医师1先后两次、医师1与医师2分别对病灶进行手动分割ICC范围,分别为0.793~0.922、0.765~0.892,均大于0.75,可重复性均较好。
2.3 影像组学特征于uAI Research Portal平台,对从增强早期、增强峰值期、增强末期及三期联合期相中提取的特征进行方差分析及LASSO筛选,最终分别得到了10、10、10及11个最优特征,4个模型所筛选的特征及相应系数见表 2、3、4、5。具体特征包括4个一阶特征、21个灰度共生矩阵(graylevel cooccurrence matrix,GLCM)特征、0个灰度游程矩阵(graylevel cooccurrence matrix,GLRLM)特征、3个灰度区域大小矩阵(graylevel size zone matrix,GLSZM)特征、11个灰度相关矩阵(graylevel dependence matrix,GLDM)特征、2个邻域灰度差矩阵(neighbourhood graytone difference matrix,NGTDM)特征。联合期相的11个特征包括4个增强早期、4个增强峰值期及3个增强末期的特征。
| 表 2 增强早期模型的影像组学特征及其相应的系数 |
| 表 3 增强峰值期模型的影像组学特征及其相应的系数 |
| 表 4 增强末期模型的影像组学特征及其相应的系数 |
| 表 5 联合期相模型的影像组学特征及其相应的系数 |
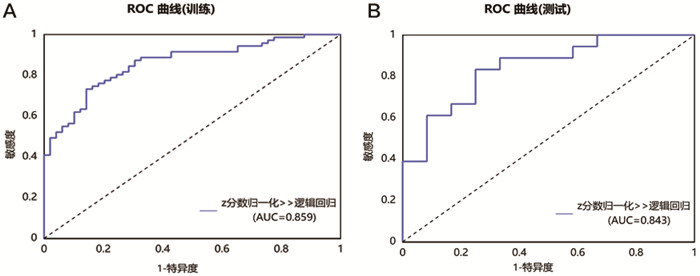
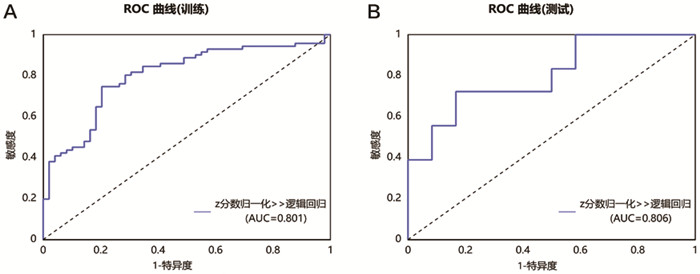
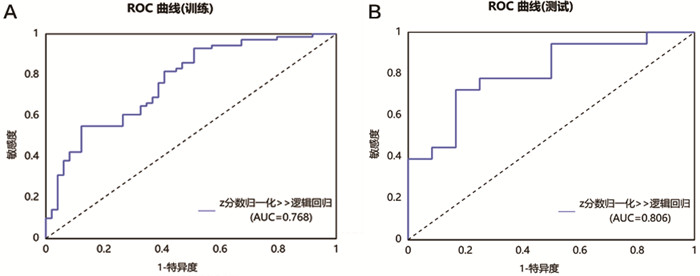
训练集增强早期、增强峰值期、增强末期及三期联合期相模型在LR模型下的AUC值分别为0.859、0.801、0.768、0.834,准确率分别为78.3%,75.8%,70.8%,78.3%。测试集增强早期、增强峰值期、增强末期及联合期相在LR模型下的AUC值分别为0.843、0.806、0.806、0.866,准确率分别为76.7%,70.0%,66.7%,80.0%(表 6、图 2~5)。Delong检验显示训练集中增强末期与联合期相之间的AUC差异存在统计学意义(P=0.037),其余各模型间的AUC差异无统计学意义(P>0.05)。DCA显示测试集阈值概率在0.11到0.62范围内,联合期相模型有较好的临床价值。见图 6。
| 表 6 LR模型在训练集与测试集中的诊断效能 |
|
图 2 基于增强早期构建的LR模型的ROC曲线 注: A.训练集;B.测试集。 |
|
图 3 基于增强峰值期构建的LR模型的ROC曲线 注: A.训练集;B.测试集。 |
|
图 4 基于增强末期构建的LR模型的ROC曲线 注: A.训练集;B.测试集。 |
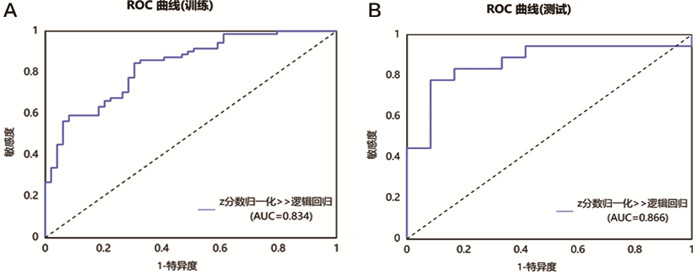
|
图 5 基于联合期相构建的LR模型的ROC曲线 注: A.训练集; B.测试集。 |
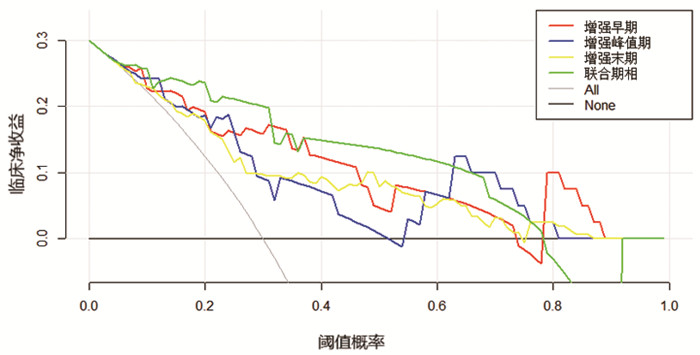
|
图 6 测试集决策曲线 注:横坐标表示阈值概率,纵坐标表示净收益。 |
术前无创准确预测出乳腺癌患者的淋巴结状态对临床治疗的选择有极大地帮助,动态对比增强磁共振扫描可以反映肿瘤的血流动力学状态。本研究中增强早期、峰值期、末期及三期联合期相模型在乳腺癌SLN转移的预测中均有较好的预测效能,在训练集中联合期相模型的AUC高于增强末期, 且测试集中联合期相模型效能均略高于其他单独期相模型。
本研究选择了DCE-MRI中的三期进行研究,选择动态增强早期的图像,一方面是因为该期病变与背景的对比度最大,利于肿瘤的勾画。另一方面则是该期反映肿瘤的早期强化,与肿瘤内新生血管的多少及肿瘤恶性程度有关,有学者[17]研究患者的增强扫描早期图像为研究对象,构建的模型得到较高的预测效能(准确率为89.54%,AUC值为0.8615),其效能略高于我们的研究,可能与分类器的不同及样本量的差异有关,在本研究的测试集,三个单独期相里以增强早期的AUC最高,也进一步说明了该期的重要性。动态增强扫描的峰值期,是肿瘤强化达到最强时的期相,更能反映肿瘤的异质性和侵袭性,既往有学者[18]在增强相最强的图像上勾勒出整个肿瘤的VOI,构建了基于LR的影像组学模型,得到了较好的预测价值(测试集AUC:0.74),本研究增强峰值期模型的AUC值高于其研究,再次证明了人工智能结合影像组学预测乳腺癌腋窝转移的可行性。本研究另外尝试选择了动态增强扫描末期的图像进行影像组学分析,是因为该期除了反映肿瘤的微循环外,还可能反映了肿瘤廓清达一定程度后肿瘤间质的内部特征,这或许与肿瘤的淋巴结转移存在一定的关联。
以往有学者[19]提取平扫T1WI和基于T1WI的增强早期特征来预测乳腺癌ALN的转移情况时,发现两者的AUC差别并不大(0.87和0.85),考虑所提取的特征类型以纹理特征为主,增强与否对图像的纹理特征影响有限,所以增强各期的AUC差别不大,本研究结果表明增强早期、峰值期、末期在预测浸润性乳腺癌SLN转移时各期之间的差异不大,与其结果相仿。同时,我们进行多期联合构建模型,结果表明,联合期相的效能略高于单独期相,这可能是因为联合期相更全面反映增强扫描不同阶段的肿瘤血流动力学特征、微环境及异质性,所提取的特征更加丰富。
从所提取的特征可以看出,灰度共生矩阵特征数量最多,且在各个模型中的系数绝对值都较大,反映了灰度共生矩阵在预测乳腺癌淋巴结转移中重要性。灰度共生矩阵反映了图像灰度值的空间依赖性,Lian等[20]发现从灰度共生矩阵中获得的纹理特征在低转移性和高转移性的癌细胞中具有较高的分辨力,可能是因为转移能力高的肿瘤在增殖方面表现出更高的无序性,从而导致肿瘤表现出更高的对比性和更低的均匀性。
本研究存在局限性:1)相较于影像组学所需要的大样本来说,本研究的样本量相对较小,并且缺乏多中心数据的支持,模型的稳健性有待进一步验证。2)本研究是基于DCE-MRI不同期相影像组学的研究,没有结合其他序列如T1WI、T2WI及DWI,缺乏多模态MRI影像组学的特征。3)本研究特征的降维选用的是基于LASSO的算法,这有可能会筛选掉部分具有潜在预测价值的特征,影响模型的效能。
综上所述,DCE-MRI不同期相(增强早期、峰值期及增强末期)影像组学模型在预测浸润性乳腺癌SLN转移中均具有较好的预测效能,测试集中的联合期相表现更为突出,有助于术前评估浸润性乳腺癌SLN的状态,为临床制定治疗方案提供思路。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [2] |
Fung F, Cornacchi SD, Vanniyasingam T, et al. Predictors of 5-year local, regional, and distant recurrent events in a population-based cohort of breast cancer patients[J]. Am J Surg, 2017, 213(2): 418-425. DOI:10.1016/j.amjsurg.2016.03.016 |
| [3] |
刘仪萱, 姚峰. 乳腺导管原位癌伴微浸润与浸润癌患者的临床特征对比分析[J]. 现代肿瘤医学, 2021, 29(21): 3766-3769. DOI:10.3969/j.issn.1672-4992.2021.21.014 |
| [4] |
Manca G, Rubello D, Tardelli E, et al. Sentinel lymph node biopsy in breast cancer: Indications, contraindications, and controversies[J]. Clin Nucl Med, 2016, 41(2): 126-133. DOI:10.1097/RLU.0000000000000985 |
| [5] |
Hindié E, Groheux D, Brenot-Rossi I, et al. The sentinel node procedure in breast cancer: nuclear medicine as the starting point[J]. J Nucl Med, 2011, 52(3): 405-414. DOI:10.2967/jnumed.110.081711 |
| [6] |
Valente SA, Levine GM, Silverstein MJ, et al. Accuracy of predicting axillary lymph node positivity by physical examination, mammography, ultrasonography, and magnetic resonance imaging[J]. Ann Surg Oncol, 2012, 19(6): 1825-1830. DOI:10.1245/s10434-011-2200-7 |
| [7] |
Lambin P, Rios-Velazquez E, Leijenaar R, et al. Radiomics: extracting more information from medical images using advanced feature analysis[J]. Eur J Cancer, 2012, 48(4): 441-446. DOI:10.1016/j.ejca.2011.11.036 |
| [8] |
马晓雯, 罗娅红. 影像组学在乳腺癌应用中的研究进展[J]. 磁共振成像, 2018, 9(8): 637-640. DOI:10.12015/issn.1674-8034.2018.08.015 |
| [9] |
卢孔尧, 黄钢, 左艳. 非小细胞肺癌淋巴结转移预测模型研究[J]. 中国医学物理学杂志, 2022, 39(2): 182-187. DOI:10.3969/j.issn.1005-202X.2022.02.009 |
| [10] |
Huang YQ, Liang CH, He L, et al. Development and validation of a radiomics nomogram for preoperative prediction of lymph node metastasis in colorectal cancer[J]. J Clin Oncol, 2016, 34(18): 2157-2164. DOI:10.1200/JCO.2015.65.9128 |
| [11] |
Li F, Pan D, He Y, et al. Using ultrasound features and radiomics analysis to predict lymph node metastasis in patients with thyroid cancer[J]. BMC Surg, 2020, 20(1): 315. DOI:10.1186/s12893-020-00974-7 |
| [12] |
Wang Y, Liu W, Yu Y, et al. CT radiomics nomogram for the preoperative prediction of lymph node metastasis in gastric cancer[J]. Eur Radiol, 2020, 30(2): 976-986. DOI:10.1007/s00330-019-06398-z |
| [13] |
夏旭东, 段成洲, 李铭, 等. 基于MRI影像组学列线图预测乳腺癌腋窝淋巴结转移[J]. 磁共振成像, 2022, 13(1): 118-122. DOI:10.12015/issn.1674-8034.2022.01.024 |
| [14] |
王猛, 刘周, 文洁, 等. 基于T2WI-FS的影像组学特征在术前预测乳腺癌腋窝淋巴结转移中的价值[J]. 肿瘤影像学, 2022, 31(1): 28-35. DOI:10.19732/j.cnki.2096-6210.2022.01.006 |
| [15] |
Qiu Y, Zhang X, Wu Z, et al. MRI-based radiomics nomogram: Prediction of axillary non-sentinel lymph node metastasis in patients with sentinel lymph node-positive breast cancer[J]. Front Oncol, 2022, 12: 811347. DOI:10.3389/fonc.2022.811347 |
| [16] |
Zhu Y, Yang L, Shen H. Value of the application of CE-MRI radiomics and machine learning in preoperative prediction of sentinel lymph node metastasis in breast cancer[J]. Front Oncol, 2021, 11: 757111. DOI:10.3389/fonc.2021.757111 |
| [17] |
Cui X, Wang N, Zhao Y, et al. Preoperative prediction of axillary lymph node metastasis in breast cancer using radiomics features of DCE-MRI[J]. Sci Rep, 2019, 9(1): 2240. DOI:10.1038/s41598-019-38502-0 |
| [18] |
Liu J, Sun D, Chen L, et al. Radiomics analysis of dynamic contrast-enhanced magnetic resonance imaging for the prediction of sentinel lymph node metastasis in breast cancer[J]. Front Oncol, 2019, 9: 980. DOI:10.3389/fonc.2019.00980 |
| [19] |
Chai R, Ma H, Xu M, et al. Differentiating axillary lymph node metastasis in invasive breast cancer patients: A comparison of radiomic signatures from multiparametric breast MR sequences[J]. J Magn Reson Imaging, 2019, 50(4): 1125-1132. DOI:10.1002/jmri.26701 |
| [20] |
Lian MJ, Huang CL. Texture feature extraction of gray-level co-occurrence matrix for metastatic cancer cells using scanned laser pico-projection images[J]. Lasers Med Sci, 2019, 34(7): 1503-1508. DOI:10.1007/s10103-018-2595-5 |



