2. 济宁医学院附属医院, 济宁 272029
2. Affiliated Hospital ofJining Medical University, Jining 272029, China
下咽鳞状细胞癌(Hypopharyngeal squamous cell carcinoma,HSCC)占所有头颈部恶性肿瘤的3%左右,是头颈部恶性程度最高、预后最差的肿瘤之一,据相关研究报道下咽癌患者的5年总生存率仅为30%~35%[1]。近50%的患者在诊断后一年内复发,且多发展为远处转移[2]。因此,进一步了解HSCC的致癌机制及有效靶点对尽早干预、防止复发、提高预后具有十分重要的意义。
脑源性神经营养因子(Brain-derived neurotrophic factor,BDNF),最早由德国学者在猪脑提取液中发现的一种碱性蛋白[3]。它通过其与细胞表面受体发生配体-受体反应激活各种关键信号通路[4]。BDNF作为目前肿瘤领域研究的热点,过往文献证明BDNF在喉癌[5]、甲状腺癌[6]等头颈部肿瘤中高表达,其高表达可以促进肿瘤的生长、侵袭、转移、上皮-间充质转化和化疗耐药性[7-8]。目前BDNF在HSCC癌组织中的表达情况及其对HSCC侵袭转移能力的影响却尚未报道。本文旨在探讨BDNF在HSCC中的表达及其临床意义。
1 资料与方法 1.1 一般资料选取2013年4月至2016年12月我院耳鼻喉科手术中用于病理检查留取的33例HSCC癌组织、22例HSCC癌旁组织以及12例行悬雍垂-腭-咽成形术(UPPP)的正常咽部黏膜组织石蜡包埋组织切片标本。纳入标准:1)符合HSCC临床诊断标准,经病理检查证实;2)临床资料完整;3)排除由其他肿瘤侵犯或转移;4)患者及家属均知情并签署知情同意书。本研究已通过济宁医学院附属医院伦理委员会批准。
1.2 细胞株与试剂细胞株: 人下咽鳞状细胞癌FaDu细胞,购自iCell Bioscience Inc。
MEM培养基、胎牛血清、青链霉素双抗混合液(Gibco);胰蛋白酶消化液(BIOTOP);冻存液(美伦公司);4%多聚甲醛(索莱宝公司);结晶紫染色液(5×结晶紫染色储液+稀释液)(凯基生物公司);Matrigal基质胶(Corning);磷酸盐缓冲液(福州迈新公司);EDTA抗原修复液pH 9.0;内源性过氧化物酶阻断剂(北京中杉金桥公司);兔抗人BDNF多克隆抗体(Affinity公司);兔抗人TrkB多克隆抗体(Proteintech Group);抗体稀释液(Proteintech Group);增强酶标山羊抗小鼠/兔IgG聚合物通用型二抗,DAB显色试剂盒(北京中杉金桥公司)。苏木素-伊红染色液、二甲苯、75%、95%、无水乙醇、中性树胶封片剂等均由我院病理科实验室提供。
1.3 二步法免疫组织化学染色通过免疫组织化学染色检测33例HSCC癌组织、22例HSCC癌旁组织及12例正常咽部黏膜组织中BDNF表达量。按照试剂说明书步骤进行通用二步法免疫组织化学染色,脱蜡、水化、抗原修复、阻断内源性过氧化物酶、孵育一抗、次日取出组织切片,PBS洗片2min×3次、滴加适量反映增强剂、滴加即用型二抗增强酶标羊抗小鼠/兔IgG聚合物、DAB显色、苏木素染色、将染色后的石蜡切片放置于上行梯度浓度的酒精中脱水、透明、封片,储存。
免疫组化结果判读:由两名病理科专业医师在光学显微镜下采取双盲法判定。观察细胞膜和细胞质,在组织中阳性表达时染色为棕黄色或褐色颗粒,调节至400×镜下随机选择5个视野计数细胞并根据阳性细胞所占比例(0分:< 5%;1分:5~25%;2分:26%~50%;3分:>51%)及染色强度(0分:无色;1分:浅黄色;2分:棕黄色;3分:棕褐色)进行评分。以上两项积分相加≥3分时判定结果为阳性。
1.4 Transwell侵袭实验对照组:不含BDNF的MEM完全培养基中生长的FaDu细胞;实验组:在含400ng/ml BDNF刺激因子的MEM完全培养基中生长的FaDu细胞,每组均设置3个副孔。
将Matrigal基质胶提前一天从-20℃冰箱转移至4℃冰箱,使其由固态变为液态,用MEM无血清培养基按1 ∶2稀释Matrigal基质胶,用预冷枪头吸取50μl稀释好的Matrigal加入Transwell上室,37℃恒温培养箱内过夜孵育基质胶,吸出上层液态的不凝胶,使薄层Matrigal基质胶沉积底部。取生长状态良好的各组FaDu细胞,更换为MEM无血清培养基饥饿过夜,常规消化、离心,用MEM无血清培养基重悬至单细胞悬液,计数后调整FaDu细胞浓度至1×106个/ml。于Transwell下室中加入30% MEM完全培养基600μl,向Transwell上室每孔滴注100μl各组细胞悬液(1×105个/孔)。放置于37℃恒温培养箱内过夜培养,取出24孔板,弃去上室培养基,吸除剩余培养基及基质胶,将小室浸于500μl 4%多聚甲醛小孔,室温下固定30min后,蒸馏水清洗3次,再浸入500μl预先配制的结晶紫溶液中,室温下染色30min后,蒸馏水清洗3次,用棉签轻轻拭去上室未穿膜FaDu细胞。将小室放置于倒置显微镜下观察,400×视野下随机选取5个视野计数,结果取平均值。
1.5 统计学方法采用SPSS25.0软件进行统计学分析,通过Fisher精确概率法进行统计学分析。采用GraphPad Prism 5软件对Transwell侵袭试验结果进行统计学分析,以P<0.05表示有统计学意义。
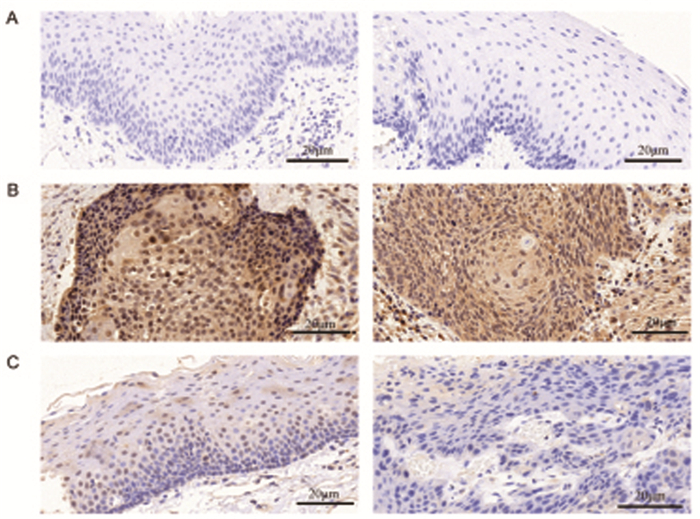
2 结果 2.1 BDNF在HSCC癌组织、癌旁组织及正常咽部黏膜组织中的表达情况光学显微镜下显示BDNF在组织中主要表达在细胞膜和细胞质,在组织中BDNF阳性表达时染色为棕黄色或褐色颗粒(图 1示)。
|
图 1 不同组织中BDNF的表达情况(40×) 注:A为正常咽部黏膜组织切片;B为下咽癌癌组织切片;C为下咽癌癌旁组织切片。 |
正常咽部黏膜组织中BDNF表达的阳性率为0(0/12);22例HSCC患者癌旁组织有7例可见BDNF阳性表达,阳性率为31.8%(7/22);HSCC患者的癌组织中28例可见BDNF阳性表达,阳性率为84.8%(28/33)。BDNF蛋白在HSCC癌组织中的表达显著高于癌旁组织及正常咽部黏膜组织,具有统计学意义(P < 0.0125);且在HSCC癌旁组织中的BDNF蛋白阳性表达明显高于正常咽部黏膜组织,具有统计学意义(P < 0.0125)。
2.3 BDNF表达与下咽癌临床病理参数之间的关系下咽癌组织标本中BDNF蛋白的表达与肿瘤直径、分化程度、是否淋巴结转移及临床分期相关(P < 0.05),与性别、年龄及浸润深度无关(P>0.05)。见表 2。
| 表 1 BDNF在下咽癌组织及癌旁组织、正常咽部黏膜组织中的表达差异 |
| 表 2 下咽癌组织中BDNF的表达与临床病理学参数的关系 |
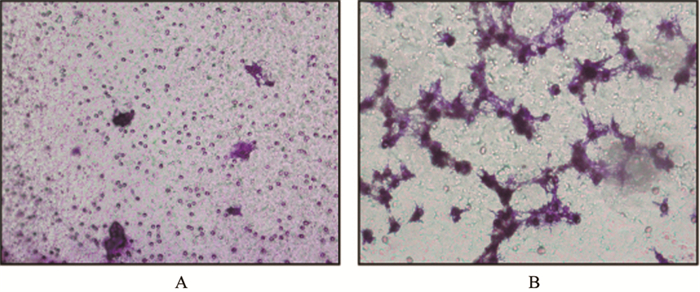
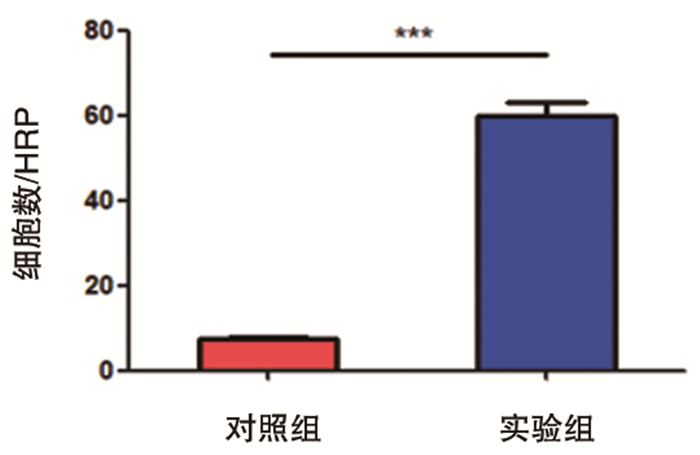
外源性BDNF明显增强FaDu细胞的侵袭能力,两组间差异性具有统计学意义(P < 0.05)。见图 2、图 3。
|
图 2 Transwell侵袭实验不同浓度BDNF穿膜的Fadu细胞 注:A为对照组穿膜的Fadu细胞; B为400ng/ml浓度组穿膜的Fadu细胞。 |
|
图 3 不同浓度BDNF下穿膜的Fadu细胞数 注:与对照组相比,***P < 0.05。 |
头颈部鳞状细胞癌(HNSCC)是上呼吸道最常见的恶性肿瘤,HSCC约占所有HNSCC的3%,然而却是所有头颈部恶性肿瘤中预后最差的一种[3],这与其早期即出现区域淋巴结转移和随后的远处转移扩散有关,这是HSCC的一个重要特征[9]。HSCC治疗手段包括手术切除,放射疗法(RT)或化学疗法。对于特定的早期病例(T1和部分T2期患者及无淋巴结转移者),可以采用单纯手术切除治疗方式,而晚期HSCC则需要手术切除及放、化疗联合的综合性治疗[10]。下咽局部有丰富的淋巴网络,使肿瘤可以早期扩散到颈部和咽后淋巴结,增加了转移的机会,导致HSCC患者预后较其他头颈部肿瘤相对较差。因此,找寻新的有意义的治疗靶点对于HSCC的治疗和远期预后具有重要意义。
肿瘤细胞中存在BDNF/TrkB自分泌通路,BDNF/TrkB通路与肿瘤细胞的形成、侵袭转移以及耐药性[11]相关。BDNF除了在神经系统肿瘤中高表达外,在呼吸系统、消化系统、血液系统及生殖系统的肿瘤组织中同样发现表达上调[12-15]。BDNF/TrkB信号通路在头颈部多种肿瘤发生发展过程中的重要作用[8, 16],但BDNF在HSCC中的表达情况及对于HSCC侵袭转移能力的影响知之甚少,因此,研究BDNF对于HSCC的生长浸润转移及预后的影响有重要的价值。
通过免疫组化实验,我们发现:1)HSCC组织中肿瘤直径>2cm的患者BDNF蛋白的表达水平明显高于≤2cm的患者;2)中低分化的患者BDNF蛋白的表达水平明显高于高分化的患者;3)有淋巴转移的患者BDNF蛋白的表达水平明显高于无淋巴转移的患者;4)Ⅲ、Ⅳ期患者BDNF蛋白的表达水平明显高于Ⅰ、Ⅲ期的患者。以上各组间差异均有统计学意义。本文中浸润至肌层及以下的患者与浸润至黏膜下层的患者的BDNF蛋白的表达率无统计学差异,分析可能原因:1)由于样本量较少导致统计学差异不明显;2)本文中所收集晚期患者(Ⅲ及Ⅳ期)较多,肿瘤恶性度普遍较高,从而影响BDNF蛋白的表达差异性。我们认为增加样本量,丰富不同肿瘤分期,可使统计学差异更加显著。
大量新生血管的形成是另一个与肿瘤远处侵袭转移密切相关的因素,BDNF在血管生成的过程中是必不可少的[17],Kermani等[18]发现BDNF有双重促血管生成的作用,其既可以通过局部激活内皮细胞亚群表达的TrkB受体,也可以通过主动募集骨髓源性干细胞的方式促进血管内皮生成。通过这种双重促血管生成活性,与血管内皮生长因子(VEGF)共同作用促进生成新生血管,达到促进肿瘤生长和侵袭转移的作用[19]。
Kupferman等[20]发现BDNF参与喉癌及舌癌的生长过程,并且可以诱导细胞迁移和上皮-间充质转化(EMT)的形成。BDNF在肿瘤微环境中可以通过成纤维细胞(CAFs)控制的旁分泌轴协助淋巴结转移,与正常成纤维细胞相比,含有来自头颈部肿瘤患者相关成纤维细胞(CAFs)的条件培养基可促进头颈部细胞增殖、细胞浸润、耐受化疗药物以及淋巴结转移,从机制上证明了BDNF在头颈部肿瘤发生及进展过程中的重要作用[21]。这一过程也被Dudás等证实,通过在无血清培养基中培养成纤维细胞,发现激活的成纤维细胞,也可以产生高水平的BDNF,能够诱导肿瘤细胞EMT形成,并且发现使用TGF-β1处理舌鳞状细胞癌SCC-25细胞后可抑制其生长,而BDNF处理后可恢复SCC-25细胞的生长,认为BDNF可以提高肿瘤细胞存活率,从而导致患者预后恶化[22-23]。
本文根据上述文献的报道进一步验证HSCC的侵袭转移能力是否与BDNF相关,在免疫组化结果证实BDNF在HSCC组织中高度表达的基础上,我们以外源性BDNF作为刺激因子培养FaDu细胞,通过Transwell侵袭实验,发现与对照组相比外源性BDNF(400ng/ml)处理后的FaDu细胞穿膜数量更多,侵袭能力明显增强,两组间比较差异具有统计学意义(P < 0.05),与上述文献报道结果一致,以此证明BDNF的表达与FaDu细胞的侵袭转移密切相关。
综上所述,BDNF蛋白在HSCC癌组织中表达水平显著高于癌旁组织及正常咽部黏膜组织,且表达水平与肿瘤直径、分化程度、是否淋巴结转移及临床分期密切相关;并且通过实验发现BDNF蛋白可促进下咽鳞状细胞癌细胞系FaDu的侵袭转移能力,进一步说明BDNF的表达对HSCC的侵袭转移有作用。临床上可通过检测BDNF的表达来辅助判断患者肿预后,后期实验也可通过BDNF作为切入点进一步研究所涉及的相关通路,期许找到HSCC潜在的治疗靶点。
| [1] |
Newman JR, Connolly TM, Illing EA, et al. Survival trends in hypopharyngeal cancer: a population-based review[J]. Laryngoscope, 2015, 125(3): 624-629. DOI:10.1002/lary.24915 |
| [2] |
Hall SF, Groome PA, Irish J, et al. The natural history of patients with squamous cell carcinoma of the hypopharynx[J]. Laryngoscope, 2008, 118(8): 1362-1371. DOI:10.1097/MLG.0b013e318173dc4a |
| [3] |
Barde YA, Edgar D, Thoenen H. Purification of a new neurotrophic factor from mammalian brain[J]. EMBO J, 1982, 1(5): 549-553. DOI:10.1002/j.1460-2075.1982.tb01207.x |
| [4] |
Pritz CO, Bitsche M, Salvenmoser W, et al. Endocytic trafficking of silica nanoparticles in a cell line derived from the organ of Corti[J]. Nanomedicine (Lond), 2013, 8(2): 239-252. DOI:10.2217/nnm.12.91 |
| [5] |
Zhu L, Werner JA, Mandic R. Implications of tropomyosin-related kinase B (TrkB) in head and neck cancer[J]. Anticancer Res, 2007, 27(5A): 3121-3126. |
| [6] |
McGregor LM, McCune BK, Graff JR, et al. Roles of trk family neurotrophin receptors in medullary thyroid carcinoma development and progression[J]. Proc Natl Acad Sci U S A, 1999, 96(8): 4540-4545. DOI:10.1073/pnas.96.8.4540 |
| [7] |
de Moraes JK, Wagner VP, Fonseca FP, et al. Uncovering the role of brain-derived neurotrophic factor/tyrosine kinase receptor B signaling in head and neck malignancies[J]. J Oral Pathol Med, 2018, 47(3): 221-227. DOI:10.1111/jop.12611 |
| [8] |
Lee J, Jiffar T, Kupferman ME. A novel role for BDNF-TrkB in the regulation of chemotherapy resistance in head and neck squamous cell carcinoma[J]. PLoS One, 2012, 7(1): e30246. DOI:10.1371/journal.pone.0030246 |
| [9] |
Werner JA, Rathcke IO, Mandic R. The role of matrix metalloproteinases in squamous cell carcinomas of the head and neck[J]. Clin Exp Metastasis, 2002, 19(4): 275-282. DOI:10.1023/a:1015531319087 |
| [10] |
Garneau JC, Bakst RL, Miles BA. Hypopharyngeal cancer: A state of the art review[J]. Oral Oncol, 2018, 86: 244-250. DOI:10.1016/j.oraloncology.2018.09.025 |
| [11] |
Nakamura K, Martin KC, Jackson JK, et al. Brain-derived neurotrophic factor activation of TrkB induces vascular endothelial growth factor expression via hypoxia-inducible factor-1alpha in neuroblastoma cells[J]. Cancer Res, 2006, 66(8): 4249-4255. DOI:10.1158/0008-5472.CAN-05-2789 |
| [12] |
Odate S, Nakamura K, Onishi H, et al. TrkB/BDNF signaling pathway is a potential therapeutic target for pulmonary large cell neuroendocrine carcinoma[J]. Lung Cancer, 2013, 79(3): 205-214. DOI:10.1016/j.lungcan.2012.12.004 |
| [13] |
Ketterer K, Rao S, Friess H, et al. Reverse transcription-PCR analysis of laser-captured cells points to potential paracrine and autocrine actions of neurotrophins in pancreatic cancer[J]. Clin Cancer Res, 2003, 9(14): 5127-5136. |
| [14] |
Pearse RN, Swendeman SL, Li Y, et al. A neurotrophin axis in myeloma: TrkB and BDNF promote tumor-cell survival[J]. Blood, 2005, 105(11): 4429-4436. DOI:10.1182/blood-2004-08-3096 |
| [15] |
于晓辉. TrkB介导的失巢凋亡抑制与卵巢癌的转移和耐药[D]. 上海: 上海交通大学, 2007.
|
| [16] |
Ng YK, Wong EY, Lau CP, et al. K252a induces anoikis-sensitization with suppression of cellular migration in Epstein-Barr virus (EBV)-associated nasopharyngeal carcinoma cells[J]. Invest New Drugs, 2012, 30(1): 48-58. DOI:10.1007/s10637-010-9513-4 |
| [17] |
Xu H, Czerwinski P, Xia N, et al. Downregulation of BDNF Expression by PKC and by TNF-α in Human Endothelial Cells[J]. Pharmacology, 2015, 96(1-2): 1-10. DOI:10.1159/000430823 |
| [18] |
Kermani P, Hempstead B. Brain-derived neurotrophic factor: a newly described mediator of angiogenesis[J]. Trends Cardiovasc Med, 2007, 17(4): 140-143. DOI:10.1016/j.tcm.2007.03.002 |
| [19] |
Sasahira T, Ueda N, Yamamoto K, et al. Trks are novel oncogenes involved in the induction of neovascularization, tumor progression, and nodal metastasis in oral squamous cell carcinoma[J]. Clin Exp Metastasis, 2013, 30(2): 165-176. DOI:10.1007/s10585-012-9525-x |
| [20] |
Kupferman ME, Jiffar T, El-Naggar A, et al. TrkB induces EMT and has a key role in invasion of head and neck squamous cell carcinoma[J]. Oncogene, 2010, 29(14): 2047-2059. DOI:10.1038/onc.2009.486 |
| [21] |
Jiffar T, Yilmaz T, Lee J, et al. Brain derived neutrophic factor (BDNF) coordinates lympho-vascular metastasis through a fibroblast-governed paracrine axis in the tumor microenvironment[J]. Cancer Cell Microenviron, 2017, 4(2). DOI:10.14800/ccm.1566 |
| [22] |
Dudás J, Bitsche M, Schartinger V, et al. Fibroblasts produce brain-derived neurotrophic factor and induce mesenchymal transition of oral tumor cells[J]. Oral Oncol, 2011, 47(2): 98-103. DOI:10.1016/j.oraloncology.2010.11.002 |
| [23] |
Dudás J, Riml A, Tuertscher R, et al. Brain-Derived Neurotrophin and TrkB in Head and Neck Squamous Cell Carcinoma[J]. Int J Mol Sci, 2019, 20(2). DOI:10.3390/ijms20020272 |



