2. 济宁医学院附属医院, 济宁 272029
2. Affiliated Hospital of Jining Medical University, Jining 272029, China
心血管疾病已成为我国居民死因首位,在疾病死亡构成中占40%以上,其患病率及死亡率仍呈上升趋势[1]。主动脉壁间血肿(Intramural hemorrhage,IMH)和主动脉夹层(Aortic dissection,AD)是两种心血管疾病。两者均以急性胸痛为主要表现的危急重症,其临床表现复杂多变,病程进展迅速、病死率高。IMH患者常需药物治疗,而AD患者在症状出现后每过1h,其死亡率增加1%~2%[2]。因此,主动脉壁间血肿和主动脉夹层患者均需要快速鉴别诊断。血清sST2作为一种新型心衰标志物,能够早期预测心肌纤维化、心室重构,并且其检测方法简单、易行,近年来已成为研究的热点[3]。目前sST2在主动脉疾病诊断中的应用研究却极为少见。本研究对从济宁医学院附属医院和南京市第一医院收集的40位主动脉夹层患者和52位主动脉壁间血肿患者的血清sST2浓度进行分析,以期得到sST2在诊断IMH和AD上的价值。
1 资料与方法 1.1 研究对象选取2020年10月至2021年8月于济宁医学院附属医院和南京市第一医院住院患者92例,其中主动脉壁间血肿患者52例,男性40例,女性12例,年龄(61.15±11.19)岁;主动脉夹层患者40例,其中男性37例,女性3例,年龄(57.18±11.18)岁。记录患者一般资料(包括性别,年龄,诊断,肌酐,尿素,碱性磷酸酶等)。分组标准:根据患者疾病类型分为主动脉壁间血肿组和主动脉夹层组。纳入标准: 1)主动脉壁间血肿患者:通过主动脉CTA,主动脉图像可满足诊断; 主动脉壁呈环形或新月形高密度增厚,厚度通常>7mm,CT值为60~70Hu,无内膜破口或真假腔血流交通[4]。主动脉夹层患者:经主动脉CTA检查见内膜破口或真假腔相通,诊断为Stanford B型主动脉夹层患者(Stanford A型夹层患者因病情危急,常需急诊手术而排除)。排除标准:外伤性主动脉壁增厚的非壁间血肿患者,如慢性血栓闭塞型主动脉夹层、主动脉粥样硬化附壁血栓形成、主动脉瘤附壁血栓形成、动脉炎及动脉周围炎等; 碘过敏试验阳性; 促甲状腺激素异常者;合并严重肝肾功能不全者。纳入的所有患者一般资料详细完整,均签署知情同意书,医院伦理委员会批准。
1.2 sST2与D-二聚体的检测患者入院后立即抽取肘静脉血3~5ml,选择无明显脂血、溶血和黄疸的标本分离血清备检,临床疑似病例在CT确诊后立即采样。选择3000r/min离心10min,分离上清液,取血清分装于EP离心管中,置于-20℃的冰箱中。后采用双抗夹心ELISA法测定血清sST2和D-二聚体浓度,试剂盒均由江莱生物公司研制,严格按照试剂盒使用说明书进行操作。
1.3 统计学方法应用SPSS25.0软件进行统计分析。符合正态分布的连续变量采用x±s表示,采用独立样本t检验;不符合正态分布的采用M(P25, P75)描述,采用Mann-Whitney U检验, 分类变量采用卡方检验。P < 0.05认为具有统计学意义。采用受试者工作曲线比较分析sST2、D-二聚体以及两者联合对主动脉壁间血肿、主动脉夹层的诊断价值并得出诊断的最佳界限值。
2 结果 2.1 患者的基础资料两组在性别、年龄、血脂、血钙、碱性磷酸酶、肌酐、D-二聚体方面差异无统计学意义(P>0.05)。两组sST2水平差异有统计学意义。见表 1。
| 表 1 两组间一般资料和血清指标比较 |
以主动脉夹层组为状态变量,得到sST2的曲线下最大面积为0.788,95%CI(0.694,0.882),P < 0.05,sST2对主动脉夹层有诊断价值,最佳界值为27.84ng/mL(敏感度为0.80, 特异性为0.71)。D-二聚体的曲线下最大面积为0.618,95%CI(0.498,0.738),最佳界值为1.215ng/mL.;D-二聚体与sST2联合诊断主动脉夹层,曲线下面积0.216,无诊断价值。见图 1。
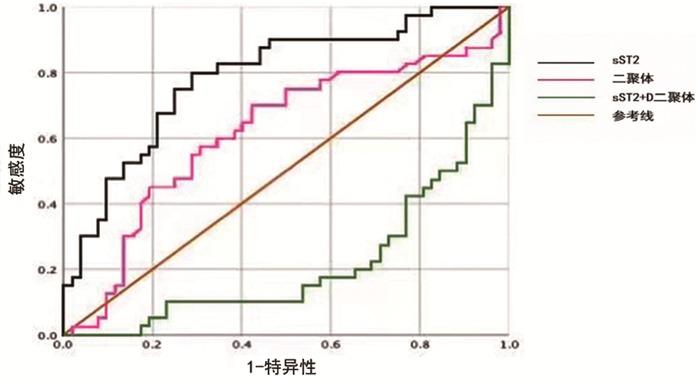
|
图 1 sST2和D-二聚体诊断主动脉夹层的ROC曲线 |
以主动脉血肿组为状态变量,可以看到sST2和D-二聚体曲线下面积分别为0.212、0.382,说明两者对血肿均无诊断意义,D-二聚体与sST2联合检测曲线下面积0.784,95%CI(0.689,0.879)最佳界值敏感度0.692,特异性为0.80,两项联合对主动脉壁间血肿有一定诊断价值。见图 2。
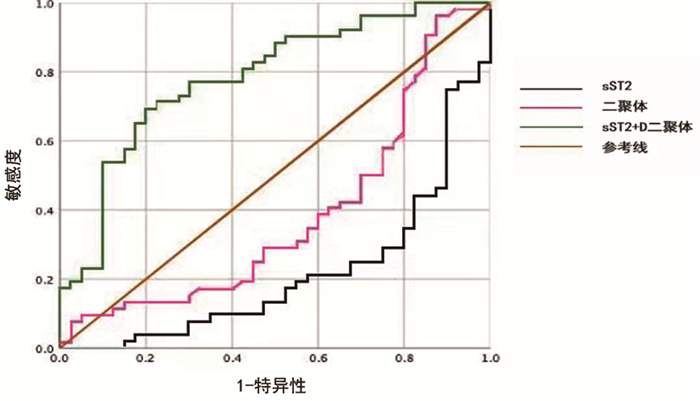
|
图 2 sST2和D-二聚体诊断主动脉壁间血肿的ROC曲线 |
IMH由Krukenberg在1920年首次提出,是由主动脉中层滋养血管破裂后动脉斑块位移所致[5]。IMH是一个潜在的致死性疾病,血肿可以完全吸收,也可以进展为动脉瘤、AD、破裂等,危及患者生命[6];AD指主动脉腔内血液从主动脉内膜撕裂处进入主动脉中膜,使中膜分离,沿主动脉长轴方向扩展形成主动脉壁的真假两腔分离状态[7]。
IMH与AD临床症状高度相似,但治疗方案差异较大,因此早期鉴别诊断并进行适当的治疗, 对改善患者预后, 促进早期康复起到极其重要的作用[8]。CT血管造影是区别、诊断该类疾病的金标准,也是监测IMH和AD病情演变的必要条件[9]。但CT血管造影存在诸多客观条件限制其应用范围,如检查费用昂贵、检查时间长、转运及检查风险高、很多基层医院尚不能实现24h增强CT等。另外CT血管造影中造影剂的高压输入有导致夹层剥离范围加大甚至是破裂的风险,对IMH和AD患者同样是一危险因素。部分碘过敏、严重肾衰患者同样难以接受CT血管造影。因此,临床上急需一种诊断效能较高的检验指标,以帮助医生对IMH、AD患者进行快速准确的诊断。
D-二聚体在临床上多用于深静脉血栓、肺栓塞等血栓性疾病的诊断、疗效评估、预后判断,它是纤维蛋白经纤溶酶水解产生的降解产物,反映机体的纤维蛋白水解功能。Shimony等[10]研究发现D-二聚体也可用于AD的诊断、鉴别诊断、预后评估。ST2是IL-1受体家族成员,主要有两种亚型,分别为跨膜型ST2(ST2L)和可溶性ST2(sST2)[11]。其中sST2可以作为一种与心血管损伤相关的生物标志物,主要由心肌细胞和心肌成纤维细胞、冠脉及大血管内皮细胞在损伤和应激反应下产生,在心衰的诊断、预后评估等方面发挥作用[12]。近年研究发现sST2在血液中的含量水平可反映心脏的负荷状况[13]。2017年美国心脏病学会/美国心脏协会/美国心力衰竭协会(ACC/AHA/HFSA)更新了HF指南,推荐sST2作为心力衰竭监测和预后评估的生物标志物[14]。研究发现,AD患者sST2蛋白浓度显著高于肺栓塞及心梗患者[15]。
本文结果显示,AD患者血清sST2浓度显著高于IMH患者,对AD诊断得到sST2的曲线下最大面积为0.772,最佳界值为27.84ng/mL,D-二聚体的曲线下最大面积为0.603,最佳界值为1.215mg/L,两者联合诊断曲线位于下方,不具有诊断意义。sST2对AD具有诊断意义,且对于AD的诊断意义强于D-二聚体;对IMH不具有诊断意义。D-二聚体对于AD具有诊断意义,但诊断意义不如sST2;对IMH不具有诊断意义。sST2和D-二聚体的联合应用对AD无诊断意义,但对IMH具有诊断意义。
本研究具有的一定的局限性:缺乏正常人群的对照;样本数量相对较少;样本采自患者入院24h内,缺乏对患者多时间点的连续检测,以便寻找最佳的诊断时机和最佳界值;AD患者纳入Stanford B型,未包含Stanford A型。
总之,根据我们的研究结果,可以将sST2在临床上用于AD的辅助诊断以及AD与IMH的鉴别诊断;可以将sST2和D-二聚体联合在临床上用于IMH的辅助诊断以及IMH与AD的鉴别诊断。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
朱雪敏, 血清sST2在慢性心衰并房颤患者中的水平变化及临床意义[D]. 福州: 福建医科大学, 2018.
|
| [2] |
Pape LA, Awais M, Woznicki EM, et al. Presentation, diagnosis, and outcomes of acute aortic dissection: 17-year trends from the international registry of acute aortic dissection[J]. J Am Coll Cardiol, 2015, 66(4): 350-358. DOI:10.1016/j.jacc.2015.05.029 |
| [3] |
Gaggin HK, Szymonifka J, Bhardwaj A, et al. Head-to-head comparison of serial soluble ST2, growth differentiation factor-15, and highly-sensitive troponin T measurements in patients with chronic heart failure[J]. JACC Heart Fail, 2014, 2(1): 65-72. DOI:10.1016/j.jchf.2013.10.005 |
| [4] |
Sueyoshi E, Onizuka H, Nagayama H, et al. Clinical importance of minimal enhancement of type B intramural hematoma of the aorta on computed tomography imaging[J]. J Vasc Surg, 2017, 65(1): 30-39. DOI:10.1016/j.jvs.2016.06.117 |
| [5] |
Marquardt E, Martini AK. Krukenberg-plasty in the E.Marquardt modification[J]. Handchir Mikrochir Plast Chir, 1985, 17(3): 117-121. |
| [6] |
AkinI, Kische S, Ince H, et al. Penterating aortic ulcer, intramural hematoma, acute aortic syndrome: when to do what[J]. J Cardiovasc Surg, 2012, 53(1): 83-90. |
| [7] |
李杨, 李洪利, 冯磊, 等. 急性主动脉夹层诊断与鉴别诊断PBL教学课程的设计与实践[J]. 中国循证心血管医学杂志, 2021, 13(7): 889-891. DOI:10.3969/j.issn.1674-4055.2021.07.34 |
| [8] |
朱杰昌, 戴向晨, 罗宇东, 等. 开窗胸主动脉修复术治疗伴有不良锚定区的急性Stanford B型夹层的早期结果分析[J]. 中华血管外科杂志, 2017, 2(2): 107-111. |
| [9] |
邹艳君, 肖振平. 主动脉壁间血肿影像学诊断及预后评估的研究进展[J]. 心肺血管病杂志, 2021, 40(6): 646-648. |
| [10] |
Shimony A, Filion KB, Mottillo S, et al. Meta-analysis of usefulness of d-dimer to diagnose acute aortic dissection[J]. Am J Cardiol, 2011, 107(8): 1227-1234. DOI:10.1016/j.amjcard.2010.12.027 |
| [11] |
Lotierzo M, Dupuy AM, Kalmanovich E, et al. sST2 as a value-added biomarker in heart failure[J]. Clin Chim Acta, 2020, 501: 120-130. DOI:10.1016/j.cca.2019.10.029 |
| [12] |
Weir RA, Miller AM, Murphy GE, et al. Serum soluble ST2:a potential novel mediator in left ventricular and infarct remodeling after acute myocardial infarction[J]. J Am Coll Cardiol, 2010, 55(3): 243-250. DOI:10.1016/j.jacc.2009.08.047 |
| [13] |
Chen WY, Hong J, Gannon J, et al. Myocardial pressure overload induces systemic inflammation through endothelial cell IL-33[J]. Proc Natl Acad Sci U S A, 2015, 112(23): 7249-7254. DOI:10.1073/pnas.1424236112 |
| [14] |
Pascual-Figal DA, Januzzi JL. The biology of ST2:the international ST2 consensus panel[J]. Am J Cardiol, 2015, 115(7 Suppl): 38-7B. DOI:10.1016/j.amjcard.2015.01.034 |
| [15] |
Miller AM. Role of IL-33 in inflammation and disease[J]. J Inflamm (Lond), 2011, 8(1): 22. DOI:10.1186/1476-9255-8-22 |



