2. 沈阳药科大学中药学院, 沈阳 110016;
3. 潍坊医学院药学院, 潍坊 261053
2. College of Traditional Chinese Medicine, Shenyang Pharmaceutical University, Shenyang 110016, China;
3. College of Pharmacy, Weifang Medical University, Weifang 261053, China
宫颈癌是女性最常见的恶性肿瘤之一,是仅次于乳腺癌、结直肠癌和肺癌的女性第4大常见癌症[1]。《全球癌症报告》统计,2020年全球新增宫颈癌病例为604000例,死亡人数为342000人[2]。西医对宫颈癌的一线治疗手段包括手术或化疗和放疗的联合应用[3-4],但此类方法疗效低,副作用大,一旦复发往往无法治愈[5-6]。中医药在治疗宫颈癌上具有独特的优势,中医将宫颈癌归属于“五色带”“癥瘕”“阴疮”等范畴[7],具有丰富的临床治疗经验,而中药具有多组分、多靶点、协同作用的特点,且疗效好,副作用少[8]。
中国药典记载徐长卿(Cynanchi Paniculati Radix et Rhizoma)为萝藦科鹅绒藤属植物徐长卿(Cynanchum paniculatum (Bge.) Kitag.)的干燥根和根茎,具有祛风除湿止痛的功效[9]。徐长卿作为临床常用药,其主要化学成分C21甾体类、菲并吲哚里西定类生物碱、挥发油和多糖类物质,具有抗癌作用[10],能够抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡、抑制肿瘤侵袭转移、抑制肿瘤血管形成[11],但其治疗宫颈癌的作用机制却鲜有报道。本研究采用网络药理学与分子对接的方法,初步探究徐长卿治疗宫颈癌的有效成分、关键靶点和作用通路,为其后续的实验验证和临床应用提供理论基础。
1 资料与方法 1.1 徐长卿活性成分的筛选利用中药系统药理学数据库与分析平台(TCMSP,https://old.tcmsp-e.com/tcmsp.php)获取徐长卿的所有活性成分,根据药物代谢动力学特性进行筛选,以口服生物利用度(Oral bioavailability,OB)≥30%、药物相似性(Drug-like,DL)≥0.18为筛选依据[12],获得徐长卿的有效活性成分。
1.2 徐长卿活性成分作用靶点的预测利用Pubchem平台(https://pubchem.ncbi.nlm.nih.gov)获取徐长卿中筛选出的每个活性成分对应的Smiles号,以Smiles号为关键词在以下2个数据库进行检索,限定筛选条件为Homo Sapiens,获得徐长卿活性成分作用靶点:1)SwissTargetPrediction数据库(http://www.swisstargetprediction.ch),选择排名前15的靶点;2)Targetnet数据库(http://targetnet.scbdd.com),选择Prob>0的靶点,再用Uniprot数据库(https://www.uniprot.org)转换基因名。
1.3 宫颈癌靶点的收集以“Cervical Cancer”为关键词在以下3个数据库进行搜索,获取宫颈癌靶点的相关信息:1)Genecards数据库(https://www.genecards.org),选择Score>20的靶点;2)OMIM数据库(https://www.omim.org);3)TTD数据库(http://db.idrblab.net/ttd)。
1.4 核心靶点的筛选利用Venny(https://bioinfogp.cnb.csic.es/tools/venny)在线工具绘制徐长卿有效活性成分靶点和宫颈癌作用靶点的韦恩图,得到交集靶点。
1.5 蛋白-蛋白相互作用(PPI)网络分析通过String数据库(https://string-db.org)将筛选得到的徐长卿有效活性成分与宫颈癌交集靶点蛋白的基因名上传到该数据库,物种设置为Homo Sapiens,构建蛋白─蛋白相互作用(PPI)网络。以大于平均度值(Degree)为筛选条件,选择徐长卿治疗宫颈癌的关键靶点。
1.6 KEGG信号通路及GO通路富集分析利用Metascape数据库(https://metascape.org)对交集靶点分别进行KEGG信号通路富集分析和GO通路富集分析。物种选择H.Sapiens,进行Custom Analysis,在下属Enrichment Analysis工具中的列表中分别进行KEGG Pathway、GO Molecular Functions、GO Biological Processes和GO Cellular Components分析,获取KEGG数据及GO数据。通过微生信在线工具(www.bioinformatics.com.cn)将KEGG数据及GO数据进行可视化分析,绘制KEGG通路富集气泡图和GO细胞组分、分子功能、生物过程三合一图。
2 结果 2.1 徐长卿活性成分将TCMSP数据库获取得到的徐长卿活性成分,以OB和DL值筛选,共得到6个化合物,分别为Tomentolide A、cynapanoside C、cynatratoside B、sitosterol、sarcostin和tomentogenin。见表 1。
| 表 1 徐长卿活性成分 |
检索Swiss Target Prediction和Targetnet在线数据库共得到徐长卿活性成分的靶点共188个。检索Genecards、OMIM、TTD 3个在线数据库共得到1014个宫颈癌的相关靶点。将上述数据利用Venny图得到24个交集靶点(图 1),主要包括JUN、MMP2、AURKA、MET、AR、DNMT1等(表 2)。

|
图 1 徐长卿与宫颈癌交集基因 |
| 表 2 徐长卿治疗宫颈癌相关靶点 |
利用Cytoscape3.9.1软件构建徐长卿─活性成分─靶点相互作用网络图,得到了1个包括31个点和50条边的网络(图 2)。图中蓝色部分代表徐长卿,绿色部分代表有效成分,黄色部分代表靶点名称。依据有效成分与靶点交集数量由大到小排名,分别为14、8、6、6、5、5,对应的有效成分依次是Tomentolide A、cynatratoside B、cynapanoside C、tomentogenin、sarcostion、sitosterol。
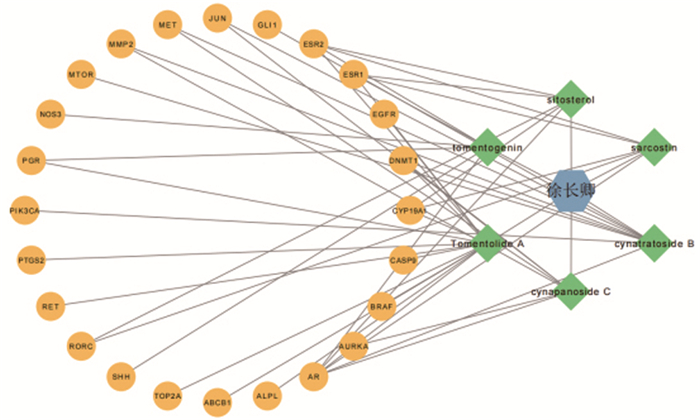
|
图 2 徐长卿—活性成分—靶点相互作用网络图 |
将徐长卿治疗宫颈癌相关的24个交集靶点输入String数据库(https://string-db.org)进行PPI网络分析,得到蛋白─蛋白相互作用网络图(图 3)。利用Cytoscape软件分析网络图,结果显示该网络图包含22个点,144条边,平均Degree值为10.36,平均局部聚类系数0.777。以大于Degree平均值为筛选条件,共选出8个关键靶点,分别为EGFR、ESR1、JUN、MTOR、PTGS2、PIK3CA、AR、PGR。
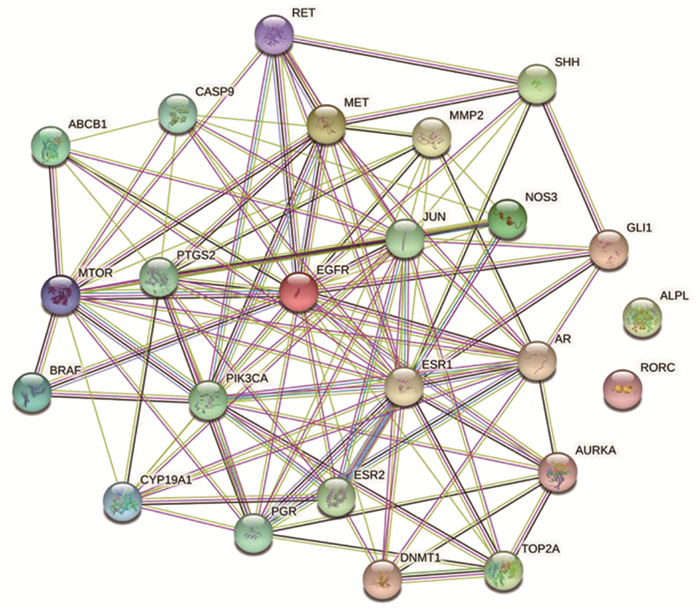
|
图 3 蛋白质相互作用关系网络图 |
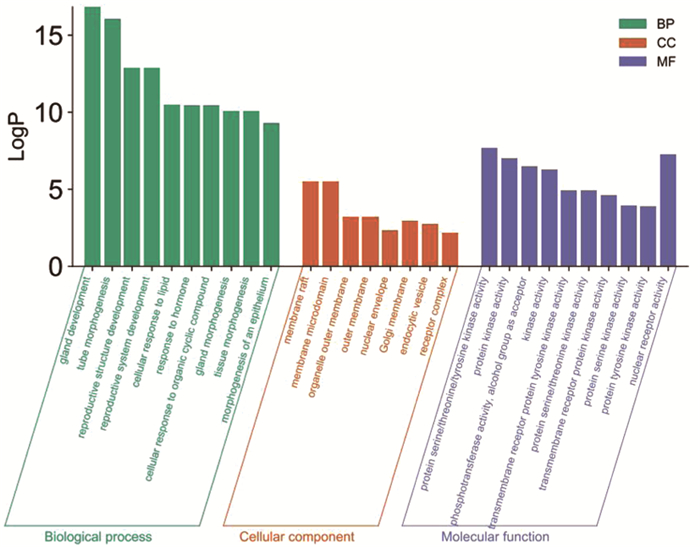
KEGG通路富集分析中主要涉及的通路有Pathways in cancer、Endocrine resistance、Estrogen signaling pathway、Breast cancer等信号通路(图 4),其中排名最高的Pathways in cancer通路,利用KEGG信号通路数据库进行解读,得到图 5。GO富集分析结果显示,Biological Processes分析主要包括gland development、tube morphogenesis、reproductive structure development等;Cellular Components分析主要包括membrane raft、membrane microdomain、organelle outer membrane等;Molecular Functions分析主要包括protein serine/threonine/tyrosine kinase activity、protein kinase activity、phosphotransferase activity, alcohol group as acceptor等(图 6)。
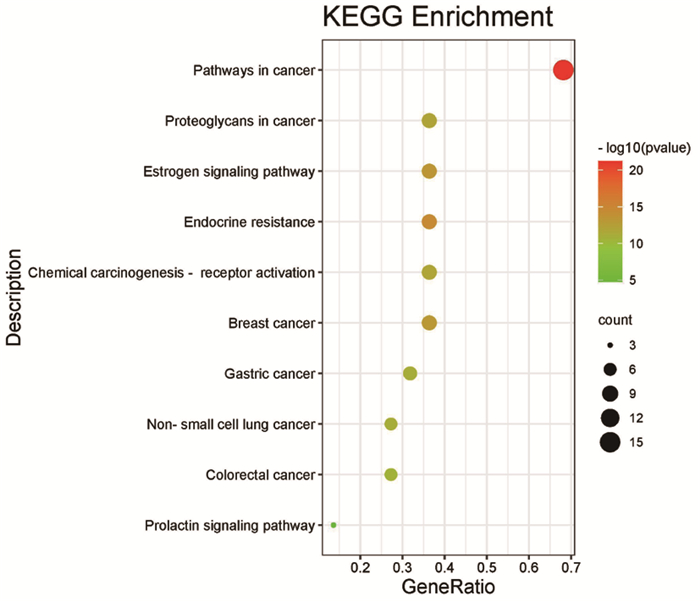
|
图 4 徐长卿治疗宫颈癌靶点的KEGG通路分析 |
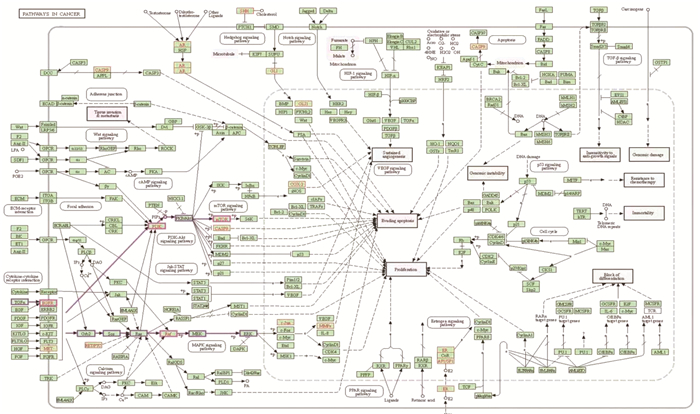
|
图 5 徐长卿交集靶点与Pathways in cancer通路 |
|
图 6 徐长卿治疗宫颈癌靶点的GO分析 |
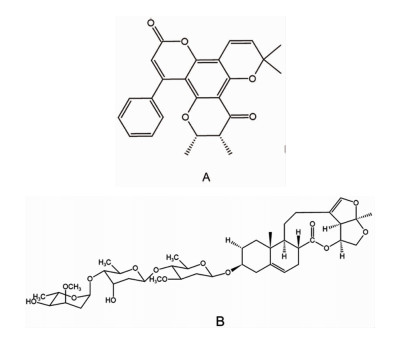
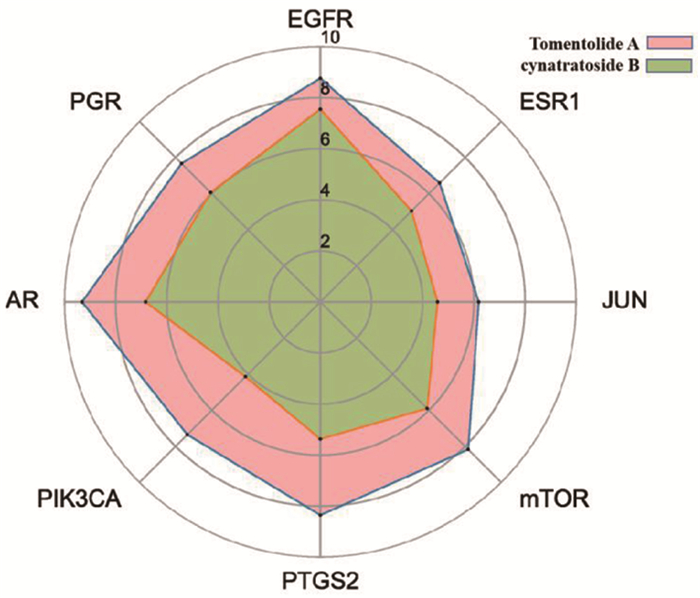
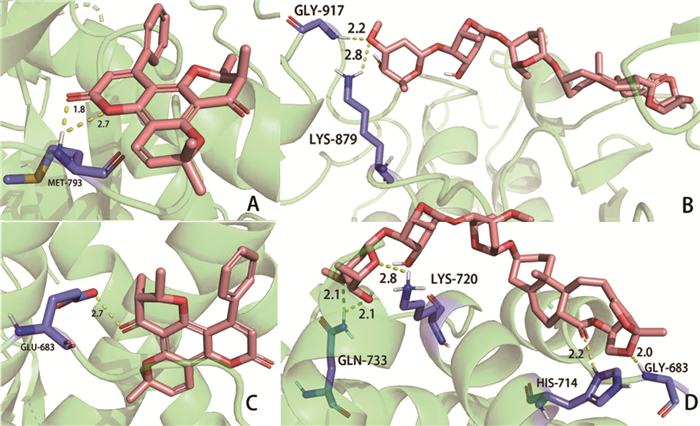
基于已有数据,选择与靶点交集数量较多的有效成分Tomentolide A和cynatratoside B(图 7),与徐长卿治疗宫颈癌的8个关键靶点进行分子对接。关键靶点蛋白核心结构的pdb文件下载自蛋白质数据库RCSB PDB(https://www.rcsb.org)[13]:EGFR[5UG9(PDB ID, 下同)]、ESR1(7NFW)、JUN(5T01)、MTOR(5WBH)、PTGS2(5IKR)、PIK3CA(7L1C)、AR(4OHA)、PGR(1SQN)。由Chem3D 20.0.0.41软件画出Tomentolide A和cynatratoside B的分子3D结构图,使用OpenBabel 3.1.1软件转换小分子与蛋白文件格式,利用AutoDockTools 1.5.7软件进行分子对接,并用PyMol 2.5.0软件对分子对接结果进行分析。分子对接最低结合能数据如表 3所示,利用最低结合能的绝对值作雷达图进行可视化分析(图 8)。当结合能≤-5 kcal/mol时判定有效成分与靶点蛋白结合较为稳定[14],发现Tomentolide A和cynatratoside B分别与表皮生长因子受体(EGFR)、雄激素受体(AR)的对接最稳定,充分说明了徐长卿对宫颈癌的稳定作用。对接结果见分子蛋白对接模拟图(图 9)和对接口袋结构图(图 10)。
|
图 7 有效成分结构式 注:A.Tomentolide A;B.cynatratoside B |
| 表 3 最低结合自由能(kcal/mol) |
|
图 8 分子对接数据雷达图 |
|
图 9 分子蛋白对接模拟图 注:A.EGFR与Tomentolide A在MET-793位点结合;B.EGFR与cynatratoside B在GLY-917、LYS-879位点结合;C.AR与Tomentolide A在GLU-683位点结合;D.AR与cynatratoside B在GLN-733、LYS-720、HIS-714、GLY-683位点结合 |

|
图 10 对接口袋结构图 注:A.EGFR与Tomentolide A;B.EGFR与cynatratoside B;C.AR与Tomentolide A;D.AR与cynatratoside B |
本研究利用网络药理学和分子对接技术,整体评价了徐长卿与宫颈癌的相互作用关系,预测了徐长卿作用于宫颈癌的分子机制。通过TCMSP数据库筛选发现徐长卿治疗宫颈癌的主要活性成分包括Tomentolide A、cynapanoside C、cynatratoside B、sitosterol、sarcostin和tomentogenin,并交集得到24个与宫颈癌相关的徐长卿的作用靶点。通过String在线数据平台构建PPI网络,筛选出8个相互作用度较高的关键靶点,分别为EGFR、ESR1、JUN、MTOR、PTGS2、PIK3CA、AR、PGR。其中EGFR的扩增、缺失、突变和过表达激活酪氨酸激酶,会启动一系列下游信号通路,从而调节肿瘤细胞的增殖、分化、促进恶性肿瘤的发展[15-16]。有研究表明,PIK3CA激酶活性的增强导致PI3K/AKT/MTOR信号通路的激活[17-19],其中MTOR起到丝氨酸/苏氨酸蛋白激酶的作用,是细胞生长的关键蛋白,在细胞代谢和增殖中发挥重要作用[20]。临床研究发现,在从健康的宫颈组织到癌变的宫颈组织发展过程中,AR的表达逐渐降低,加剧了宫颈癌细胞的增殖与侵袭[21]。这提示徐长卿治疗宫颈癌的机制可能与抑制肿瘤发展和促进肿瘤细胞凋亡最为相关。
KEGG信号通路富集分析表明Pathways in cancer通路与徐长卿治疗宫颈癌最为相关,其中EGFR蛋白引起了笔者关注,作为一种肌动蛋白结合蛋白,目前已成为肿瘤治疗中不可缺少的靶点[22]。如图 5所示,以EGFR为起始靶点的PI3K/AKT/MTOR和Ras/Raf/MEK/ERK两条信号通路[23-24],可能是徐长卿发挥治疗作用的重要通路。PI3K/AKT/MTOR通路在肿瘤发展中具有控制细胞生长增殖和凋亡功能[25],在宫颈癌组织中PI3K/AKT/MTOR基因及蛋白水平随着癌症恶性程度的增加而升高[26]。Ras/Raf/MEK/ERK信号通路在促进细胞生长,化疗耐药和靶向治疗敏感性方面发挥重要作用,抑制此信号通路的异常激活是降低癌细胞增殖的一种治疗方式[27]。这两条信号通路均与宫颈癌密切相关[28-30],这为我们深入探讨徐长卿抗癌的药理作用提供了思路。
通过GO富集分析发现,腺体发育(gland development)通路在Biological Processes中富集较高,Fan等[21]发现,雌激素受体α(ERα)和雄激素受体(AR)的过表达会显著抑制宫颈癌细胞的增殖与侵袭,这提示腺体发育水平对激素分泌的影响可能与宫颈癌的发展有关。此外,Molecular Functions高富集的蛋白丝氨酸/苏氨酸/酪氨酸激酶活性(protein serine / threonine / tyrosine kinase activity)通路也进一步佐证了PI3K/AKT/MTOR通路与徐长卿治疗宫颈癌的相关性,因为MTOR具有丝氨酸/苏氨酸/酪氨酸蛋白激酶的作用,可以调节细胞生长、增殖和蛋白质的合成,自噬和转录[31-32]。
综上所述,本研究运用网络药理学的方法,筛选得到徐长卿治疗宫颈癌的活性成分和关键靶点,并利用分子对接的分析方法,验证了徐长卿对关键靶点的作用方式。基于通路富集分析,发现徐长卿可能通过抑制宫颈癌细胞的增殖与促进癌细胞的凋亡,从而达到治疗宫颈癌的作用。目前本课题组正在进行徐长卿抗肿瘤活性成分的分离及结构鉴定,本研究后续将进行蛋白水平实验、细胞实验和动物实验[33],进一步验证其治疗宫颈癌的作用机制,从而明确徐长卿治疗宫颈癌的药理作用。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Buskwofie A, David-West G, Clare CA, et al. A Review of cervical cancer: incidence and disparities[J]. Natl Med Assoc, 2020, 112(2): 229-232. DOI:10.1016/j.jnma.2020.03.002 |
| [2] |
Sung H, Ferlay J, Siegel RL, et al. Global cancer statistics 2020:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2021, 71(3): 209-249. DOI:10.3322/caac.21660 |
| [3] |
Lea JS, Lin KY. Cervical cancer[J]. Obstet Gynecol Clin North Am, 2012, 39(2): 233-253. DOI:10.1097/01.AOG.0000215986.48590.79 |
| [4] |
Mauricio D, Zeybek B, Tymon-Rosario J, et al. Immunotherapy in cervical cancer[J]. Curr Oncol Rep, 2021, 23(6): 61. DOI:10.1007/s11912-021-01052-8 |
| [5] |
Wendel Naumann R, Leath CA 3rd. Advances in immunotherapy for cervical cancer[J]. Curr Opin Oncol, 2020, 32(5): 481-487. DOI:10.1097/CCO.0000000000000663 |
| [6] |
Hill EK. Updates in cervical cancer treatment[J]. Clin Obstet Gynecol, 2020, 63(1): 3-11. DOI:10.1097/GRF.0000000000000507 |
| [7] |
韩凤娟, 姜婷婷, 张茗. 中医药在宫颈癌治疗中的作用及其机制研究[J]. 天津中医药大学学报, 2018, 37(1): 80-83. DOI:10.11656/j.issn.1673-9043.2018.01.19 |
| [8] |
王忠, 陈寅萤, 张盈颖, 等. 多组分多靶点中药药理作用机制研究中的问题和解决策略[J]. 中国实验方剂学杂志, 2018, 24(5): 1-6. DOI:10.13422/j.cnki.syfjx.2018050001 |
| [9] |
国家药典委员会. 中国药典: 一部[M]. 北京: 中国医药科技出版社, 2020: 298.
|
| [10] |
李葆林, 杨梦婷, 支雅婧, 等. 徐长卿化学成分和药理作用的研究进展及质量标志物(Q-Marker)预测分析[J]. 中草药, 2021, 52(12): 3725-3735. DOI:10.7501/j.issn.0253-2670.2021.12.031 |
| [11] |
刘同亭. 徐长卿抗肿瘤分子生物学机制的研究进展[J]. 实用医药杂志, 2016, 33(5): 455-458. DOI:10.14172/j.issn1671-4008.2016.05.032 |
| [12] |
李磊, 吴东良, 阎玥, 等. 基于网络药理学探讨徐长卿-紫草-地肤子治疗湿疹的作用机制[J]. 现代中医药, 2022, 42(1): 40-47. DOI:10.13424/j.cnki.mtcm.2022.01.007 |
| [13] |
杨杰, 彭启伦, 郭步伐, 等. 半夏-附子药对拮抗冠心病分子机制研究[J]. 现代中医药, 2022, 42(2): 54-62. 现代中医药, 2022, 42(2): 54-62. DOI: 10.13424/j.cnki.mtcm.2022.02.010.
|
| [14] |
贾瑞康, 刘会云, 睢建亮, 等. 小儿风热清抗新型冠状病毒肺炎网络药理学研究[J]. 现代中医药, 2021, 41(6): 22-33. DOI:10.13424/j.cnki.mtcm.2021.06.005 |
| [15] |
Sabbah DA, Hajjo R, Sweidan K. Review on epidermal growth factor receptor(EGFR) structure, signaling pathways, interactions, and recent updates of egfr inhibitors[J]. Curr Top Med Chem, 2020, 20(10): 815-834. DOI:10.2174/1568026620666200303123102 |
| [16] |
Singh D, Attri BK, Gill RK, et al. Review on EGFR inhibitors: critical updates[J]. Mini Rev Med Chem, 2016, 16(14): 1134-1166. DOI:10.2174/1389557516666160321114917 |
| [17] |
Pergialiotis V, Nikolaou C, Haidopoulos D, et al. PIK3CA mutations and their impact on survival outcomes of patients with cervical cancer: A systematic review[J]. Acta Cytol, 2020, 64(6): 547-555. DOI:10.1159/000509095 |
| [18] |
Martell K, McIntyre JB, Kornaga EN, et al. PIK3CA mutation and CNV status and post-chemoradiotherapy survival in patients with cervical cancer[J]. Gynecol Oncol, 2020, 158(3): 776-784. DOI:10.1016/j.ygyno.2020.06.506 |
| [19] |
Mosele F, Stefanovska B, Lusque A, et al. Outcome and molecular landscape of patients with PIK3CA-mutated metastatic breast cancer[J]. Ann Oncol, 2020, 31(3): 377-386. DOI:10.1016/j.annonc.2019.11.006 |
| [20] |
Yang Y, Wang Q, Song D, et al. Lysosomal dysfunction and autophagy blockade contribute to autophagy-related cancer suppressing peptide-induced cytotoxic death of cervical cancer cells through the AMPK/mTOR pathway[J]. J Exp Clin Cancer Res, 2020, 39(1): 197. DOI:10.1186/s13046-020-01701-z |
| [21] |
Fan Q, Huang T, Sun X, et al. miR-130a-3p promotes cell proliferation and invasion by targeting estrogen receptor α and androgen receptor in cervical cancer[J]. Exp Ther Med, 2021, 21(5): 414. DOI:10.3892/etm.2021.9858 |
| [22] |
Wang K, Zhu TN, Zhao RJ. Filamin A regulates EGFR/ERK/Akt signaling and affects colorectal cancer cell growth and migration[J]. Mol Med Rep, 2019, 20(4): 3671-3678. DOI:10.3892/mmr.2019.10622 |
| [23] |
Yi YW, Hong W, Kang HJ, et al. Inhibition of the PI3K/AKT pathway potentiates cytotoxicity of EGFR kinase inhibitors in triple-negative breast cancer cells[J]. J Cell Mol Med, 2013, 17(5): 648-656. DOI:10.1111/jcmm.12046 |
| [24] |
Wheeler DL, Dunn EF, Harari PM. Understanding resistance to EGFR inhibitors-impact on future treatment strategies[J]. Nat Rev Clin Oncol, 2010, 7(9): 493-507. DOI:10.1038/nrclinonc.2010.97 |
| [25] |
McLendon RE, Turner K, Perkinson K, et al. Second messenger systems in human gliomas[J]. Arch Pathol Lab Med, 2007, 131(10): 1585-1590. DOI:10.5858/2007-131-1585-SMSIHG |
| [26] |
Zhang W, Zhou Q, Wei Y, et al. The exosome-mediated PI3k/Akt/mTOR signaling pathway in cervical cancer[J]. Int J Clin Exp Pathol, 2019, 12(7): 2474-2484. |
| [27] |
Abrams SL, Steelman LS, Shelton JG, et al. The Raf/MEK/ERK pathway can govern drug resistance, apoptosis and sensitivity to targeted therapy[J]. Cell Cycle, 2010, 9(9): 1781-1791. DOI:10.4161/cc.9.9.11483 |
| [28] |
Li X, Zhao J, Yan T, et al. Cyanidin-3-O-glucoside and cisplatin inhibit proliferation and downregulate the PI3K/AKT/mTOR pathway in cervical cancer cells[J]. J Food Sci, 2021, 86(6): 2700-2712. DOI:10.1111/1750-3841.15740 |
| [29] |
Gui Y, Wang L, Huang Z. MiR-137 inhibits cervical cancer progression via down-modulating Notch1 and inhibiting the PI3K/AKT/mTOR signaling pathway[J]. Transl Cancer Res, 2021, 10(8): 3748-3756. DOI:10.21037/tcr-21-1049 |
| [30] |
Seshadri VD. Brucine promotes apoptosis in cervical cancer cells (ME-180) via suppression of inflammation and cell proliferation by regulating PI3K/AKT/mTOR signaling pathway[J]. Environ Toxicol, 2021, 36(9): 1841-1847. DOI:10.1002/tox.23304 |
| [31] |
Dogan F, Biray Avci C. Correlation between telomerase and mTOR pathway in cancer stem cells[J]. Gene, 2018, 641: 235-239. DOI:10.1016/j.gene.2017.09.072 |
| [32] |
Bhalla M, Law D, Dowd GC, et al. Host serine/threonine kinases mTOR and protein kinase C-α promote inlB-mediated entry of listeria monocytogenes[J]. Infect Immun, 2017, 85(7): e00087-17. DOI:10.1128/IAI.00087-17 |
| [33] |
牛明, 张斯琴, 张博, 等. 《网络药理学评价方法指南》解读[J]. 中草药, 2021, 52(14): 4119-4129. DOI:10.7501/j.issn.0253-2670.2021.14.001 |



