甲基苯丙胺(methamphetamine,METH)是一种精神活性药,滥用后会导致神经损伤和精神障碍。该药具有强烈的成瘾性。中缝背核(dorsal raphe nucleus, DRN)是中脑导水管腹侧的神经核,可调控情绪和认知功能。在奖励性饮酒行为中,MRI显示小鼠的DRN脑区激活[1]。内源性阿片受体通过DRN到伏隔核的神经通路调控小鼠的奖赏行为[2]。激活大鼠DRN中促肾上腺皮质激素释放因子受体1(CRF-R1)明显降低了吗啡诱导的条件性位置偏爱(conditioned place preference, CPP)评分[3]。这些研究说明DRN与药物成瘾相关,但DRN在METH成瘾中的作用和机制还不清楚。
本实验建立小鼠CPP动物模型,然后分析了METH诱导DRN神经元c-Fos表达情况,并通过化学遗传学抑制DRN神经元活性,检测对METH诱导CPP行为偏好的影响。最后,进行蛋白质谱分析,寻找差异表达的蛋白分子。本实验有助于揭示METH成瘾机制并发现针对性的干预靶点。
1 材料与方法 1.1 材料选用6~8周龄C57BL/6J雄性小鼠,体重20~25g,购于山东大学实验动物中心,所有动物实验符合山东大学实验动物伦理委员会要求。腺病毒AAV2/9-hSyn-hM4D(Gi)-mCherry和AAV2/9-hSyn-mCherry购自上海吉凯基因科技有限公司。兔抗小鼠C-Fos单克隆抗体购自Abcam公司。
1.2 方法 1.2.1 CPP行为检测实验动物均进行基线测试(pre-test),METH模型组分别在第1、3、5天给予METH腹腔注射(2mg/kg), 对照组注射等量生理盐水。两组动物均在白箱中训练,时长40min。在2、4、6d两组动物均给予生理盐水腹腔注射,在黑箱中训练。第7天自由探索15min,进行测试(test)。
1.2.2 脑内定位注射采用5%水合氯醛腹腔注射(0.75ml/100g),麻醉小鼠。将含钙指示剂的病毒AAV2/9-CMV-GCaMP6s-P2A-nls-dTomato注射至DRN脑区,坐标为前囟前AP: -4.5mm,旁开L: 0mm,硬膜下D: 3.1mm,注射300nL,3w后取脑切片检测Ca2+信号变化。在化学遗传学实验中,将AAV2/9-hSyn-hM4D(Gi)-mCherry和AAV2/9-hSyn-mCherry分别注射到METH模型组和对照组小鼠DRN脑区,待3w后病毒充分表达,CPP测试前30min腹腔注射叠氮平-N-氧化物(clozapine-N-oxide, CNO),剂量为3mg/kg。
1.2.3 免疫组织化学染色实验动物灌注取脑,固定6h后,置入30%蔗糖溶液内,4℃静置至沉入容器底部,切取含DRN脑区的组织块,行冰冻切片,厚度30μm。经5%二抗同源血清封闭1h后,给予兔抗小鼠c-Fos(1 ∶1000)孵育,4℃过夜。然后经羊抗兔二抗(1 ∶500)室温孵育2h,在荧光显微镜下观察分析。
1.2.4 蛋白提取及分析提取DRN脑区蛋白,以Bradford法测量蛋白浓度,-20℃储存。对蛋白进行还原和烷基化后,使用100mM Tris-HCl, (pH 8.5)稀释3倍,在1mM CaCl2的条件下用胰蛋白酶消化(酶与底物的比例为1 ∶50),持续处理16h(37℃)。经纯化、洗脱、干燥后,重新溶解于0.1%甲酸,行LC/MS-MS分析。
1.2.5 实时荧光定量PCR提取DRN区域组织的总RNA。通过NanoDrop检测RNA纯度。设计靶分子引物,在以下条件下进行PCR扩增:95℃ 3min,95℃ 5s和60℃ 30s,重复40个循环。以GAPDH为内参。引物序列见表 1。
| 表 1 引物序列 |
统计分析使用GraphPad Prism 9.0软件。正态分布的计量资料采用x±s描述,两组数据的比较采用独立样本t检验分析,组内比较采用配对资料的t检验分析。P < 0.05为差异具有统计学意义。
2 结果 2.1 小鼠CPP模型的建立采用METH腹腔注射建立小鼠CPP模型,评估METH引起的成瘾记忆(图 1a)。METH模型组小鼠在伴药箱中的运动轨迹较训练前密集,停留时间明显增加,较前产生了明显的CPP偏好(t=4.438, P < 0.05),而对照组小鼠测试时CPP分数与基线水平无明显差异(P>0.05)(图 1b, c)。这表明成功建立了METH诱导的CPP动物模型。

|
图 1 CPP模型的建立 注:a.METH诱导CPP模型建立示意图;b.对照组小鼠基线和测试的CPP评分;c.METH模型鼠基线和测试的CPP评分,测试时形成明显的CPP偏好(t=4.438, P < 0.05)。对照组n=4,METH模型组n=5。 |
METH模型小鼠DRN内大量神经元呈c-Fos阳性着色,这些c-Fos阳性细胞多沿DRN中线分布;对照组DRN内仅有少量散在的c-Fos阳性细胞(图 2a)。METH处理后c-Fos阳性细胞数较对照组明显增多(图 2b, t=4.065, P < 0.05),而且c-Fos阳性细胞比例也明显高于对照组(图 2b, t=4.529, P < 0.05)。

|
图 2 c-Fos免疫组织化学染色结果 注:a.METH诱导DRN c-Fos表达,对照组仅有少量阳性细胞分布;b.c-Fos阳性细胞数和阳性细胞比例统计分析。对照组n=4,METH模型组n=5;标尺:50μm。 |
将含Ca2+指示剂的病毒载体实施脑内注射,神经元转染后显示红色荧光,钙离子活动显示为绿色荧光(图 3 a)。对照组DRN神经元Ca2+信号荧光强度26.93±0.64,METH处理后Ca2+信号荧光强度为50.43±1.02,明显高于对照组(t=20.50, P < 0.001)。见图 3b、c。
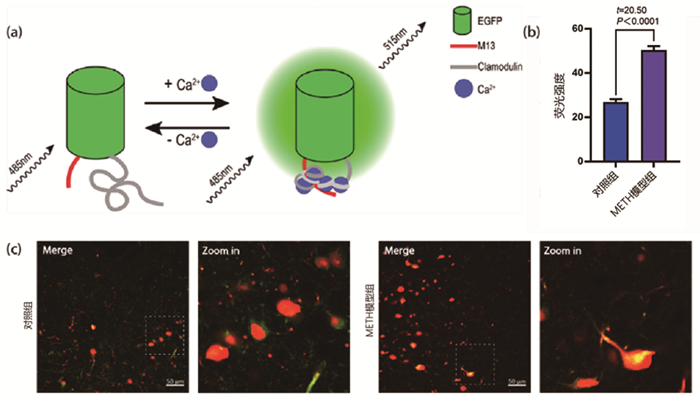
|
图 3 神经元胞内钙离子水平检测结果 注:a.示意图显示钙离子与GCaMP6结合后,分子构象改变导致了515nm波段发射荧光增加; b.为钙离子荧光强度统计分析; c.分别为对照组,METH组DRN神经元钙离子荧光检测图片。对照组n=3,METH模型组n=3;标尺:50μm。 |
本实验采用化学遗传学的方式抑制DRN脑区神经元(图 4 a)。在METH模型鼠测试前30min腹腔注射CNO,激活hM4Di抑制DRN神经元活性,结果显示,抑制后模型鼠的CPP分数明显降低(t=3.26, P < 0.05)。而对照组,在CNO诱导后,仍表现出CPP行为偏好(t=4.407, P < 0.05)。显示抑制DRN可以降低METH诱导的CPP偏好。
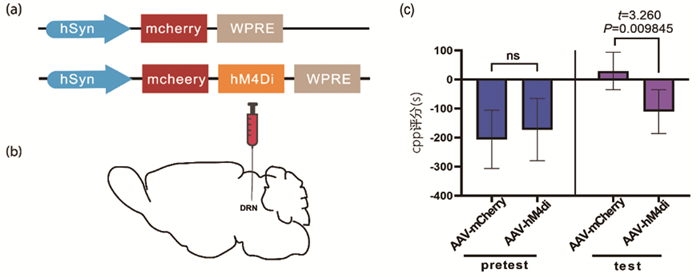
|
图 4 化学遗传学抑制DRN降低CPP评分 注:a.化学遗传学病毒载体元件构成; b.脑区注射示意图; c.CPP行为分析,抑制DRN脑区后,明显降低了CPP分数(P < 0.05)。对照组n=5,METH模型组n=6;ns:表示比较的两组数据没有差异。 |
本实验采用LC/MS-MS对DRN脑区组织进行了蛋白组学的分析。共获得了583个蛋白分子,其中13个表达上调,17个表达下调(设定差异倍数≥1.5倍及P < 0.05)(表 2,表 3)。筛选了部分和神经及突触相关的蛋白分子进行表达验证,其中突触囊泡蛋白1(Syt1)和细胞黏附分子1(Cadm1)表达升高(均P < 0.05);神经束蛋白(Nfasc)和突触小泡蛋白2(SV2)的C亚型Sv2c表达降低(均P < 0.05)。其中,Syt1的上调较为明显,上调近4倍(图 5)。
| 表 2 表达上调分子 |
| 表 3 表达下调分子 |

|
图 5 差异分子的表达验证 注:通过荧光定量PCR检测筛选分子的mRNA表达变化。a.检测Cadm1、ATP1B2、Stx1a的表达; b.检测Nfasc、Sv2c、Syt1的表达。对照组n=3,METH模型组n=3。 |
本实验发现,给予METH处理后,小鼠DRN内c-Fos阳性细胞明显多于对照组,同时DRN内钙离子信号强度增加,说明METH激活了DRN神经元。c-Fos作为即早基因,是Fos转录因子家族的成员之一,多数成瘾性药物如可卡因、吗啡、苯丙胺等可快速诱导c-Fos表达,活化神经元[4]。Ca2+是通用的第二信使,参与神经元去极化信号的传递并有助于突触活动的发生,所以对于神经元的活化至关重要。在吗啡成瘾中,通过在体多通道的电生理记录发现,DRN 5-HT神经元在吗啡作用下被激活[5]。并且,在吗啡诱导的CPP测试时,DRN内神经元活化明显。本项实验中,METH明显激活DRN神经元,提示这个脑区可能和METH导致的成瘾行为变化有关。
3.2 抑制DRN后显著降低CPP评分本实验通过化学遗传学手段抑制DRN脑区,显著降低了METH诱导的CPP评分。DRN内含有多种神经元,其中5-羟色胺(5-hydroxy tryptamine, 5-HT)能神经元最多,占DRN神经元总量的2/3。5-HT神经元投射广泛,也接受多个脑区的投射[6]。DRN 5-HT神经元从与奖赏信号密切相关的前脑和边缘系统接收广泛而密集的投射[7]。5-HT能神经元可控制情绪,学习和认知功能,感觉和运动的控制等[8]。最近研究发现,DRN的5-HT神经元编码奖赏信号[9]。我们推测,抑制DRN脑区导致CPP的逆转,很可能与DRN脑区的5-HT神经元有关。
3.3 DRN脑区蛋白组学分析本实验对METH模型鼠的DRN组织进行了蛋白质组学分析,获得了一批差异变化的蛋白分子,其中和突触相关的分子变化显著,如Syt1表达明显上调,Nfasc,Sv2c表达下调。Syt1属于突触蛋白突触蛋白家族,在突触传递和可塑性的几个阶段起着关键作用。SYT1可以在参与突触的常规功能之前调节轴突丝状伪足和分支的形成[10]。突触囊泡2C(SV2C)属于突触囊泡2(SV2)蛋白超家族的一种新的异构体,是已知的肉毒杆菌神经毒素/A(BoNT/A)的受体,调节多巴胺释放,从而成为治疗精神疾病的潜在目标分子[11]。这说明筛选的分子在调控突触可塑性以及神经递质的释放与转运方面发挥了重要的作用。我们推测在METH成瘾中,这些分子在DRN脑区的差异表达可能执行着重要的功能。
综上,METH激活了DRN脑区神经元。DRN在METH成瘾中起着重要作用,METH可通过改变DRN内一些与突触相关的蛋白分子的表达,进而调控成瘾行为的变化。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Sakurai K, Shintani T, Jomura N, et al. Hyper BOLD activation in dorsal raphe nucleus of APP/PS1 Alzheimer's disease mouse during reward-oriented drinking test under thirsty conditions[J]. Sci Rep, 2020, 10(1): 3915. DOI:10.1038/s41598-020-60894-7 |
| [2] |
Castro DC, Oswell CS, Zhang ET, et al. An endogenous opioid circuit determines state-dependent reward consumption[J]. Nature, 2021, 598(7882): 646-651. DOI:10.1038/s41586-021-04013-0 |
| [3] |
Li C, McCloskey N, Phillips J, et al. CRF-5-HT interactions in the dorsal raphe nucleus and motivation for stress-induced opioid reinstatement[J]. Psychopharmacology(Berl), 2021, 238(1): 29-40. DOI:10.1007/s00213-020-05652-3 |
| [4] |
Nestler EJ, Barrot M, Self DW. DeltaFosB: a sustained molecular switch for addiction[J]. Proc Natl Acad Sci USA, 2001, 98(20): 11042-11046. DOI:10.1073/pnas.191352698 |
| [5] |
Fu B, Yao JQ, Lu C, et al. Dorsal raphe nucleus serotoninergic neurons mediate morphine rewarding effect and conditioned place preference[J]. Neuroscience, 2022, 480: 108-116. DOI:10.1016/j.neuroscience.2021.10.031 |
| [6] |
Berger M, Gray JA, Roth BL. The expanded biology of serotonin[J]. Annu Rev Med, 2009, 60: 355-366. DOI:10.1146/annurev.med.60.042307.110802 |
| [7] |
Pollak Dorocic I, Furth D, Xuan Y, et al. A whole-brain atlas of inputs to serotonergic neurons of the dorsal and median raphe nuclei[J]. Neuron, 2014, 83(3): 663-678. DOI:10.1016/j.neuron.2014.07.002 |
| [8] |
Lesch KP, Waider J. Serotonin in the modulation of neural plasticity and networks: implications for neurodevelopmental disorders[J]. Neuron, 2012, 76(1): 175-191. DOI:10.1016/j.neuron.2012.09.013 |
| [9] |
Li Y, Zhong W, Wang D, et al. Serotonin neurons in the dorsal raphe nucleus encode reward signals[J]. Nat Commun, 2016, 7: 10503. DOI:10.1038/ncomms10503 |
| [10] |
Greif KF, Asabere N, Lutz GJ, et al. Synaptotagmin-1 promotes the formation of axonal filopodia and branches along the developing axons of forebrain neurons[J]. Dev Neurobiol, 2013, 73(1): 27-44. DOI:10.1002/dneu.22033 |
| [11] |
Hu YW, Xiao L, Zheng L, et al. Synaptic vesicle 2C and its synaptic-related function[J]. Clin Chim Acta, 2017, 472: 112-117. DOI:10.1016/j.cca.2017.07.029 |




 孙晋浩, 山东大学, 教授, 博士生导师。1994年毕业于济宁医学院临床医学专业, 获医学学士学位, 1997年于山东医科大学获医学硕士学位, 2002年于山东大学获医学博士学位。曾先后两次赴美国耶鲁大学医学院神经生物学系进行为期两年的学习深造。现任山东大学人体解剖与神经生物学系主任。主要从事神经发育与退行性脑病的研究, 在本领域发表中英文研究论文100余篇, 其中通信作者和第一作者SCI论文40余篇。主持国家自然科学基金6项, 其中重点项目1项, 面上项目5项; 主持省部级科研课题10余项。培养研究生30余名。主编人民卫生出版社国家规划教材八年制及“5+3”《系统解剖学》第4版; 副主编五年制临床医学《系统解剖学》第8版和第9版
孙晋浩, 山东大学, 教授, 博士生导师。1994年毕业于济宁医学院临床医学专业, 获医学学士学位, 1997年于山东医科大学获医学硕士学位, 2002年于山东大学获医学博士学位。曾先后两次赴美国耶鲁大学医学院神经生物学系进行为期两年的学习深造。现任山东大学人体解剖与神经生物学系主任。主要从事神经发育与退行性脑病的研究, 在本领域发表中英文研究论文100余篇, 其中通信作者和第一作者SCI论文40余篇。主持国家自然科学基金6项, 其中重点项目1项, 面上项目5项; 主持省部级科研课题10余项。培养研究生30余名。主编人民卫生出版社国家规划教材八年制及“5+3”《系统解剖学》第4版; 副主编五年制临床医学《系统解剖学》第8版和第9版