2. 济宁医学院康复医学院, 济宁 272000
2. College of Rehabilitation Medicine, Jining Medical University, Jining 272000, China
氧化应激参与帕金森病(Parkinson’s disease,PD)及阿尔茨海默病(Alzheimer’s disease,AD)等神经退行性疾病的发生发展[1]。目前关于氧化应激在PD等神经退行性疾病中的调节机制尚不完全明确。转录因子Nrf2能调控下游抗氧化酶的表达,从而参与机体代谢及抗氧化等过程中,促进个体不断适应变化的环境[2-3];Nrf2还参与AD及PD等多种神经退行性疾病的病理过程中[2]。
食欲素是一种神经肽,主要是由外侧下丘脑神经元分泌,包括食欲素A (Orexin A,OA)和食欲素B(Orexin B,OB)[4]。食欲素系统功能异常参与多种神经退行性疾病如AD及PD的发病过程中[5-7]。
本研究以H2O2诱导的HT-22细胞为体外氧化应激模型探讨食欲素在氧化应激过程中的作用,阐明食欲素在氧化应激中的作用机制。
1 材料与方法 1.1 材料 1.1.1 细胞HT-22细胞系购自上海通派生物公司。培养至含有FBS(10%)的DMEM培养基中,在细胞恒温培养箱(5% CO2,37℃)中培养,待细胞长满,传代于六孔板中,用于后续实验。
1.1.2 药品和试剂OA及OB购自Phoenix Pharmaceuticals公司;DMEM购自HyClone公司;Nrf2抗体购自abclonal公司;β-actin抗体、羊抗鼠IgG及羊抗兔IgG购自ZSGB-BIO。
1.2 方法 1.2.1 氧化应激细胞模型建立HT-22细胞种于六孔板中,加入H2O2处理建立体外氧化应激模型。将细胞随机分为6组:对照组、H2O2组、OA组、OB组、H2O2+OA组及H2O2+OB组。待细胞长至40%~50%时,H2O2组给予H2O2(500μM·L-1)处理,OA组给予OA(10-7M·L-1)处理,OB组给予OB(10-7M·L-1)处理,H2O2+OA组及H2O2+OB组中给予H2O2(500μmol·L-1)+OA/OB(10-7M·L-1)处理,待处理24h后利用显微镜观察各组细胞状态及数量,并分别拍照,用于后续计数。
1.2.2 qPCR检测各组Nrf2的表达总RNA提取:待细胞处理完毕,吸除培养基并用PBS缓冲液清洗两遍后,加入一定量的裂解液RZ(TIANGEN公司),待细胞充分裂解后,收集裂解液至EP管中(RNase-free)。按照总RNA提取试剂盒(TIANGEN公司)的说明书进行提取,将提取的RNA溶于适量的RNase-Free双蒸水中,待RNA充分溶解后,检测RNA的浓度。
反转录:根据说明书(TIANGEN公司),取适量提取的总RNA(20μl的反应体系里加入50ng~2μg的RNA)置于EP管(RNase-free),按稀释比例加入5×gDNA Buffer,加RNase-free的水补齐至20μl,充分混合均匀后置于42℃水浴锅中反应3min,结束后取出EP管置于冰上,按照相应的稀释比例加入10×King RT Buffer、FastKing RT Enzyme Mix及FQ-RT Primer Mix,加RNase-free的水补齐总体系10μl,充分混匀后加入到前面的gDNA步骤的反应体系中,混合均匀后置于42℃水浴锅中孵育15min,之后95℃孵育3min。反应结束后通过qPCR仪检测目的基因Nrf2的变化水平。Nrf2 qPCR引物如下:forward: 5’-CGTCCCTAGGTCCTTGTTCC-3’; reverse: 5’-TCAAATCCATGTCCTGCTGGG-3’。
1.2.3 蛋白印迹检测各组Nrf2蛋白的表达总蛋白提取: 待细胞处理结束,将细胞内的培养基吸除干净,用PBS缓冲液清洗2遍后,然后将PBS吸干净,加入适量含有蛋白酶抑制剂的细胞裂解液RIPA裂解20~30min(将样品置于冰上进行操作),待细胞充分裂解后,将裂解后的细胞转移到1.5ml EP管中。于12000g,4℃离心15min。将上清转移至新的EP管中,按比例加入适量蛋白上样缓冲液,放于100℃金属浴中加热10min,用于后续实验。
蛋白印迹:将提取的细胞蛋白样品,利用聚丙烯酰胺凝胶电泳方法将蛋白进行分离,之后通过转膜的方法将蛋白转移到PVDF膜上,加入1×TBST洗膜5min,然后加入5%的脱脂奶粉进行封闭1~2h,之后吸掉封闭液,加入稀释好的一抗,放于4℃摇床上,过夜孵育。第二天将一抗回收,加入1×TBST洗膜3次,每次10~15min,倒掉TBST,加入稀释好的二抗,然后放于室温孵育1h,之后回收二抗,加入1×TBST洗膜3次,每次10~15min,洗膜完毕后,之后将底物加入到PVDF膜上进行显色,用proteinsimple仪器采集数据,并使用ImageJ软件进行灰度分析。
1.3 统计学方法数据均利用GraphPad 6.0软件进行统计。正态分布的计量资料采用x±s描述,多组间比较采用方差分析,组间多重比较采用Bqnferroni法校正。P < 0.05为差异具有统计学意义。
2 结果 2.1 HT-22细胞氧化应激模型的建立本研究利用H2O2诱导的HT-22细胞为模型,结果显示,与对照组相比,在处理24h的情况下,不同浓度的H2O2引起HT-22细胞数量不同程度地降低(图 1)。其中500μM·L-1的H2O2处理24h能引起HT-22细胞数量降低50%左右。因此本研究后续均采用500μM·L-1H2O2处理的HT-22细胞作为细胞模型。
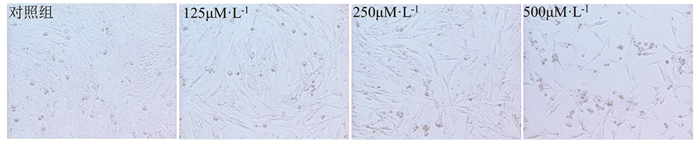
|
图 1 不同浓度的H2O2引起的HT-22细胞的变化 |
与对照组相比,H2O2组HT-22细胞数量降低约50%,而与H2O2组相比,OA和OB显著增加HT-22细胞数量(约30%),差异具有统计学意义(P < 0.05)。因此,OA和OB显著降低H2O2引起的HT-22细胞死亡,说明OA和OB能显著降低H2O2对HT-22的神经损伤,进而发挥神经保护作用(图 2)。

|
图 2 食欲素显著降低H2O2引起的HT-22细胞死亡 注:***P < 0.001 vs.对照组;#P < 0.05 vs.H2O2组;##P < 0.01 vs.H2O2组 |
qPCR结果显示,与对照组相比,H2O2组Nrf2基因表△△CT达约为-2.064,说明相对于对照组,H2O2显著升高HT-22细胞中Nrf2的基因表达水平。
2.4 食欲素对HT-22细胞中Nrf2蛋白表达水平的影响相对于对照组,OA及OB对HT-22细胞中Nrf2的表达无显著影响,而OA和OB组HT-22细胞中Nrf2的蛋白表达水平约为H2O2组的2倍。说明相对于H2O2组,OA和OB显著升高HT-22细胞内Nrf2的蛋白表达水平(图 3),提示OA和OB很可能通过增强HT-22细胞中Nrf2的表达水平,进而发挥神经保护作用。

|
图 3 食欲素引起的HT-22细胞的Nrf2蛋白表达水平的变化 注:NS (P>0.05) vs.对照组;*P < 0.05 vs.H2O2组 |
氧自由基的聚集会造成细胞内蛋白质及DNA等的损伤,进而引起组织及器官的功能异常,从而导致机体疾病的产生和发展[8-9]。氧化应激参与多种神经系统的发生过程中[1]。已有研究显示,食欲素参与到多种氧化应激相关神经退行性疾病的病理过程中[1],然而其在氧化应激中的具体作用机制尚不明确。本研究利用体外H2O2诱导的HT-22细胞的氧化应激模型发现,H2O2显著降低HT-22细胞的数量,OA及OB能显著降低H2O2诱导的HT-22细胞的死亡,进而在细胞氧化应激模型中发挥神经保护作用。
H2O2可引起细胞成分破坏,引起氧化应激,导致细胞死亡[10]。H2O2是用来建立氧化应激模型的常用药物,有研究者发现600μM·L-1的H2O2处理24h能引起HT-22细胞数量降低50%左右[10]。这在一定程度上和本研究的实验结果是一致的。Nrf2属于碱性亮氨酸拉链(bZIP)转录因子家族成员[2],参与氧化应激过程中,并在HT-22细胞的氧化应激模型中发挥一定的作用[11-12]。本研究中,与对照组相比,H2O2处理会引起HT-22细胞数量的显著下降,说明H2O2对HT-22细胞有一定的神经毒性;与H2O2组相比,OA及OB处理均能显著增加HT-22细胞的数量,说明OA及OB能够减轻H2O2的神经毒性作用;与对照组相比,H2O2显著增加HT-22细胞中Nrf2的基因表达水平,提示Nrf2在H2O2诱导的氧化应激中的潜在作用;与H2O2组相比,OA和OB显著增加HT-22细胞内的Nrf2蛋白的表达水平。一方面提示OA及OB对Nrf2表达水平的调控作用,另一方面本研究也提示食欲素系统与Nrf2信号通路的相关性。
前期研究显示,OA能显著降低氧化应激引起的SH-SY5Y细胞损伤[13],这也进一步支持本研究的结论。本研究提示,Nrf2很有可能参与到食欲素介导的神经保护作用。正常生理条件下,Keap1会与Nrf2结合引起Nrf2进入降解途径,当外界条件改变如某些氧化应激相关刺激等存在时,会引起Nrf2从复合物中分离出来,进而入核,Nrf2入核之后会引起一些抗氧化酶等的产生,从而发挥抗氧化过程[2]。本文结果显示,H2O2显著增加HT-22细胞中的核因子Nrf2的基因表达水平,但是H2O2对HT-22细胞内Nrf2蛋白表达的影响需要进一步探究;而食欲素显著增强HT-22细胞内Nrf2蛋白的表达,因此我们推测食欲素很有可能是通过增强HT-22细胞内Nrf2的表达及入核,进而引起抗氧化应激相关因子的产生,从而降低H2O2引起的HT-22细胞的死亡[2]。而Nrf2在其中的具体作用机制需要进一步采用动物实验和细胞实验去阐释。
综上,本课题研究结果显示食欲素能增强H2O2引起的HT-22细胞的Nrf2的表达水平,并降低H2O2引起的HT-22细胞的神经损伤,发挥神经保护作用。而关于食欲素对Nrf2的具体调控机制还需要进一步探究。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Konovalova J, Gerasymchuk D, Parkkinen I, et al. Interplay between microRNAs and oxidative stress in neurodegenerative diseases[J]. Int J Mol Sci, 2019, 20(23): 6055. DOI:10.3390/ijms20236055 |
| [2] |
Fao L, Mota SI, Rego AC. Shaping the Nrf2-ARE-related pathways in Alzheimer's and Parkinson's diseases[J]. Ageing Res Rev, 2019, 54: 100942. DOI:10.1016/j.arr.2019.100942 |
| [3] |
Wang X, Chen XX, Zhou WQ, et al. Ferroptosis is essential for diabetic cardiomyopathy and is prevented by sulforaphane via AMPK/NRF2 pathways[J]. Acta Pharm Sin B, 2022, 12(2): 708-722. DOI:10.1016/j.apsb.2021.10.005 |
| [4] |
Han Y, Yuan K, Zheng YB, et al. Orexin receptor antagonists as emerging treatments for psychiatric disorders[J]. Neurosci Bull, 2020, 36(4): 432-448. DOI:10.1007/s12264-019-00447-9 |
| [5] |
Liguori C, Spanetta M, Izzi F, et al. Sleep-wake cycle in alzheimer's disease is associated with tau pathology and orexin dysregulation[J]. J Alzheimers Dis, 2020, 74(2): 501-508. DOI:10.3233/JAD-191124 |
| [6] |
Shimizu S, Takenoshita N, Inagawa Y, et al. Positive association between cognitive function and cerebrospinal fluid orexin a levels in Alzheimer's disease[J]. J Alzheimers Dis, 2020, 73(1): 117-123. DOI:10.3233/JAD-190958 |
| [7] |
Huang S, Zhao ZX, Ma JJ, et al. Increased plasma orexin-A concentrations are associated with the non-motor symptoms in Parkinson's disease patients[J]. Neurosci Lett, 2021, 741: 135480. DOI:10.1016/j.neulet.2020.135480 |
| [8] |
Filomeni G, De Zio D, Cecconi F. Oxidative stress and autophagy: the clash between damage and metabolic needs[J]. Cell Death Differ, 2015, 22(3): 377-388. DOI:10.1038/cdd.2014.150 |
| [9] |
Sies H. Oxidative stress: a concept in redox biology and medicine[J]. Redox Biol, 2015, 4: 180-183. DOI:10.1016/j.redox.2015.01.002 |
| [10] |
Wu XQ, Luo P, Rao W, et al. Homer1a attenuates hydrogen peroxide-induced oxidative damage in HT-22 cells through AMPK-dependent autophagy[J]. Front Neurosci, 2018, 12: 51. DOI:10.3389/fnins.2018.00051 |
| [11] |
Jiang T, Cheng H, Su JJ, et al. Gastrodin protects against glutamate-induced ferroptosis in HT-22 cells through Nrf2/HO-1 signaling pathway[J]. Toxicol In Vitro, 2020, 62: 104715. DOI:10.1016/j.tiv.2019.104715 |
| [12] |
Xu BT, Qin YY, Li D, et al. Inhibition of PDE4 protects neurons against oxygen-glucose deprivation-induced endoplasmic reticulum stress through activation of the Nrf-2/HO-1 pathway[J]. Redox Biol, 2020, 28: 101342. DOI:10.1016/j.redox.2019.101342 |
| [13] |
Wang CM, Yang CQ, Cheng BH, et al. Orexin-A protects SH-SY5Y cells against H2O2-induced oxidative damage via the PI3K/MEK1/2/ERK1/2 signaling pathway[J]. Int J Immunopathol Pharmacol, 2018, 32. DOI:10.1177/2058738418785739 |



