肝脏是人体重要的免疫器官,含有多种天然免疫细胞及适应性免疫细胞。免疫介导的肝损伤因其免疫细胞失衡、炎性因子的过表达可导致肝细胞或肝组织受损,进而引发急性肝衰竭、慢性肝炎、肝纤维化的发生[1-2]。髓源性抑制细胞(myeloid-derived suppressor cells,MDSCs)是由骨髓祖细胞和不成熟的髓系细胞组成的异质性细胞群,可通过表达和分泌免疫抑制相关因子发挥强有力的免疫抑制作用,如诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)、精氨酸酶-1(arginase 1,Arg-1)等[3-4],MDSCs在肝脏中的积累可减轻肝损伤[5-6]。白细胞介素16(interleukin-16,IL-16)作为多种细胞分泌的炎性因子,广泛参与机体的炎症反应,并与哮喘、肠炎、系统性硬化症、心脏损伤等疾病密切相关[7-10],而IL-16是否参与肝损伤未见报道。Con A作为T细胞分裂原,能够引发免疫兴奋和炎症刺激,其引起的病理改变与肝细胞损伤的病理生理过程类似,故Con A诱导的小鼠肝损伤是较为理想的免疫肝损伤动物模型[11-12]。本课题借助于IL-16基因敲除(IL-16-/-)小鼠,构建Con A诱导的肝损伤模型,观察IL-16对肝损伤及MDSCs的影响,进一步探讨IL-16是否通过调控MDSCs的募集而影响肝损伤。
1 材料与方法 1.1 材料 1.1.1 动物7~8周龄,体质量18~22g,SPF级雄性C57BL/6小鼠,购自济南朋悦实验动物繁育有限公司,利用CRISPER/Cas9基因编辑技术获得IL-16-/-小鼠,所有小鼠均在SPF级动物房繁殖饲养,符合济宁医学院实验动物伦理委员会要求。
1.1.2 试剂及仪器刀豆球蛋白A(Con A,批号:C2010)购自美国Sigma公司;IL-16、IL-6、IL-12、TNF-α及内参GAPDH的引物均委托上海生工生物工程技术服务有限公司合成;小鼠IL-16 ELISA试剂盒购自武汉华美生物工程有限公司;IL-6、IL-12、TNF-α ELISA试剂盒及流式细胞术相关抗体均购自美国BioLegend公司;末端脱氧核苷酸转移酶介导的dUTP缺口末端标记法[terminal dexynucleotidyl transferase(Td T)-mediated d UTP nick end labeling,TUNEL]凋亡检测试剂盒购自Roche公司;定量逆转录聚合酶链反应(qPCR)试剂由南京诺唯赞生物科技股份有限公司提供,包括AceQ qPCR SYBR Green Master Mix(货号:Q111)和HiScript Ⅲ RT Super Mix for qPCR(货号:R323);兔抗IL-16多克隆抗体购自Abcam公司;粒细胞-巨噬细胞集落刺激因子(granulocyte-macrophage colonystimulating factor,GM-CSF)、IL-6购自Pepro Tech公司;免疫组织化学染色试剂盒购自北京博奥森生物技术有限公司。Light cycler 480 PCR仪购自Roche公司;酶联免疫检测仪购自Bio-Tek公司;流式细胞仪购自BD公司。
1.2 方法 1.2.1 Con A诱导的肝损伤模型的建立及实验分组根据实验设计将C57BL/6小鼠(WT)及IL-16敲除(IL-16-/-)小鼠分别随机分为对照组(control组, n=5)和模型组(Con A组,n=7),Con A组尾静脉注射Con A(20mg/kg),建立肝损伤模型,control组尾静脉注射相同体积的磷酸缓冲盐溶液(Phosphate Buffered Saline,PBS), 6h后取小鼠血清待测IL-6、IL-12、TNF-α的表达,12h后取血清待测IL-16、ALT、AST,取脾脏、肝脏备用。另外给予小鼠致死剂量的Con A(25mg/kg)尾静脉注射,观察小鼠生存率。
1.2.2 免疫组织化学技术检测肝组织中IL-16蛋白的表达各组小鼠肝组织石蜡切片脱蜡水化,柠檬酸缓冲液微波抗原修复后PBS洗3次,每次5 min;H2O2作用30min阻断过氧化物酶;PBS洗3次,每次5min,血清封闭室温孵育20min;弃去血清滴加IL-16多克隆抗体,37℃过夜;PBS洗3次,每次5min;滴加生物素标记的二抗,室温孵育30min;辣根过氧化物酶标记的链霉亲和素室温孵育20min,PBS洗3次,每次5min;DAB显色、苏木素衬染,脱水、透明后,中性树胶封片,镜下观察。
1.2.3 小鼠血清转氨酶检测及组织病理学分析小鼠尾静脉注射Con A,12h后摘眼球取血,4000r/min,离心10min后取血清,罗氏cobas8000全自动生化分析仪检测血清中谷丙转氨酶(alanine transaminase,ALT)和谷草转氨酶(aspartate aminotransferase,AST)水平。同时将部分肝组织于4%多聚甲醛中固定,行常规HE染色,显微镜下观察肝组织病理变化。
1.2.4 TUNEL试剂盒检测肝组织中凋亡细胞肝组织石蜡切片常规脱蜡、水化;PBS洗涤后滴加蛋白酶K,37℃孵育30min;PBS洗涤后滴加TUNEL反应液,37℃孵育30min;PBS洗涤后滴加防荧光淬灭剂封片,荧光显微镜下观察。
1.2.5 小鼠体外MDSCs的诱导分别分离WT小鼠和IL-16-/-小鼠的股骨及胫骨,剔除肌肉后,用无菌PBS冲洗骨髓腔获取骨髓细胞。在含100mL/L FBS、40ng/mL GM-CSF、40ng/mL IL-6的DMEM培养基中培养,4d后收取细胞待测。
1.2.6 小鼠肝脏、脾脏单个核细胞的制备小鼠麻醉后暴露心脏和肝脏,在右心耳充分收集血液,于心尖处注入20ml PBS冲洗肝脏至灰白色。取肝脏至200目铜网上研磨至单细胞悬液,3000r/min,离心10min;弃上清后用约45ml的PBS将细胞重悬,400r/min,离心5min;吸取上清至一新的50ml离心管中,2500r/min,离心8min;弃去上清,用3ml 40% percoll重悬细胞,将重悬后的细胞缓慢叠加至2ml 70% 的percoll的上层。差速离心,2500r/min,离心30min。吸取中间灰白层至15ml离心管中,PBS洗涤2次后,弃去上清,用PBS调整细胞浓度后流式细胞术待测。
取小鼠脾脏充分研磨后获取单细胞悬液,转移至15ml离心管中,1500r/min,离心5min;弃上清后悬浮细胞,加入1ml红细胞裂解液,混匀后室温静置5min;适量PBS终止裂解后离心,弃上清后重悬细胞,PBS调整细胞浓度后流式细胞术待测。
1.2.7 实时荧光定量PCR(Quantitative Real-time PCR)采用RANiso Plus试剂提取肝组织及体外诱导MDSCs的总RNA,HiScript Ⅲ RT Super Mix for qPCR试剂盒扩增cDNA。使用Light Cycler 480系统进行实时PCR反应。PCR引物序列见表 1。
| 表 1 引物序列 |
取各组小鼠血液,4000r/min,离心10min后取上层血清,采用ELISA试剂盒检测血清中IL-16、IL-6、IL-12、TNF-α的水平,实验操作严格按说明书进行。
1.2.9 流式细胞术检测小鼠脾脏、肝脏及体外诱导MDSCs的比例将制备的小鼠脾细胞、肝细胞及体外诱导的MDSCs转移至流式管中,每管加入相应荧光标记的流式抗体,混匀后室温避光30min;PBS洗涤,弃上清,200μl PBS悬浮细胞,过滤后行流式细胞术检测。
1.3 统计学方法实验所有数据采用GraphPad Prism 7软件进行统计学分析,正态分布的计量资料采用x±s描述,多组间比较采用方差分析,组间多重比较采用非配对t检验,P < 0.05为差异有统计学意义。
2 结果 2.1 IL-16在Con A诱导的肝损伤模型中表达增加WT-Con A组小鼠血清IL-16蛋白水平(160.5±18.93)pg/ml较WT-control组(0.39±0.08)pg/ml明显增加(t=7.457,P < 0.001,图 1A);WT-con A组肝组织IL-16 mRNA水平(1.91±0.05)较WT-control组(0.89±0.07)升高,差异具有统计学意义(t=11.04,P < 0.001,图 1B)。IL-16在WT-Con A组小鼠肝组织中显著表达(图 1C)。以上结果均表明,IL-16在Con A诱导的肝损伤中表达增加,提示IL-16可能参与Con A诱导的肝损伤。

|
图 1
IL-16在Con A诱导的肝损伤模型中的表达
注:A.ELISA检测小鼠血清中IL-16的含量;B.qPCR检测小鼠肝组织中IL-16的mRNA水平;C.免疫组织化学检测肝组织中IL-16的表达 ***P < 0.001 vs.WT-control组 |
为进一步明确IL-16在Con A诱导的肝损伤中发挥的作用,利用IL-16-/-小鼠建立Con A诱导的肝损伤模型,观察小鼠生存率及肝损伤程度。结果显示,IL-16-/-组小鼠的生存率明显高于WT组小鼠(P < 0.05,图 2A)。IL-16-/--Con A组小鼠血清ALT(2331±460.6)U/L、AST(2753±589.8)U/L,含量较WT-Con A组ALT(8122±1886)U/L、AST(6328±1222)U/L降低,差异具有统计学意义(t=3.26,P=0.0098;t=2.789,P=0.0211,图 2B)。另外,小鼠肝脏病理切片HE染色结果显示,WT-control组及IL-16-/--control组肝小叶结构完整,肝索整齐,肝窦清晰,肝细胞形态正常,细胞核大小均一,胞浆均匀红染;WT-Con A组表现为肝细胞坏死呈片状分布,肝索消失,肝窦内大量红细胞淤积,可见不同程度的淋巴细胞、中性粒细胞浸润;而IL-16-/--Con A组肝小叶及肝索结构可见,肝窦内有不同程度的红细胞淤积,淋巴细胞及中性粒细胞稍有浸润。TUNEL检测结果显示,IL-16-/--Con A组肝组织凋亡细胞显著少于WT-Con A组。以上结果均表明IL-16可加重Con A引起的肝损伤。
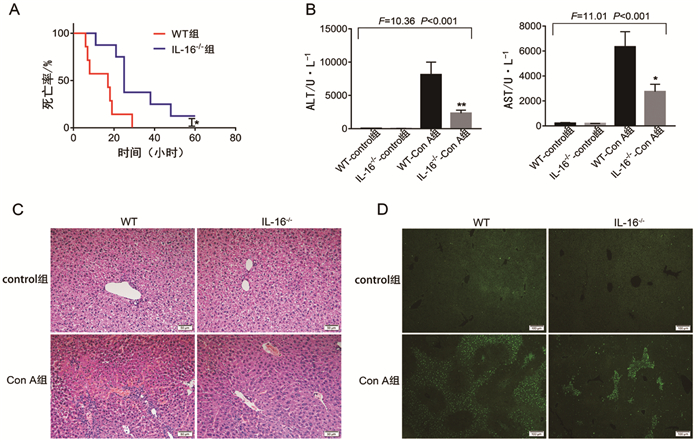
|
图 2
IL-16加重Con A诱导的肝损伤
注:A.小鼠生存率;B.小鼠血清中ALT和AST水平;C.小鼠肝脏组织形态(HE染色);D.TUNEL染色检测小鼠肝组织的细胞凋亡 *P < 0.05、**P < 0.01 vs.WT-Con A组 |
IL-16-/--Con A组血清IL-6(52.35±11.28)ng/ml、IL-12(2.58±0.14)ng/ml、TNF-α(56.51±0.14)pg/ml蛋白水平较WT-Con A组血清IL-6(155±18.16)ng/ml、IL-12(3.37±0.20)ng/ml、TNF-α(195.2±38.19)pg/ml下降,差异具有显著性(t=4.803,P < 0.001;t=2.888,P=0.0202;t=3.986,P=0.0032,图 3A)。IL-16-/--Con A组肝组织IL-6 (0.72±0.03)、IL-12(4.14±1.29)、TNF-α(1.14±0.09)mRNA水平低于WT-Con A组IL-6(1.77±0.35)、IL-12(14.45±2.83)、TNF-α(1.68±0.15), 差异具有统计学意义(t=3.995,P=0.0072;t=3.525,P=0.0065;t=3.875,P=0.0061,图 3B)。WT-control组及IL-16-/--control组小鼠体内炎症因子无明显变化。以上结果表明,IL-16可加重Con A引起的肝损伤炎症反应。
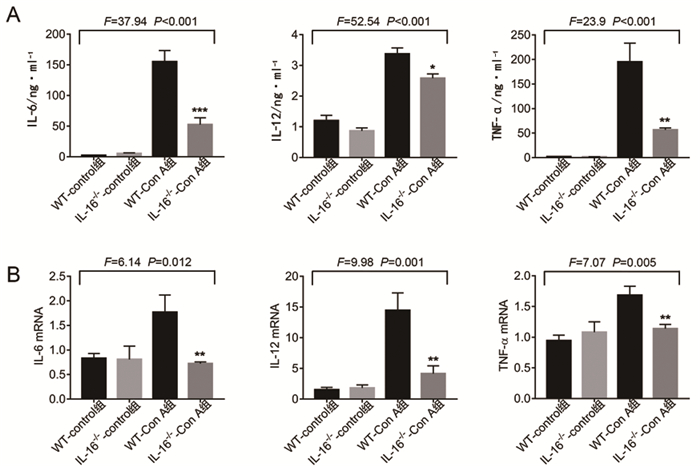
|
图 3
IL-16增加肝损伤小鼠炎症因子的表达
注:A.ELISA检测血清中IL-6、IL-12和TNF-α的水平;B.qPCR检测肝组织中IL-6、IL-12和TNF-α mRNA水平 *P < 0.05、**P < 0.01,*** P < 0.001 vs.WT-Con A组 |
如图 4所示,WT-Con A组小鼠肝脏中MDSCs的比例(5.66±0.54)%较WT-control组(1.58±0.16)%增高, 差异具有统计学意义(t=5.106,P=0.0014);而IL-16-/--Con A组小鼠脾脏及肝脏中MDSCs比例(1.48±0.77)%、(9.84±1.06)%明显高于WT-Con A组(0.59±0.14)%、(5.66±0.54)%(t=5.705,P=0.0002;t=3.516,P=0.0056)。另外,我们在体外诱导了MDSCs,IL-16-/-小鼠来源诱导的MDSCs比例(76.14±0.31)%明显高于WT小鼠来源的MDSCs(70.78±1.32)%(t=3.968,P=0.0041, 图 5A);qPCR分析与MDSCs生成及发挥抑制作用的相关分子iNOS、Arg-1发现,与WT来源的MDSCs(1.61±0.32)、(0.94±0.20)相比,IL-16-/-小鼠来源MDSCs中iNOS mRNA表达水平(2.68±0.32)显著升高(t=2.394,P=0.0436),而Arg-1的mRNA表达水平(0.71±0.26)无明显变化(t=0.7293,P=0.4933, 图 5B)。
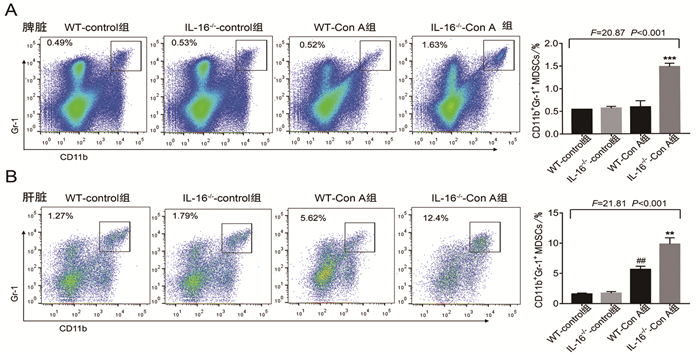
|
图 4
IL-16下调肝损伤小鼠MDSCs在脾脏和肝脏中的募集
注:A.流式细胞术检测脾脏中MDSCs的比例;B.流式细胞术检测肝脏中MDSCs的比例 **P < 0.01,***P < 0.001 vs.WT-Con A组;##P < 0.01 vs.WT-control组 |
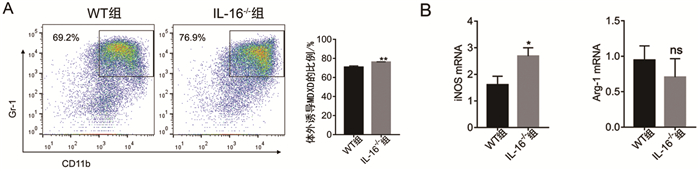
|
图 5
IL-16调节体外诱导的MDSCs的比例
注:A.流式细胞术检测体外诱导的MDSCs的比例;B.qPCR检测iNOS和Arg-1的mRNA水平 *P < 0.05、**P < 0.01、nsP>0.05 vs.WT组 |
免疫性肝损伤是指由于免疫刺激和炎症反应引起的肝细胞损伤或病变,其发病与多种因素有关,且机制复杂。细胞因子在肝损伤发生发展中发挥着至关重要的作用。IL-16是由多种细胞(包括激活的T细胞、巨噬细胞等免疫细胞和肥大细胞、上皮细胞等非免疫细胞)分泌的一种重要的前炎症因子,参与肠炎、哮喘等多种疾病的病理过程[7]。目前, IL-16是否参与肝损伤的发生发展尚未可知。
本研究发现Con A诱导小鼠肝损伤后,IL-16在小鼠血清及肝组织中高表达,说明IL-16参与了Con A诱导的肝损伤的发生发展。前期研究表明,下调IL-16的表达有助于某些疾病病情的缓解。例如,中和IL-16可减轻阿霉素诱导的心脏损伤,改善心功能[8];抗IL-16单克隆抗体可减轻三硝基苯磺酸诱导的小鼠结肠损伤和炎症反应[13];IL-16基因敲除后可减轻鸡卵白蛋白诱导的小鼠哮喘炎症[9]。而下调或敲除IL-16基因的表达是否有助于缓解Con A诱导的肝损伤?
我们借助IL-16-/-小鼠进行了进一步研究。结果表明,小鼠IL-16基因的缺失可明显提高Con A致死剂量诱导的肝损伤小鼠生存率。肝损伤后肝细胞破坏,肝细胞内ALT和AST迅速释放入血,可引起血清中水平增高,故血清中ALT及AST的活性水平是反映肝损伤程度、评价肝功能的重要指标。在本实验中,IL-16基因的敲除可显著降低肝损伤小鼠血清中ALT和AST水平,改善肝组织病理性损伤,减少肝细胞凋亡,说明IL-16的缺失在一定程度上可减轻Con A诱导的肝损伤。另外,肝损伤发生过程中中性粒细胞、巨噬细胞、T淋巴细胞等炎症细胞在肝脏中浸润,产生大量细胞因子加重肝脏损伤。本研究IL-16基因的缺失可显著降低Con A引起的血清中炎症因子IL-6、IL-12和TNF-α的蛋白水平及肝组织中IL-6、IL-12和TNF-α mRNA水平。以上结果均表明,IL-16的缺失有助于缓解Con A诱导的肝损伤病情,也就是说,IL-16可加重Con A诱导的小鼠肝损伤。
为进一步探讨IL-16加重Con A诱导肝损伤的机制,我们对WT小鼠及IL-16-/-小鼠肝损伤后肝脏内浸润的免疫细胞进行了分析。结果发现,对于WT小鼠,Con A组肝脏中Gr-1+CD11b+双阳性细胞即MDSCs比例明显高于control组。这与其他报道结果相似[5-6, 14]。当IL-16基因缺失后,Con A并不影响小鼠肝脏内浸润的细胞类型,但肝脏内MDSCs的比例明显升高。在体外诱导MDSCs实验中,IL-16缺失后诱导的MDSCs比例及其相关抑制因子iNOS的表达均有不同程度的增加。在炎症发生时,机体为抑制免疫细胞激活,可诱导MDSCs募集至炎症局部发挥免疫抑制作用,从而减轻炎症反应[15]。实验结果说明IL-16在一定程度上是通过下调MDSCs在肝脏中的募集而加重肝损伤。而MDSCs的募集是一个复杂而渐进的过程,由多种因素控制。一方面,未成熟骨髓细胞扩增为MDSCs可由基底膜基质或肿瘤产生的因子驱动,参与慢性感染和炎症[16-18];另一方面,MDSCs的激活可由炎性因子和损伤相关分子模式介导,包括IFN-γ、IL-1β、IL-4等,这些因素主要通过NF-κB、STAT1和STAT6信号途径而实现[19-20]。而IL-16作为炎性因子,通过何种途径对MDSCs的驱动或激活发挥了负调节作用有待进一步研究。
综上所述,IL-16参与Con A诱导的肝损伤的发生发展,并且通过下调MDSCs在肝组织中的募集而加重肝损伤。本课题不仅为研究IL-16与MDSCs的相互作用提供了新思路,也为研究肝损伤发展的分子机制提出了新见解,因此,IL-16可能成为治疗肝损伤的一个新的研究靶点。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Yan F, Cheng D, Wang H, et al. Corilagin ameliorates Con A-induced hepatic injury by restricting M1 macrophage polarization[J]. Fronti Immunol, 2021, 12: 807509. DOI:10.3389/fimmu.2021.807509 |
| [2] |
Hao J, Sun W, Xu H. Pathogenesis of concanavalin A induced autoimmune hepatitis in mice[J]. Int Immunopharmacol, 2022, 102: 108411. DOI:10.1016/j.intimp.2021.108411 |
| [3] |
Hegde S, Leader AM, Merad M. MDSC: Markers, development, states, and unaddressed complexity[J]. Immunity, 2021, 54(5): 875-884. DOI:10.1016/j.immuni.2021.04.004 |
| [4] |
Bruger AM, Dorhoi A, Esendagli G, et al. How to measure the immunosuppressive activity of MDSC: assays, problems and potential solutions[J]. Cancer Immunol Immunother, 2019, 68(4): 631-644. DOI:10.1007/s00262-018-2170-8 |
| [5] |
Sarra M, Cupi ML, Bernardini R, et al. IL-25 prevents and cures fulminant hepatitis in mice through a myeloid-derived suppressor cell-dependent mechanism[J]. Hepatology, 2013, 58(4): 1436-1450. DOI:10.1002/hep.26446 |
| [6] |
Wang H, Li X, Dong G, et al. Toll-like receptor 4 inhibitor TAK-242 improves fulminant hepatitis by regulating accumulation of myeloid-derived suppressor Cell[J]. Inflammation, 2021, 44(2): 671-681. DOI:10.1007/s10753-020-01366-y |
| [7] |
Kawabata K, Makino T, Makino K, et al. expression is increased in the skin and sera of patients with systemic sclerosis[J]. Rheumatology (Oxford), 2020, 59(3): 519-523. DOI:10.1093/rheumatology/kez318 |
| [8] |
Zhang J, Yang Z, Liang Z, et al. Anti-interleukin-16-neutralizing antibody attenuates cardiac inflammation and protects against cardiac injury in doxorubicin-treated mice[J]. Mediators Inflamm, 2021, 2021: 6611085. DOI:10.1155/2021/6611085 |
| [9] |
Li C, Dai J, Dong G, et al. Interleukin-16 aggravates ovalbumin-induced allergic inflammation by enhancing Th2 and Th17 cytokine production in a mouse model[J]. Immunology, 2019, 157(3): 257-267. DOI:10.1111/imm.13068 |
| [10] |
Mostafa S, Nasef SI, Hassan AM, et al. Interleukin 16 polymorphism and susceptibility of rheumatoid arthritis disease in Egyptian population[J]. Egypt J Immunol, 2021, 28(4): 282-289. |
| [11] |
Heymann F, Hamesch K, Weiskirchen R, et al. The concanavalin A model of acute hepatitis in mice[J]. Lab Anim, 2015, 49(1 Suppl): 12-20. DOI:10.1177/0023677215572841 |
| [12] |
Chen A, Wang Y, Wu J, et al. Identification and characterization of dynamically regulated hepatitis-related genes in a concanavalin A-induced liver injury model[J]. Aging (Albany NY), 2020, 12(22): 23187-23199. DOI:10.18632/aging.104089 |
| [13] |
Keates AC, Castagliuolo I, Cruickshank WW, et al. Interleukin 16 is up-regulated in Crohn's disease and participates in TNBS colitis in mice[J]. Gastroenterology, 2000, 119(4): 972-982. DOI:10.1053/gast.2000.18164 |
| [14] |
Suh YG, Kim JK, Byun JS, et al. CD11b (+) Gr1(+) bone marrow cells ameliorate liver fibrosis by producing interleukin-10 in mice[J]. Hepatology, 2012, 56(5): 1902-1912. DOI:10.1002/hep.25817 |
| [15] |
Veglia F, Perego M, Gabrilovich D. Myeloid-derived suppressor cells coming of age[J]. Nature Immunol, 2018, 19(2): 108-119. DOI:10.1038/s41590-017-0022-x |
| [16] |
Dolcetti L, Peranzoni E, Ugel S, et al. Hierarchy of immunosuppressive strength among myeloid-derived suppressor cell subsets is determined by GM-CSF[J]. Eur J Immunol, 2010, 40(1): 22-35. DOI:10.1002/eji.200939903 |
| [17] |
Umansky V, Sevko A. Tumor microenvironment and myeloid-derived suppressor cells[J]. Cancer Microenviron, 2013, 6(2): 169-177. DOI:10.1007/s12307-012-0126-7 |
| [18] |
Yan D, Yang Q, Shi M, et al. Polyunsaturated fatty acids promote the expansion of myeloid-derived suppressor cells by activating the JAK/STAT3 pathway[J]. Eur J Immunol, 2013, 43(11): 2943-2955. DOI:10.1002/eji.201343472 |
| [19] |
Condamine T, Mastio J, Gabrilovich DI. Transcriptional regulation of myeloid-derived suppressor cells[J]. J Leukoc Biol, 2015, 98(6): 913-922. DOI:10.1189/jlb.4RI0515-204R |
| [20] |
Ribechini E, Hutchinson JA, Hergovits S, et al. Novel GM-CSF signals via IFN-gammaR/IRF-1 and AKT/mTOR license monocytes for suppressor function[J]. Blood Adv, 2017, 1(14): 947-960. DOI:10.1182/bloodadvances.2017006858 |



