2. 济宁医学院精准医学研究院, 济宁 272067
2. Institute of Precision Medicine, Jining Medical University, Jining 272067, China
伴随老龄化社会的发展,退行性心脏瓣膜病(Degenerative heart valve disease, DHVD)已逐渐成为我国老年人心脏瓣膜病最常见类型[1-2],主要表现为钙化性主动脉瓣狭窄[3]。DHVD与动脉粥样硬化有类似发病危险因素包括高龄、高脂和高血压等,其病理特点是炎症浸润、脂质沉积、细胞外基质重塑、瓣膜间质细胞转分化及钙化等[4]。自噬是细胞利用溶酶体降解长寿命蛋白、老化及受损的细胞器和大分子物质的过程,主要场所为自噬-溶酶体,参与调节细胞动态平衡、细胞分化和生存、衰老等过程,在动脉粥样硬化、心力衰竭和血管老化等疾病中发挥重要作用[5-6]。我们前期研究显示冠心病患者自噬-溶酶体标记基因微管相关蛋白轻链3(LC3B)和溶酶体相关蛋白2(LAMP2)表达显著异常,提示自噬-溶酶体参与动脉粥样硬化的发生[7-8]。多项研究显示,在人的主动脉瓣膜样本中,自噬-溶酶体相关基因的表达具有差异,其功能失调严重影响瓣膜钙化程度[9-11]。在一些溶酶体贮积病患者中发现主动脉瓣膜增厚和狭窄,其发病机制可能为炎症反应、钙离子平衡改变和脂质沉积相互作用引起瓣膜退行性改变[12]。
目前,DHVD发病的分子机制尚未清楚,本文将探究自噬-溶酶体标记基因LC3B和LAMP2调控序列是否与DHVD发病相关,通过测序分析其调控序列变异与DHVD的关联性,揭示DHVD的分子机制,为DHVD的分子诊断和临床预防及治疗提供可靠的实验基础和理论依据。
1 对象和方法 1.1 对象选取2018-2020年就诊于济宁医学院附属医院并经临床明确诊断的247例DHVD患者作为DHVD组,男135例, 女112例, 年龄(63.02±11.04)岁;同期选取在济宁医学院附属医院健康体检中心体检的健康人群454例为对照组, 男235例, 女219例, 年龄(51.00±12.00)岁。DHVD患者依据以下标准进行临床诊断:1)主动脉瓣功能障碍的临床表现;2)超声心动图和CT检查有典型的主动脉瓣膜钙化;3)排除其他原因,如风湿性心脏病(病理特征为Aschoff小体)、感染性心内膜炎等。本研究已获得济宁医学院附属医院医学伦理学委员会批准,患者本人或者法定监护人知情同意。
1.2 方法 1.2.1 样本采集及DNA提取所有研究对象抽取空腹外周血3mL,采用密度梯度离心法提取外周血单核细胞。按DNeasy Blood and Tissue Kit(QIAGEN, USA) 说明书操作,提取单核细胞基因组DNA,-20℃保存。
1.2.2 PCR扩增参照GeneBank中LAMP2基因(NG_007995)和LC3B基因(NG_029030)转录起始点上游序列设计启动子引物,由上海生工生物公司合成。50 μL PCR反应体系:模板DNA 3μL,上游、下游引物(10μmol/ L)各1μL,PCR Mix 25μL,ddH2O 20μL。PCR反应条件:95℃预变性3min;95℃变性30s,退火40或60s,72 ℃延伸40s,共35个热循环;72℃延伸10min。PCR扩增产物-20℃暂时保存。引物序列见表 1。
| 表 1 启动子引物序列 |
所有样本扩增完毕送至上海生工生物公司测序,以GeneBank中的启动子序列为野生型参照,利用DNAMAN(Lynnon Biosoft,USA)软件比对测序结果进行基因分型。
1.3 统计方法采用SPSS 20.0软件进行统计分析,计数资料采用卡方检验,且理论频数1≤T < 5时用卡方检验校正公式,理论频数T < 1时改用Fisher确切概率法进行统计分析;运用logistic回归分析SNPs与DHVD的关联性,以优势比(odds ratio,OR)和95%置信区间(confidence interval,CI)表示,同时对SNPs进行Hardy-Weinberg平衡检验;利用在线TRANSFAC2.0数据库预测转录因子潜在的结合位点。P < 0.05为差异具有统计学意义。
2 结果 2.1 LC3B与LAMP2基因启动子序列变异情况筛选测序不合格的结果后,LAMP2基因测序成功的DHVD组201例(男性108例,女性93例)和对照组397例(男性201例,女性196例);LC3B基因DHVD组212例,对照组390例。两组共发现29个序列变异位点,经测序验证确定,LC3B启动子有6个序列变异位点(g.4085G>A,g.4266G>A,g.4286C>T,g4339G>A,g.4853A>G,g.4903G>T)仅发现于DHVD组,LAMP2启动子有1个序列变异位点(g.4167A>G)仅存在于DHVD女性患者;在对照组中观察到11个序列变异包含4个SNP,DHVD组未有这些变异;两组中都存在的序列变异共有11个包含5个SNP,其中rs42900中AA,CC基因型在DHVD男性患者与对照组的差异有统计学意义(χ2=5.44,P < 0.02)。见图 1,表 2和表 3。
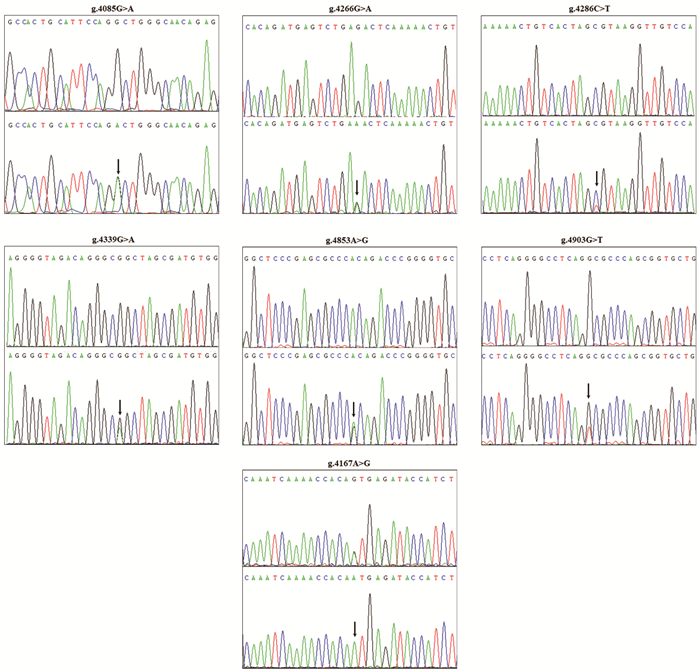
|
图 1 序列变异的测序色谱图 |
| 表 2 DHVD组和对照组LC3B基因序列变异基因型分析(n) |
| 表 3 DHVD组和对照组LAMP2基因序列变异基因型分析(n) |
选取两组都存在的SNPs位点(rs11117269、rs532744297、rs35227715、rs16944733、rs42900、rs28603270)进行HardyWeinberg平衡检验,均符合HardyWeinberg平衡,提示样本来自遗传平衡的群体。
随之对SNPs位点进行logistic回归分析,结果发现rs35227715中等位基因G的致病效应是C的1.36倍(95%CI:1.02~1.81,P=0.04);DHVD男性患者中rs42900基因型CC的致病效应是AA的0.56倍(95%CI:0.34~0.91,P=0.02),其等位基因C的致病效应同样是A的0.56倍(95%CI:0.40~0.79,P < 0.01)。其余SNPs的基因型及等位基因均无相关性(P>0.05)。见表 4和表 5。
| 表 4 LC3B基因SNP与DHVD的关联性分析(n/%) |
| 表 5 LAMP2基因SNP与DHVD的关联性分析(n/%) |
利用在线TRANSFAC2.0数据库(https://portal.genexplain.com/)分析发现于DHVD组的序列变异位点g.4085G>A,g.4266G>A,g.4286C>T,g4339G>A,g.4853A>G,g.4903G>T,g.4167A>G,结果显示序列变异可消除原有转录因子的结合位点或者创建新的转录因子结合位点,包括SMAD蛋白家族,CAAT区/增强子结合蛋白(C/EBP),激活增强子结合蛋白2(AP-2),通用起始子(General initiator,Inr),性别决定区Y框蛋白10(SOX10)(见表 6,图 2)。
| 表 6 预测变异序列影响结合的转录因子 |
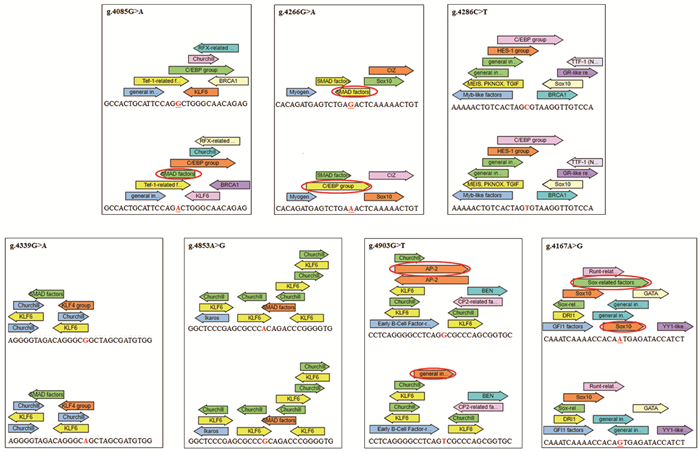
|
图 2 预测序列变异影响结合的转录因子 |
DHVD的分子细胞机制本质是瓣膜间质细胞内的动态平衡紊乱,促使其向成骨样细胞转化[4]。自噬是一种高度保守的分解代谢错误折叠蛋白质和受损细胞器的动态循环系统,以利于细胞的更新和维态[13]。LC3是哺乳动物中酵母细胞Atg8的同源物,是自噬泡形成的标志物,其含量多少可反映自噬的程度[14]。LAMP2是自噬-溶酶体成熟的关键调节因子,其基因缺失可引起自噬小体的积聚,导致细胞自噬功能失调[15]。在钙化性瓣膜间质细胞中,LAMP2基因表达丰富[16]。同时也有报道称黏多糖贮积症小鼠模型的心脏瓣膜增厚,LC3和LAMP2的蛋白表达显著升高,自噬功能失调[17]。在人的瓣膜组织中,检测到LC3基因表达上调,自噬活动增强[9]。本文研究了LC3和LAMP2基因调控序列变异与DHVD的关联性,对阐明DHVD发病的分子机制奠定基础。
针对DHVD患者和健康对照的调控序列DNA,经基因测序分析发现,共有29个序列变异位点,其中7个序列变异位点(g.4085G>A,g.4266G>A,g.4286C>T,g4339G>A,g.4853A>G,g.4903G>T,g.4167A>G)只存在于DHVD组。对所获得的SNP进行卡方检验分析,发现rs42900在男性患者中有差异(P < 0.05),而在女性中无影响,提示rs42900与DHVD患者性别存在关联。随之进行logistic回归分析,结果显示rs35227715的等位基因G与DHVD相关联,是DHVD的独立危险因素,致病风险是1.36倍;DHVD男性患者中rs42900基因型CC和等位基因C与DHVD存在关联,两者的致病风险均为0.56倍,提示其在DHVD发病过程中具有保护性作用。在线TRANSFAC2.0数据库预测结果显示,序列变异位点g.4085G>A可创建SMAD的结合位点,SMAD蛋白家族在TGF-β信号转导起着关键的作用,通过R-Smad/Co-Smad形成的异聚体进入细胞核调节靶基因的表达,其成员SMAD3可降低心肌重塑中心肌细胞的凋亡[18],SMAD4则在心脏中胚层前体细胞的形成中发挥重要作用[19]。g.4266G>A可创建C/EBP的结合位点,C/EBP是一种含“碱性亮氨酸拉链”结构的转录因子, 其功能是促进和维持细胞的分化状态,有研究称其在心脏损伤中可调节心外膜的激活,以改善心脏功能[20]。g.4903G>T可创建Inr结合位点,Inr作为核心启动子的基本要素之一,在转录调控过程中有重要的作用[21]。g.4167A>G仅消除了SOX10的结合位点,而SOX10作为一种重要的转录因子,在脊神经细胞的分化,早期胚胎发育及心肌再生中发挥重要的作用[22]。由此可见,转录因子结合位点的消除或创建可能会改变启动子的转录活性以致改变其基因表达,进而影响自噬水平和功能,从而引起DHVD的发病。
综上所述,调控序列变异的确定能在分子遗传学角度揭示DHVD发病机制。本研究基于生物信息学方法预测调控序列变异位点的功能,下一步我们将利用序列变异报告基因检测,凝胶电泳迁移实验(EMSA),自噬-溶酶体系统功能改变等多种生物功能学方法,验证预测结果的准确性,进而为DHVD的发生发展机制提供坚实的遗传学理论。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Yang Y, Wang Z, Chen Z, et al. Current status and etiology of valvular heart disease in China: a population-based survey[J]. BMC Cardiovasc Disord, 2021, 21(1): 339. DOI:10.1186/s12872-021-02154-8 |
| [2] |
齐喜玲, 许海燕, 刘庆荣, 等. 中国老年退行性心脏瓣膜病住院患者诊疗现状分析[J]. 中国循环杂志, 2019, 34(8): 771-776. DOI:10.3969/j.issn.1000-3614.2019.08.007 |
| [3] |
Baumgartner H, Iung B, Messika-Zeitoun D, et al. The year in cardiovascular medicine 2021:valvular heart disease[J]. Eur Heart J, 2022, 3(7): 633-640. DOI:10.1093/eurheartj/ehab885 |
| [4] |
Kraler S, Blaser MC, Aikawa E, et al. Calcific aortic valve disease: from molecular and cellular mechanism stomedical therapy[J]. Eur Heart J, 2022, 43(7): 683-697. DOI:10.1093/eurheartj |
| [5] |
Schiattarella GG, Hill JA. The rapeutic targeting of autophagy in cardiovascular disease[J]. J Mol Cell Cardiol, 2016, 95: 86-93. DOI:10.1016/j.yjmcc.2015.11.019 |
| [6] |
Abdellatif M, Sedej S, Carmona-Gutierrez D, et al. Autophagy in cardiovascular aging[J]. Circ Res, 2018, 123: 803-824. DOI:10.1161/CIRCRESAHA.118.312208 |
| [7] |
Wu G, Wei G, Huang J, et al. Decreased gene expression of LC3 in peripheral leucocytes of patients with coronary artery disease[J]. Eur J Clin Invest, 2011, 41(9): 958-963. DOI:10.1111/j.1365-2362.2011.02486.x |
| [8] |
Wu G, Huang J, Wei G, et al. LAMP-2 gene expression in peripheral leukocytes is increased in patients with coronary artery disease[J]. Clin Cardiol, 2011, 34(4): 239-243. DOI:10.1002/clc.20870 |
| [9] |
Carracedo M, Persson O, Saliba-Gustafsson P, et al. Upregulated autophagy in calcific aortic valve stenosis confers protection of valvular interstitial cells[J]. Int J Mol Sci, 2019, 20: 1486. DOI:10.3390/ijms20061486 |
| [10] |
Deng XS, Meng X, Venardos N, et al. Autophagy negatively regulates pro-osteogenic activity in human aortic valve interstitial cells[J]. J Surg Res, 2017, 218: 285-291. DOI:10.1016/j.jss.2017.05.088 |
| [11] |
Somers P, Knaapen M, Kockx M, et al. Histological evaluation of autophagic cell death in calcified aortic valve stenosis[J]. J Heart Valve Dis, 2006, 15: 43-47. |
| [12] |
Bursi F, Osranek M, Seward JB, et al. Mitral and aortic valve thickening associated with galactosialidosis: echocardiographic features of a lysosomal storage disease[J]. Echocardiography, 2003, 20: 605-606. DOI:10.1046/j.1540-8175.2003.02139.x |
| [13] |
Mizushima N, Komatsu M. Autophagy: renovation of cells and tissues[J]. Cell, 2011, 147(4): 728-741. DOI:10.1016/j.cell.2011.10.026 |
| [14] |
Nieto-Torres JL, Leidal AM, Debnath J, et al. Beyond autophagy: The expanding roles of ATG8 proteins[J]. Trends Biochem Sci, 2021, 46(8): 673-686. DOI:10.1016/j.tibs.2021.01.004 |
| [15] |
Saftig P, Beertsen W, Eskelinen EL. LAMP-2:A control step for phagosome and autophagosome maturation[J]. Autophagy, 2008, 4(4): 510-512. DOI:10.4161/auto.5724 |
| [16] |
Cui L, Rashdan NA, Zhu D, et al. End stage renal disease-induced hypercalcemia may promote aorticvalvecalcification via annexin Ⅵ enrichment of valveinterstitial cell derived-matrix vesicles[J]. J Cell Physiol, 2017, 232(11): 2985-2995. DOI:10.1002/jcp.25935 |
| [17] |
Schiattarella GG, Cerulo G, De Paquale V, et al. The murine model of mucopolysaccharidosis IIIB develops cardiopathies over time leading to heart failure[J]. PLoS One, 2015, 10(7): e0131662. DOI:10.1371/journal.pone.0131662 |
| [18] |
Kong P, Shinde AV, Su Y, et al. Opposing actionsof fibroblastand cardiomyocyte smad 3 signaling in the infarcted myocardium[J]. Circulation, 2018, 137(7): 707-724. DOI:10.1161/CIRCULATIONAHA.117.029622 |
| [19] |
Xu J, Gruber PJ, Chien KR. SMAD4Is essential for human cardiac mesodermal precursor cell formation[J]. Stem Cells, 2019, 37(2): 216-225. DOI:10.1002/stem.2943 |
| [20] |
Huang GN, Thatcher JE, McAnally J, et al. C/EBP transcription factors mediate epicardial activation during heart development and injury[J]. Science, 2012, 338(6114): 1599-1603. DOI:10.1126/science.1229765 |
| [21] |
Kraus RJ, Murray EE, Wiley SR, et al. Experimentally determined weight matrix definitions of the initiator and TBP binding site elements of promoters[J]. Nucleic Acids Res, 1996, 24(8): 1531-1539. DOI:10.1093/nar/24.8.1531 |
| [22] |
Sande-Melón M, Marques IJ, Galardi-Castilla M, et al. Adultsox 10+cardiomyocytes contribute to myocardial regenerationin the zebrafish[J]. Cell Rep, 2019, 29(4): 1041-1054.e5. DOI:10.1016/j.celrep.2019.09.041 |




 闫波, 我校1979级校友, 医学博士, 教授, 博士研究生导师, 山东省泰山学者特聘专家, 济宁医学院精准医学研究院院长。1996年获得中国协和医科大学医学分子生物学博士学位, 1996-2001年在美国国立卫生研究院完成博士研究。2002-2011年起历任美国乔治·华盛顿大学医学院研究员, 助理教授和副教授。2012年起任济宁医学院教授, 2015年被山东省政府聘为“泰山学者海外特聘专家”。长期从事医学分子生物学、医学分子遗传学和发育生物学的基础研究和临床应用基础研究, 主要研究方向为心血管疾病的分子遗传学、心肌再生和心脏修复。在JBC, Dev Biol, Hum Mol Genet和Transl Res等杂志上发表SCI论文100余篇(其中通讯作者70余篇), 中文核心论文20余篇。主持完成国家自然科学基金项目5项, 参与完成国家自然科学基金项目2项, 参与完成科技部国家重点研发计划2项, 主持完成山东省自然科学基金项目2项。参与在研科技部国家重点研发计划1项。已培养研究生20余名
闫波, 我校1979级校友, 医学博士, 教授, 博士研究生导师, 山东省泰山学者特聘专家, 济宁医学院精准医学研究院院长。1996年获得中国协和医科大学医学分子生物学博士学位, 1996-2001年在美国国立卫生研究院完成博士研究。2002-2011年起历任美国乔治·华盛顿大学医学院研究员, 助理教授和副教授。2012年起任济宁医学院教授, 2015年被山东省政府聘为“泰山学者海外特聘专家”。长期从事医学分子生物学、医学分子遗传学和发育生物学的基础研究和临床应用基础研究, 主要研究方向为心血管疾病的分子遗传学、心肌再生和心脏修复。在JBC, Dev Biol, Hum Mol Genet和Transl Res等杂志上发表SCI论文100余篇(其中通讯作者70余篇), 中文核心论文20余篇。主持完成国家自然科学基金项目5项, 参与完成国家自然科学基金项目2项, 参与完成科技部国家重点研发计划2项, 主持完成山东省自然科学基金项目2项。参与在研科技部国家重点研发计划1项。已培养研究生20余名