2. 济宁医学院精准医学研究院, 济宁 272067
2. Institute ofPrecision Medicine, Jining Medical University, Jining 272067, China
结直肠癌是人类高发恶性肿瘤, 其发病率一直呈上升趋势, 在全球恶性肿瘤发病率中已上升至第三位, 其死亡率居恶性肿瘤死因的第二位。在我国, 结直肠癌死亡率已位于恶性肿瘤死亡率的第五位, 严重危害人类健康,对家庭和社会造成巨大的经济负担[1]。结肠癌治疗方法目前仍然以手术为主,化疗是一个主要的治疗方法,包括靶向药物治疗,还有新兴的免疫方法。但目前的方法仍存在术后复发,不良反应强烈等弊端。因此,急需开发高效、低副作用的新型结肠癌疗法。近几年抗癌药物研究显示,酚类化合物是具有抗癌价值的单体药物研究领域中的热门主题。迄今人们已经发现或合成一系列具有抗癌活性的酚类化合物,如儿茶酚衍生物、多酚衍生物、鹤草酚等。儿茶酚可以通过诱导细胞周期停滞和细胞凋亡来抑制胰腺癌的活性,并可调节胰腺癌细胞中的AMPK / Hippo信号通路[2]。在前期研究中,我们从实验室合成酚类单体化合物2, 4-dibromo-3-fluoro-6-(3-(trifluoromethyl) isoxazol-5-yl) phenol(DFTP)并发现其对结肠癌有明显抑制作用。本论文中,我们用CCK-8试剂盒检测细胞活性,用倒置显微镜监测其形态学的变化,用细胞划痕实验检测细胞的迁移能力,用EdU荧光染色试剂盒检测DNA复制速率,用克隆形成实验检测细胞的克隆形成能力,用流式细胞仪检测细胞周期,用Calcein AM荧光染色法检测活/死细胞,用Annix-V-FITC染色检测细胞凋亡,从多角度阐述了DFTP对结肠癌的抑制作用。
1 材料与方法 1.1 材料单体化合物DFTP来自中南民族大学药学院;结肠癌细胞系SW480、胶质瘤细胞系U251、肺癌细胞系A549购自北纳生物(中国,河南,BNCC);胰蛋白酶(北京,沃卡威生物技术有限公司),结晶紫染色试剂盒(江苏,凯基生物),BSA(北京,索莱宝科技有限公司),TritonX-100(北京索莱宝科技有限公司);RNA酶、碘化丙啶、Hoechst 33342染色液、EdU细胞增殖检测试剂盒、4%多聚甲醛固定液、CCK-8细胞活性试剂盒、CCK-F试剂盒、V-FITC/PI细胞凋亡检测试剂盒均购自上海碧云天生物技术有限公司。DMEM培养基(以色列,BI公司)、PBS缓冲液(以色列,BI公司)、胎牛血清(以色列,BI公司)、青霉素/链霉素双抗(以色列,BI公司)、细胞划痕插件(德国,iBidi)均由济宁诺昂生物科技有限公司代理商代购。
光学显微镜(8588,日本尼康);Cytation5多功能酶标仪(美国伯腾公司);Cyto FLEX LX流式细胞仪(中国贝克曼库尔特有限公司)。
1.2 方法 1.2.1 细胞培养SW480细胞(结肠癌细胞系)、A549细胞(肺癌细胞系)、U251细胞(脑胶质瘤细胞系)培养于完全培养基(DMEM+10%FBS+1%PS),置于37℃(5% CO2)恒温细胞培养箱中培养,每日观察细胞状态及密度。
1.2.2 细胞活性检测SW480细胞、A549细胞、U251细胞接种在培养皿中贴壁后,用DFTP处理适当时间(每个浓度3个复孔),弃掉培养基后,加入CCK-8细胞增殖检测试剂,置于37℃(5% CO2)恒温培养箱中孵育20~40 min后用酶标仪检测细胞吸光度,检测波长450nm。
1.2.3 细胞形态观测将SW480细胞接种在6孔板中培养,细胞贴壁后用不同浓度DFTP处理,每日观察细胞形态并拍照保存。
1.2.4 细胞迁移实验将细胞迁移插件(iBid)插在12孔板中,在插件的每个小孔中接种SW480细胞,细胞长满后拔除插件,用DFTP处理适当时间,每隔一定时间在显微镜下观察拍照并保存。细胞划痕的定量分析在Image J(V1.8.0.112)软件中进行。
1.2.5 细胞增殖检测将SW480细胞接种在12孔板中,细胞贴壁后用DFTP处理适当时间,每孔加入EdU在恒温箱中孵育,取出后用4%多聚甲醛固定,0.3% Triton X-100通透,3%BSA(in PBS)溶液清洗,加入click染液(按照碧云天C0078S试剂盒说明书配置)避光室温孵育,清洗后加入H33342避光孵育,PBS清洗后拍摄荧光照片保存。
1.2.6 细胞克隆形成实验将SW480细胞消化后梯度稀释,按照每孔500个细胞的密度接种在12孔板中,培养72h后待细胞形成小型克隆团落时用DFTP处理,后续培养过程中,每3天更换一次培养基并补足相应浓度的DFTP,待对照组细胞出现大型克隆团落时终止培养,用结晶紫染色剂染色,在PBS环境中拍照保存。
1.2.7 细胞周期检测将SW480细胞接种在6孔板中培养,贴壁后用不同浓度DFTP处理24 h后收获细胞。细胞收集于1.5ml EP管,经清洗—离心后,用冷乙醇(70%)再冰浴中固定40 min。固定后的细胞经PBS清洗后,加入细胞周期检测剂(由PI、Triton X-100、RNA酶组成)避光孵育20 min,用流式细胞仪检测细胞周期。
1.2.8 活细胞/死细胞双荧光染色实验将SW480细胞接种在6孔板中培养,细胞贴壁后用DFTP处理适当时间,用PBS清洗,加入用缓冲液配置的Calcein AM染液(按说明书进行配制),在培养箱中孵育适当时间后,加入用PBS配置的H33342和PI染液避光孵育,PBS清洗后拍摄荧光照片保存。
1.2.9 细胞凋亡检测将SW480细胞接种在6孔板中培养,细胞贴壁后用DFTP处理适当时间,弃培养液,加入用结合液配制的Annix-V-FITC和PI染液(按说明书进行配制)避光孵育,弃染液后加入用PBS配置的H33342染液避光孵育15 min(4℃,避光),拍摄荧光照片并保存。
1.3 统计学方法采用SPSS17.0软件进行统计分析。符合正态分布的连续计量资料,用x±s表示。在两组数据之间进行成对检验时,采用t检验(Student's t test)进行分析;在(大于两组的)多组数据之间进行统计学分析时,采用单因素方差分析(One-way ANOVA analysis)。当P < 0.05时,认为差异有统计学意义。
2 结果 2.1 DFTP对癌细胞的抑制作用图 1A为DFTP的结构式;DFTP对癌细胞的抑制在3种恶性肿瘤细胞系中得到了研究,如图 1B所示,DFTP对结肠癌细胞SW480、脑胶质瘤细胞U251以及肺癌细胞A549的细胞活力均有不同程度的抑制作用,其中SW480对DFTP最为敏感。该现象分别在10μM与20μM的DFTP中得到了具体对比(图 1B)。经过定量计算,DFTP对上述3种细胞系的半抑制浓度(IC50)分别为4.2μM、10.3μM、6.3μM(图 1C)。
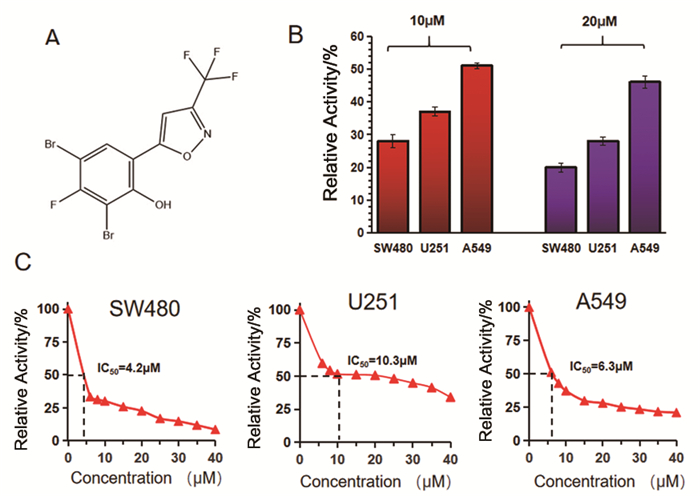
|
图 1 DFTP对癌细胞的抑制作用 |
正常生长的SW480细胞结构完整,贴壁状态良好,细胞呈圆形至梭形。而随着DFTP浓度增加,SW480细胞密度逐渐下降,细胞外观变狭长,细胞边缘有丝状结构出现(见图 2中黄色箭头标示),并且随着DFTP浓度增大,细胞出现无法良好伸展甚至不能贴壁生长的现象(见图 2中蓝色箭头标示)。

|
图 2 DFTP对结肠癌细胞形态方面的影响 |
正常生长的SW480细胞向划痕中央大量迁移,细胞延展伸长呈梭形或线形。而随着DFTP浓度增加,SW480细胞仍然大量向中央迁移,细胞形态与正常生长的细胞相似(见图 3A)。经图像处理软件ImageJ测量和统计学分析,在相同处理时间,不同DFTP处理浓度下的细胞划痕面积无显著差异,且在不同浓度下,处理前后的细胞划痕面积之差无显著差异(F=1.849, P>0.05)(见图 3B)。
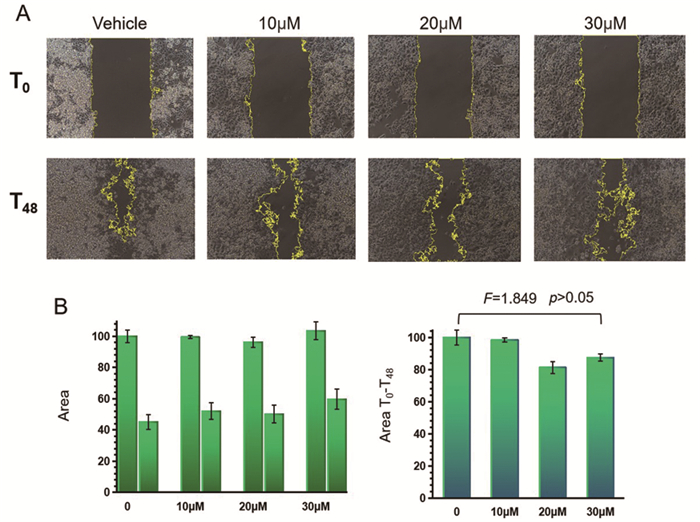
|
图 3 DFTP对结肠癌细胞迁移能力的影响 |
如图 4A所示,红色荧光代表细胞DNA复制速率,蓝色荧光代表细胞核。正常生长的SW480细胞在荧光显微镜下红色荧光和蓝色荧光均较强烈,表示细胞DNA合成旺盛,细胞增殖速率快,细胞密度较高。而随着DFTP浓度的增加,SW480细胞在荧光显微镜下的红色荧光和蓝色荧光均逐渐减弱,并且红色荧光与蓝色荧光之比也随之下降(F=11.897, P < 0.001),这说明随着DFTP的加入,细胞密度逐渐降低,DNA复制速率和细胞增殖能力受到显著抑制。
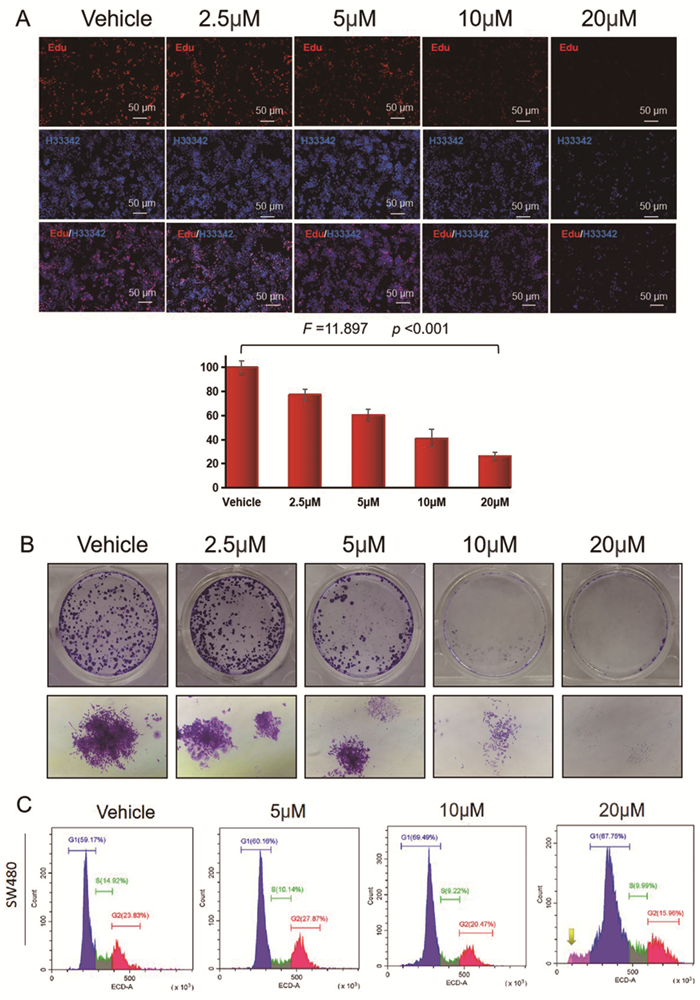
|
图 4 DFTP对结肠癌细胞增殖能力的抑制作用 |
正常生长的SW480细胞形成较多大型细胞克隆团落,细胞有重叠堆积生长的现象。而随着DFTP浓度的增加,SW480细胞形成的克隆团落逐渐变小,细胞分布逐渐分散,直至无法形成团落,甚至细胞碎片逐渐增多,细胞密度显著降低(见图 4B),这说明DFTP对于结肠癌细胞SW480的克隆形成具有显著的抑制作用。
2.6 DFTP对SW480细胞周期S期的抑制作用如图 4C所展示,随着DFTP浓度的增加,SW480细胞周期中的S期所占比逐渐下降,并且在DFTP浓度为20 μM时,有大量死细胞存在(如图 4C中黄色箭头所表示)。
2.7 DFTP对SW480细胞的杀伤作用如图 5A所表示,红色荧光代表死细胞,绿色荧光代表活细胞,蓝色荧光代表细胞核。正常生长的SW480细胞在荧光显微镜下红色荧光强度较弱,蓝色和绿色荧光均较强烈,且蓝色和绿色荧光的分布具有高度一致性。随着DFTP浓度的增加,红色荧光逐渐增强,死细胞逐渐增多,蓝色和绿色荧光均逐渐减弱,活细胞逐渐减少(F=16.38, P < 0.001)。
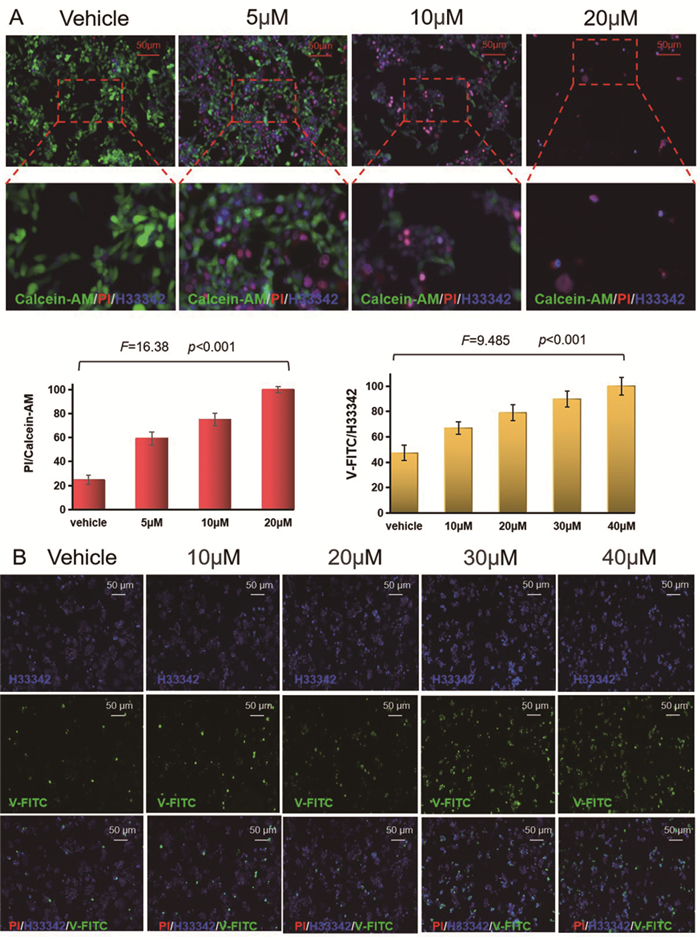
|
图 5 DFTP对SW480细胞凋亡的促进作用 |
如图 5B所展示,蓝色荧光代表细胞核,绿色荧光代表细胞凋亡水平。正常生长的SW480细胞绿色荧光强度较弱,细胞凋亡数量较少。随着DFTP浓度的增大,绿色荧光强度也逐渐增大(F=9.485, P < 0.001),细胞凋亡数量增多,这提示DFTP可以促进SW480发生细胞凋亡。
3 讨论目前手术切除结肠肿瘤组织结合药物辅助化疗的方法是结肠癌主要的治疗方式[3],但由于结肠癌细胞的增殖速度较快,侵袭转移能力较强,人体缺乏有效的免疫抑制反应,很容易造成周围正常器官及组织的损害,导致术后再次复发,致使远期预后不良。传统的化疗药物存在毒副作用大、耐药性强、价格昂贵的问题。虽然随着医疗条件的改善手术技术的进步和新型药物制剂的不断发展,结肠癌的发展趋势已然得到了有效的控制,但其仍然保持着较高的死亡率,多年来的治疗经验以及研究进展表明影响结肠癌患者患病率及复发率的主要因素是癌细胞的转移[4]。因此, 能够抑制肿瘤细胞增殖、迁移作用的化疗药物一直是肿瘤学研究的重点,探究影响结肠癌细胞侵袭和转移的相关分子机制对结肠癌患者的早期诊断和治疗以及改善患者预后具有重要的意义[5-6]。本文应用DFTP处理结肠癌系SW480细胞,发现DFTP以浓度依赖性或剂量依赖性抑制SW480细胞增殖并促使细胞凋亡,从而起到抑制结肠癌细胞生长的作用。通常细胞增殖与细胞程序性凋亡是正常的生理过程,并维持在一个平衡状态[7],如果打破细胞增殖与凋亡之间的平衡状态,就可对肿瘤的生长进行有效的干预[8],因而, 可通过干涉细胞增殖及程序性凋亡等途径对肿瘤进行治疗[9-10]。在当前一线抗癌药物中,靶向细胞周期的单体化合物是重要的来源。儿茶酚对ERK2/c-Myc信号传导轴有抑制作用,能够通过诱导肺癌细胞G1期停滞以及与G1-S进展相关的蛋白表达降低来减少肺癌肿瘤在体外和体内的生长[11]。此外,Abliz [12]发现在传统维吾尔医学中的一种草药制剂Savda Munziq(ASMq)的一种多酚也被证实具有抗宫颈癌的作用,富含酚类的ASMq提取物可诱导人宫颈鳞癌SiHa细胞凋亡,能以浓度依赖和时间依赖的方式提高细胞凋亡率;富酚提取物对SiHa细胞的生长抑制和凋亡诱导还与抗凋亡分子Bcl-2表达以及端粒酶和Survivin表达的下调有关。这些发现表明,酚类化合物在未来的临床治疗中具有作为对抗癌症发生的新型治疗剂的潜力。本文结果显示,在经过DFTP处理后细胞活性受到明显抑制,其活性与培养时间和处理浓度呈相关性,说明DFTP可以有效抑制结肠癌细胞的细胞活性;在细胞迁移实验中,经过DFTP处理后的SW480细胞迁移并未受到影响,说明DFTP对于结肠癌细胞SW480的迁移无显著影响;在EdU细胞增殖检测实验中发现在处理浓度为10μM时细胞增殖能力急剧下降,说明DFTP可以降低结肠癌细胞SW480的DNA复制速率;在克隆形成实验中10μM的DFTP细胞失去克隆形成细胞团落的能力,说明DFTP可以抑制结肠癌细胞的增殖与克隆形成;在经过DFTP处理后,细胞周期中S期显著下降,而G1和G2期并没有出现显著变化,这说明DFTP影响SW480细胞DNA复制(这与前面的EdU实验结果是一致的);与此同时,对于细胞周期检测的实验结果显示,当DFTP浓度为20 μM时开始出现细胞死亡现象,并且这种死亡为细胞凋亡。但是本文并未对DFTP的诱导细胞凋亡的分子机制进行深度阐述,这将在下一步工作中进行深入的探究和验证。
综上所述,本研究首次揭示了DFTP的抑癌能力和特点,相比于肺癌和脑胶质瘤,DFTP对于抑制结肠癌细胞更为有效。DFTP虽然不影响结肠癌细胞SW480细胞的移动能力,但是可以通过抑制细胞增殖和诱导细胞凋亡“双管齐下”的方式对抗结肠癌:通过抑制DNA复制,抑制细胞周期S期向G2期的过渡,从而降低细胞增殖速率,并且可以通过诱导细胞凋亡来杀伤结肠癌细胞SW480。本研究对于开发以酚类化合物单体为先导化合物的抗肿瘤药物有重要意义,为开发新的结肠癌的治疗方法提供了实验依据。
志谢:感谢中南民族大学药学院杨小龙教授提供单体化合物DFTP,并为本课题提供了宝贵建议。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
吕强, 邢沈阳, 赵志辉, 等. 结肠癌的研究现状及展望[J]. 中国实验诊断学, 2009, 13(8): 4. DOI:10.3969/j.issn.1007-4287.2009.08.055 |
| [2] |
Moon JY, Ediriweera MK, Ji YR, et al. Catechol enhances chemo and radiosensitivity by targeting AMPK/Hippo signaling in pancreatic cancer cells[J]. Oncol Rep, 2021, 45(3): 1133-1141. DOI:10.3892/or.2021.7924 |
| [3] |
Erdem GU, Dogan M, Demirci NS, et al. Oxaliplatin-induced acute thrombocytopenia[J]. J Cancer Res Ther, 2016, 12(2): 509. DOI:10.4103/0973-1482.154056 |
| [4] |
Wei S, Ding C, Xu X, et al. Investigation of the expressions of MMPs and TIMPs between isogeneic and allogeneic rat aortic transplantation[J]. Mol Med Rep, 2018, 17(5): 6909-6913. DOI:10.3892/mmr.2018.8684 |
| [5] |
程贝贝, 冯如, 陈光侠, 等. 二甲双胍对结肠癌HCT116细胞增殖、凋亡的影响[J]. 胃肠病学和肝病学杂志, 2017, 26(8): 4. DOI:10.3969/j.issn.006,5709.2017.08.005 |
| [6] |
随振阳, 张琪, 曹文斌, 等. 二甲双胍联合奥沙利铂对人结肠癌细胞HCT-8迁移及侵袭的影响[J]. 中国临床研究, 2019, 32(8): 1019-1024. DOI:10.13429/j.cnki.cjcr.2019.08.003 |
| [7] |
Li X, Deng Y, Zheng Z, et al. Corilagin, a promising medicinal herbal agent[J]. Biomed Pharmacother, 2018, 99: 43-50. DOI:10.1016/j.biopha.2018.01.030 |
| [8] |
Yang WT, Li GH, Li ZY, et al. Effect of corilagin on the proliferation and NF-κB in U251 glioblastoma cells and U251 glioblastoma stem-like cells[J]. Evid Based Complement Alternat Med, 2016, 2016: 1418309. DOI:10.1155/2016/1418309 |
| [9] |
Bala-Silva J, Matias D, Carmo AD, et al. Cellular and molecular mechanisms of glioblastoma malignancy: Implications in resistance and therapeutic strategies[J]. Semin Cancer Biol, 2018, 58: 130-141. DOI:10.1016/j.semcancer.2018.09.007 |
| [10] |
陈俊, 周佳彬, 李根华, 等. 柯里拉京对神经胶质瘤U373MG细胞增殖和迁移能力的影响[J]. 济宁医学院学报, 2019, 42(3): 158-161. DOI: 10.3969jissn.1000-9760.2019.03.002.
|
| [11] |
Lindoy, Shin SH, Lee MH, et al. A natural small molecule, catechol, induces c-Myc degradation by directly targeting ERK2 in lung cancer[J]. Oncotarget, 2016, 7(23): 35001-35014. DOI:10.18632/oncotarget.9223 |
| [12] |
Abliz G, Mijit F, Hua L, et al. Anti-carcinogenic effects of the phenolic-rich extract from abnormal Savda Munziq in association with its cytotoxicity, apoptosis-inducing properties and telomerase activity in human cervical cancer cells (SiHa)[J]. BMC Complement Altern Med, 2015, 15: 23. DOI:10.1186/s12906-015-0530-x |




 夏勇, 男, 济宁医学院精准医学研究院教授, 全南国立大学(韩国)生物医学博士, 纽约大学(美国)博士后, 山东省“泰山学者”青年专家, 济宁市高层次人才, 山东大学和山东第一医科大学硕士生导师, 获2022年山东省“青年科技奖”, 2022年济宁市“最美科技工作者”。长期从事生物医学方面研究, 主要方向为: 1)肿瘤发生与发展的重要分子病理机制; 2)新型抗肿瘤分子的筛选及药理机制研究。目前已在Nature Communications、Cancer Research、PNAS等高水平国际学术期刊发表SCI论文36篇, 其中以第一作者或通讯作者发表SCI论文20篇, 单篇最高影响因子17.694。主持国家自然科学基金面上项目、中央本级重大增减支项目1项、省部级项目及横向项目共计5项。目前以第一发明人或唯一发明人申报国家发明专利5项以及国际发明专利1项, 已获授权国家发明专利4项。担任SCI学术期刊《Frontier in Pharmacology》的Topic Editor, 全国肿瘤代谢委员会会员, 山东省抗癌协会会员, 山东省青年科学家协会会员, 山东省留学归国人员协会会员, 济宁医学院欧美同学会副秘书长; 担任《Biochemistry and Cell Biology》《Digestive Diseases and Sciences》《International Journal of Biological Macromolecules》《Journal of Cellular Biochemistry》《Microbiological Research》《Proceed Biochemistry》等10余家SCI学术期刊的审稿人
夏勇, 男, 济宁医学院精准医学研究院教授, 全南国立大学(韩国)生物医学博士, 纽约大学(美国)博士后, 山东省“泰山学者”青年专家, 济宁市高层次人才, 山东大学和山东第一医科大学硕士生导师, 获2022年山东省“青年科技奖”, 2022年济宁市“最美科技工作者”。长期从事生物医学方面研究, 主要方向为: 1)肿瘤发生与发展的重要分子病理机制; 2)新型抗肿瘤分子的筛选及药理机制研究。目前已在Nature Communications、Cancer Research、PNAS等高水平国际学术期刊发表SCI论文36篇, 其中以第一作者或通讯作者发表SCI论文20篇, 单篇最高影响因子17.694。主持国家自然科学基金面上项目、中央本级重大增减支项目1项、省部级项目及横向项目共计5项。目前以第一发明人或唯一发明人申报国家发明专利5项以及国际发明专利1项, 已获授权国家发明专利4项。担任SCI学术期刊《Frontier in Pharmacology》的Topic Editor, 全国肿瘤代谢委员会会员, 山东省抗癌协会会员, 山东省青年科学家协会会员, 山东省留学归国人员协会会员, 济宁医学院欧美同学会副秘书长; 担任《Biochemistry and Cell Biology》《Digestive Diseases and Sciences》《International Journal of Biological Macromolecules》《Journal of Cellular Biochemistry》《Microbiological Research》《Proceed Biochemistry》等10余家SCI学术期刊的审稿人