帕金森病(Parkinson’s disease,PD)是一种常见的仅次于阿尔茨海默病(Alzheimer’s disease,AD)的神经退行性疾病[1],其主要病理特征是黑质致密部多巴胺能神经元发生退行性变,并伴有路易氏小体(Lewy body,LB) 出现。LB主要是由于α-突触核蛋白(α-synuclein)的异常积累形成的[2]。PD的发病机制还不清楚,而线粒体功能障碍与PD发病机制密切相关[3-4]。
鱼藤酮(rotenone)是一种细胞毒性物质,可选择性地抑制细胞呼吸链NADH脱氢酶(即复合物Ⅰ,complex Ⅰ)的活性,使NADH氧化为NAD的过程受阻,减少ATP生成,阻碍质子传递,细胞中活性氧的含量进而增加,导致自由基过量累积,从而促进细胞凋亡[5-6]。
Apelin最初是从牛胃组织中分离出来的。Apelin-13、apelin-17和apelin-36是apelin前体肽经水解生成的生物活性形式。越来越多的证据表明,apelin可能在PD模型中具有神经保护作用[7-8]。
本实验用鱼藤酮刺激SH-SY5Y细胞,制作PD体外模型,然后用apelin-36干预,研究apelin-36的神经保护作用及对线粒体功能的影响。
1 材料与方法 1.1 材料 1.1.1 试剂人神经母细胞瘤细胞系(SH-SY5Y细胞)购自美国菌种保藏中心(ATCC);DMEM培养液(美国Hyclone公司);鱼藤酮(美国Sigma公司);Apelin-36(美国Phoenix Pharmaceuticals公司);CCK-8(日本Dojindo公司);Hoechst 33342检测试剂盒(日本Dojindo公司);线粒体复合物Ⅰ(complex Ⅰ) ELISA试剂盒(酶免), ADP/ATP比率检测试剂盒(日本Dojindo公司);RIPA裂解液(碧云天公司);BCA蛋白浓度测定试剂盒(天根生物公司);超敏ECL化学发光试剂盒(万类生物公司);α-synuclein抗体、bcl-2抗体、Bax抗体(美国Cell Signaling Technology公司);β-actin抗体(北京中杉金桥有限公司)。
1.1.2 仪器微量移液器(德国Eppendorf公司);CO2培养箱(美国Thermo公司);台式低温高速离心机(美国Beckman公司);超声波细胞粉碎仪(江苏波场智能科技股份有限公司);普通光学显微镜、倒置生物显微镜(日本Olympus公司);酶标仪、电泳仪、转膜仪(美国Bio-Rad公司);激光共聚焦扫描显微镜(SP8)(德国Leica公司)。
1.2 方法 1.2.1 细胞培养SH-SY5Y细胞培养于DMEM培养基中,内含10%胎牛血清、青霉素(100 U/ml)和链霉素(100 U/ml)。将SH-SY5Y细胞接种于96、12或6孔板在37℃、5%CO2培养箱中培养,细胞生长至约90%后,后续根据需要加入鱼藤酮和apelin-36。
1.2.2 药物处理及分组取对数生长期的SH-SY5Y细胞,以5×104/孔的密度接种于96、12或6孔板中,随机分成4组:对照组、apelin-36组、鱼藤酮组、apelin-36+鱼藤酮组,置于37℃、5%CO2的细胞培养箱中培养,待细胞长至约90%,apelin-36组、apelin-36+鱼藤酮组先给予apelin-36(10-6M)预处理,其他两组加入相同剂量的PBS,鱼藤酮组、apelin-36+鱼藤酮组2h后给予鱼藤酮(500 μM)处理,其他两组加入相同剂量PBS,放入培养箱培养24h,然后进行后续实验。
1.2.3 细胞活力测定用CCK-8法测定细胞活力。首先将SH-SY5Y细胞以5×104/孔的密度接种在96孔培养板中,细胞长至约90%,按上述方法进行药物处理。继续培养约22h后,加入CCK-8溶液(10μl/孔),避光继续孵育2h。最后在酶标仪450nm处测量吸光度值。每组设6个复孔,实验平行重复3次。
1.2.4 细胞凋亡检测将SH-SY5Y细胞以5×104/孔的密度接种于12孔板的盖玻片上,细胞长至约90%,后按上述方法药物处理。继续培养约22h后,用PBS冲洗细胞,用4%多聚甲醛固定20min,然后用PBS清洗3次。随后,加入5mg/ml的Hoechst 33342,避光在室温下放置15min,再用PBS冲洗两次。染色细胞在倒置荧光显微镜下成像。每组选择3张照片,计数凋亡细胞数。
1.2.5 线粒体复合物-Ⅰ(complex Ⅰ)检测SH-SY5Y细胞以5×104/孔的密度接种在6孔培养板中。细胞长至约90%,然后按上述方法进行药物处理。继续培养约22h后,去除上清液,按照人Complex Ⅰ ELISA试剂盒的说明进行操作。
1.2.6 ADP/ATP比率检测SH-SY5Y细胞以5×104/孔的密度接种在白色96孔培养板中。细胞长至约90%,后按上述方法药物处理。继续培养约22h后,按照ADP/ATP比率检测试剂盒说明操作。
1.2.7 相关蛋白表达检测Western blotting用于检测Bax、bcl-2、α-synuclein的表达,β-actin作为对照。方法如下:按上述方法处理细胞,然后将SH-SY5Y细胞中提取的等量蛋白质(30μg)加载到10% SDS-PAGE上,随后转移到PVDF膜上。在室温下,用含5%无脂奶粉的TBST(含1%吐温20的TBS缓冲液)封闭膜1h,然后在4℃与一抗孵育过夜。然后用TBST清膜3次,在室温下与二抗(1:5000)孵育1h。最后加入ECL溶液,暗室内曝光显影。实验平行重复3次,用ImageJ软件分析目标条带的灰度值。
1.3 统计学方法该实验中的数据使用GraphPad Prism 5.0软件分析,计量资料以x±s表示,组间比较采用方差分析方法进行, 组间两两比较用Bonferroni检验, P < 0.05具有统计学意义。
2 结果 2.1 Apelin-36对鱼藤酮处理的SH-SY5Y细胞活力的影响鱼藤酮(500μM)降低了SH-SY5Y细胞存活率,而apelin-36(10-6M)预处理减轻了鱼藤酮的神经毒性并提高细胞活力。表明apelin-36对鱼藤酮诱导损伤的SH-SY5Y细胞存在一定的保护作用。见图 1。

|
图 1 Apelin-36对鱼藤酮刺激的SH-SY5Y细胞活力的影响 注:***P < 0.001 vs.对照组;###P < 0.001 vs.鱼藤酮组 |
Hoechst 33342染色结果(图 2A)显示,与鱼藤酮组相比,apelin-36减轻了鱼藤酮引起的细胞凋亡,并显著降低了细胞凋亡率(图 2B)。
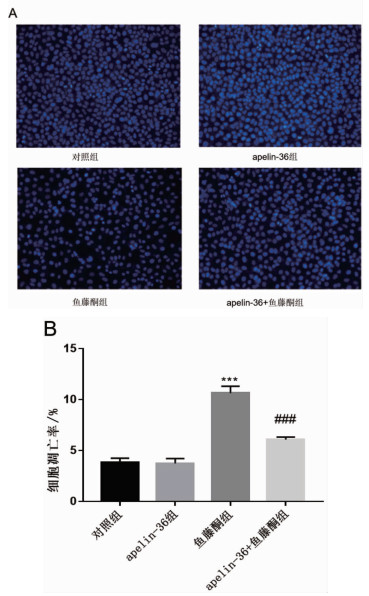
|
图 2 Apelin-36对鱼藤酮刺激的SH-SY5Y细胞凋亡的影响 注:***P < 0.001 vs.对照组;###P < 0.001 vs.鱼藤酮组。 |
与对照组相比较,鱼藤酮组bcl-2的表达显著降低,Bax的表达显著增加;而apelin-36+鱼藤酮组与鱼藤酮组相比,apelin-36则明显上调了bcl-2的表达,减少了Bax的表达(图 3A)。鱼藤酮组bcl-2/Bax的比值与对照组相比明显降低,而apelin-36+鱼藤酮组与鱼藤酮组相比,bcl-2/Bax的比值明显升高,说明apelin-36减轻了鱼藤酮造成的细胞凋亡(图 3B)。与对照组相比,鱼藤酮组α-synuclein的表达显著增加,而apelin-36+鱼藤酮组与鱼藤酮组相比,apelin-36明显减少了α-synuclein的表达(图 3C、3D)。
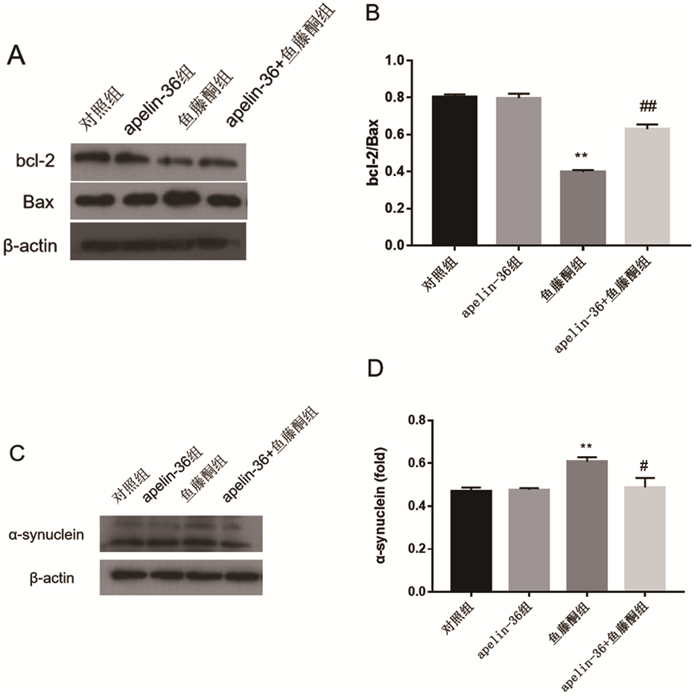
|
图 3 Apelin-36对鱼藤酮刺激的SH-SY5Y细胞中bcl-2、Bax和α-synuclein表达的影响 注:**P < 0.01 vs.对照组;#P < 0.05 vs.鱼藤酮组;##P < 0.01 vs.鱼藤酮组 |
与对照组相比,鱼藤酮组complex Ⅰ的表达下调,ADP/ATP比率显著上调;而与鱼藤酮组相比,apelin-36和鱼藤酮共处理组逆转了这种现象。见图 4。

|
图 4 Apelin-36对鱼藤酮诱导损伤的SH-SY5Y细胞中complex Ⅰ和ADP/ATP的影响 注:***P < 0.001 vs对照组;###P < 0.001 vs鱼藤酮组;##P < 0.01 vs鱼藤酮组 |
线粒体是有氧呼吸发生的主要场所,除了为细胞提供能量外,线粒体还参与了细胞信息传递、细胞分化、和细胞凋亡等过程,而且拥有调控细胞生长和细胞周期的能力[9]。研究显示错误折叠的α-synulein的过度累积导致了神经退行性变,而线粒体功能障碍参与了错误折叠的α-synulein累积这一过程[10-11]。
鱼藤酮是一种可直接透过细胞膜和血脑屏障的细胞毒性物质。线粒体complex Ⅰ可被鱼藤酮选择性地阻断,从而使NADH的氧化过程受阻,ATP生成减少,细胞中活性氧族增加,进而自由基增加,进一步导致氧化应激[12],最终引起细胞凋亡。因此鱼藤酮可导致细胞线粒体功能障碍,引起细胞凋亡。在本实验中,与对照组相比,鱼藤酮组α-synulein表达明显升高,bcl-2/Bax比值明显降低,细胞活力明显降低,细胞凋亡显著增多。Bcl-2家族蛋白是典型的凋亡相关蛋白,可操控线粒体的外膜通透性。促凋亡蛋白Bax可与抗凋亡蛋白bcl-2结合形成调节细胞凋亡的异二聚体,当细胞发生凋亡时,bcl-2/Bax比率降低[13]。与鱼藤酮组相比,apelin-36和鱼藤酮共处理组中α-synulein的表达明显降低,说明apelin-36预处理可减少错误折叠的α-synulein累积;同时,apelin-36和鱼藤酮共处理组中bcl-2/Bax比率明显升高,细胞活力显著升高,细胞凋亡则明显减少,说明apelin-36预处理可减少细胞凋亡,因此apelin-36可减轻鱼藤酮对SH-SY5Y细胞的神经毒性作用,对神经细胞起到保护作用。
鱼藤酮通过阻断complex Ⅰ造成了ATP生成减少,而ATP的生成减少降低了线粒体膜电位(ΔΨm),导致线粒体膜的通透性改变,引起了线粒体功能紊乱[14-15]。本研究首次在鱼藤酮PD体外模型中通过检测线粒体complex Ⅰ的表达和ADP/ATP的比率,来讨论apelin-36是否可以减轻鱼藤酮造成的线粒体功能紊乱。与对照组相比,鱼藤酮组complex Ⅰ的表达明显降低,而ADP/ATP的比率显著升高,这说明鱼藤酮造成了线粒体功能紊乱。与鱼藤酮组相比,apelin-36和鱼藤酮共处理组complex Ⅰ的表达明显升高,而ADP/ATP的比率显著降低,说明apelin-36可以减轻鱼藤酮造成的线粒体功能紊乱。
综上所述,apelin-36可以减轻鱼藤酮造成的线粒体功能紊乱,减少错误折叠的α-synulein累积,提高细胞活力,减少细胞凋亡,起到神经保护作用。而apelin-36通过何种信号传导途径减轻鱼藤酮造成的线粒体功能紊乱还不清楚,值得进一步研究,为apelin成为治疗PD的潜在临床药物提供新的证据。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Forman MS, Trojanowski JQ, Lee VM. Neurodegenerative diseases: A decade of discoveries paves the way for therapeutic breakthroughs[J]. Nat Med, 2004, 10(10): 1055-1063. DOI:10.1038/nm1113 |
| [2] |
Song JX, Lu JH, Liu LF, et al. HMGB1 is involved in autophagy inhibition caused by SNCA/alpha-synuclein overexpression: a process modulated by the natural autophagy inducer corynoxine B[J]. Autophagy, 2014, 10(1): 144-154. DOI:10.4161/auto.26751 |
| [3] |
Katila N, Bhurtel S, Park PH, et al. Metformin attenuates rotenone-induced oxidative stress and mitochondrial damage via the AKT/Nrf2 pathway[J]. Neurochem Int, 2021, 148: 105120. DOI:10.1016/j.neuint.2021.105120 |
| [4] |
Bose A, Beal MF. Mitochondrial dysfunction in Parkinson's disease[J]. J Neurochem, 2016, 139(1): 216-231. DOI:10.1111/jnc.13731 |
| [5] |
Martinez TN, Greenamyre JT. Toxin models of mitochondrial dysfunction in Parkinson's disease[J]. Antioxid Redox Signal, 2012, 16(9): 920-934. DOI:10.1089/ars.2011.4033 |
| [6] |
Radad K, Al-Shraim M, Al-Emam A, et al. Rotenone: from modelling to implication in Parkinson's disease[J]. Folia Neuropathol, 2019, 57(4): 317-326. DOI:10.5114/fn.2019.89857 |
| [7] |
Angelopoulou E, Paudel YN, Bougea A, et al. Impact of the apelin/APJ axis in the pathogenesis of Parkinson's disease with therapeutic potential[J]. J Neurosci Res, 2021, 99(9): 2117-2133. DOI:10.1002/jnr.24895 |
| [8] |
Zhu J, Dou S, Jiang Y, et al. Apelin-36 exerts the cytoprotective effect against MPP+-induced cytotoxicity in SH-SY5Y cells through PI3K/Akt/mTOR autophagy pathway[J]. Life Sci, 2019, 224: 95-108. DOI:10.1016/j.lfs.2019.03.047 |
| [9] |
Chen QY, Kirk K, Shurubor YI, et al. Rewiring of glutamine metabolism is a bioenergetic adaptation of human cells with mitochondrial DNA mutations[J]. Cell Metab, 2018, 27(5): 1007-1025. DOI:10.1016/j.cmet.2018.03.002 |
| [10] |
Xie H, Hu H, Chang M, et al. Identification of chaperones in a MPP+-induced and ATRA/TPA-differentiated SH-SY5Y cell PD model[J]. Am J Transl Res, 2016, 8(12): 5659-5671. |
| [11] |
Malpartida AB, Williamson M, Narendra DP, et al. Mitochondrial dysfunction and mitophagy in parkinson's disease: From mechanism to therapy[J]. Trends Biochem Sci, 2021, 46(4): 329-343. DOI:10.1016/j.tibs.2020.11.007 |
| [12] |
Navarro A, Boveris A. Brain mitochondrial dysfunction and oxidative damage in Parkinson's disease[J]. J Bioenerg Biomembr, 2009, 41(6): 517-521. DOI:10.1007/s10863-009-9250-6 |
| [13] |
Chittenden T, Harrington EA, O'Connor R, et al. Induction of apoptosis by the Bcl-2 homologue Bak[J]. Nature, 1995, 374(6524): 733-736. DOI:10.1038/374733a0 |
| [14] |
Li B, Chauvin C, De Paulis D, et al. Inhibition of complex Ⅰ regulates the mitochondrial permeability transition through a phosphate-sensitive inhibitory site masked by cyclophilin D[J]. Biochim Biophys Acta, 2012, 1817(9): 1628-1634. DOI:10.1016/j.bbabio.2012.05.011 |
| [15] |
Xiong YJ, Song YZ, Zhu Y, et al. Neuroprotective effects of olanzapine against rotenone-induced toxicity in PC12 cells[J]. Acta Pharmacol Sin, 2020, 41(4): 508-515. DOI:10.1038/s41401-020-0378-6 |



