2. 宿州市第一人民医院, 宿州 234000
2. First People's Hospital of Suzhou City, Suzhou 234000, China
脂肪肝(fatty liver, FL)动物模型在探索FL发病机制、筛选预防和治疗药物等方面具有重要作用。高脂饮食可诱导FL动物模型,实验动物的品系和性别、高脂饲料的成分和造模时间不同,复制的模型病变程度和病理类型也不同[1]。在相同的实验条件下,SD大鼠对高脂饮食更为敏感[2],雄性大鼠更容易发生肝细胞脂肪变性[3],但这种模型复制方法耗时较长,肝纤维化和炎症的变化较轻。注射CCl4复制FL模型简便、能快速引起FL,但其发病机制、病程演变及组织学改变与人类FL有很大不同。此外,高浓度CCl4毒性大,会造成早期和严重的肝细胞坏死、炎症和纤维化及动物高死亡率[4]。理想的FL动物模型应符合人类疾病的特点;病变有发展过程,与人的发病机制密切相关;形成率高,死亡率低,重复性好;模型复制方法简单易行[5-6]。本研究采用脂肪乳剂、30%白酒灌胃与皮下注射CCl4的复合造模方法成功制备了大鼠FL模型。现报道如下。
1 材料与方法 1.1 材料 1.1.1 动物健康雄性SD大鼠,SPF级,体质量(160±10)g,购于安徽省医学科学研究院,实验动物许可证号:SYK(皖)2019-008,实验前将大鼠在动物房正常饲养1周。所有动物实验符合伦理学要求。
1.1.2 试剂胆固醇、胆酸钠(上海西宝公司),白酒(安徽文王酿酒股份有限公司),四氯化碳(广东汕头市西陇化工厂),花生油(莱阳鲁花浓香花生油有限公司),吐温80(天津光复精细化工研究所),丙二醇(上海东姿化学试剂公司),ALT、AST试剂盒(南京建成生物工程研究所),HDL、LDL、TC、TG、FFA试剂盒(长春汇力生物技术有限公司)。
1.1.3 主要仪器BS-110S精密天平(北京塞多利斯天平有限公司),MP6001电子天平(上海恒平科学仪器有限公司),TDL-5型台式低速大容量离心机、TGL-16G型离心机(上海安亭科学仪器厂),752P紫外可见分光光度计(上海光谱仪器有限公司),HH-S2系列恒温水浴锅(常州市金坛区环宇科学仪器厂)。
1.2 方法 1.2.1 脂肪乳剂制备[7-8]取猪油25g置200ml烧杯内,磁力搅拌器上加热至100℃后加10g胆固醇充分混匀,加25ml吐温80,得油相。取20ml丙二醇、30ml纯化水置200ml烧杯内,磁力搅拌器加热至60℃,加2g胆酸钠,完全溶解后得水相。将水相加入油相,充分混匀,得脂肪乳剂,冷却至室温,14℃保存备用。临用前水浴融化,冷却至室温后灌胃。
1.2.2 模型制备大鼠随机分为正常对照组10只,模型组18只。模型组每日灌胃脂肪乳剂(1mL/100g)和30%白酒(1ml/100g),2次/周皮下注射40%CCl4花生油溶液(0.3ml/100g)。对照组灌胃等量纯化水,皮下注射等量生理盐水,方法同模型组。每周称重1次,根据体重变化调整剂量。
1.2.3 一般情况观察每日观察大鼠毛色、精神、进食和二便等情况。4周末,肉眼观察肝脏质地、颜色、边缘厚度及表面和切面光滑度;计算肝指数,肝指数=肝湿重/末次体重×100%。
1.2.4 肝脏病理观察第2周末、第3周末分别随机抽取模型组4只大鼠,第4周末抽取模型组剩余大鼠,肉眼观察肝脏变化,保留肝脏进行病理检查,将正常对照组作为模型组0周的数据,观察模型组动态变化过程。每只大鼠肝脏左叶相同部位取小块肝组织,10%甲醛溶液固定,常规石蜡包埋、切片,HE染色。光镜观察肝脏病理学变化,并评估脂肪变性程度[9]:重度(脂变肝细胞超过肝小叶2/3),中度(脂变肝细胞占肝小叶1/3~2/3),轻度(脂变肝细胞呈散在小灶分布),无(肝小叶结构完好,基本无脂变)。脂肝变超过1/3,提示FL模型制备成功。
1.2.5 血清生化指标检测4周末,隔夜禁食不禁水,水合氯醛麻醉后腹主动脉采血,3000rpm,离心15min,分离血清,-20℃保存。按照试剂盒说明书,分别采用赖氏法测定ALT、AST水平;直接法测定HDL水平;沉淀法测定LDL水平;4-AAP法测定TC、TG含量;酶比色法测定FFA含量。
1.2.6 肝组织TC、TG、FFA含量测定采血后,迅速取出肝脏,取每只大鼠相同部位肝组织1g,剪碎,4℃,3000rpm,匀浆1min,制备肝匀浆,加入氯仿∶甲醇(1 ∶1,V/V)提取脂质,静置12h,3000rpm,离心15min,取上清液,-20℃保存。根据试剂盒说明书检测肝脏TC、TG和FFA含量。
1.3 统计学方法采用SPSS 26.0进行统计分析。计量资料采用x±s表示,组间比较采用t检验。P < 0.05为差异有统计学意义。
2 结果 2.1 一般情况正常对照组毛色光滑,活动积极,精神振奋,食量和二便正常。造模初期,模型组出现厌食、活动减少、大便稀软,部分大鼠腹泻,随着试验进展逐渐消失;灌胃白酒后少数有嗜睡现象,数小时后逐渐清醒。造模后期,模型组毛色灰暗,无光泽,活动迟缓。
4周末,模型组体重明显低于正常对照组(P < 0.05)。肉眼观察,正常对照组肝脏颜色鲜红,有光泽,被膜光滑,边缘锐利,切面光洁;模型组肝脏明显肿胀,黄褐色,被膜致密,边缘钝,触之有油腻感(图 1)。肝指数与正常对照组相比有显著差异(P < 0.05)。见表 1。
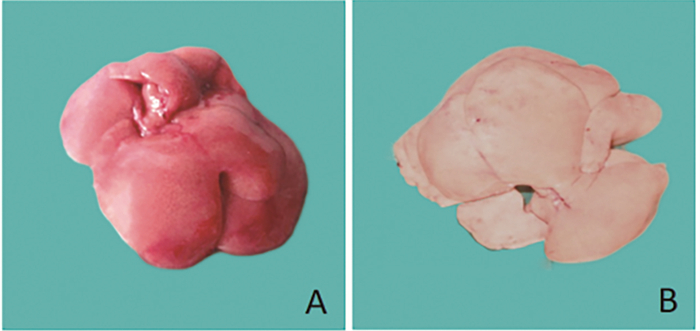
|
图 1 两组大鼠肝脏形态比较 注:A.正常对照组;B.模型组 |
| 表 1 两组大鼠肝指数比较(x±s) |
镜下观察,正常对照组肝细胞无脂肪变性,肝小叶结构清晰,细胞索排列整齐,肝窦正常,肝细胞无病变,细胞核结构清晰(图 2A)。模型复制2周末,脂肪颗粒增大、紧密相连,细胞核数量减少(图 2B);模型复制3周末,细胞核数量少,肝细胞体积增大,部分细胞内见空泡结构,脂变肝细胞占肝小叶1/3~1/2,达到轻度脂肪肝变性(图 2C);模型复制4周末,肝细胞结构大部分破坏,小叶边界不清,细胞索紊乱,大部分肝窦消失,肝细胞广泛脂肪变性,呈大泡状改变,由中央小静脉向周围逐渐扩散和延伸,细胞肿胀,细胞质疏松,含有较大脂肪滴,脂变肝细胞占肝小叶1/2~2/3(图 2D),提示第4周末模型组大鼠FL模型复制成功,中度脂肪肝占100%。
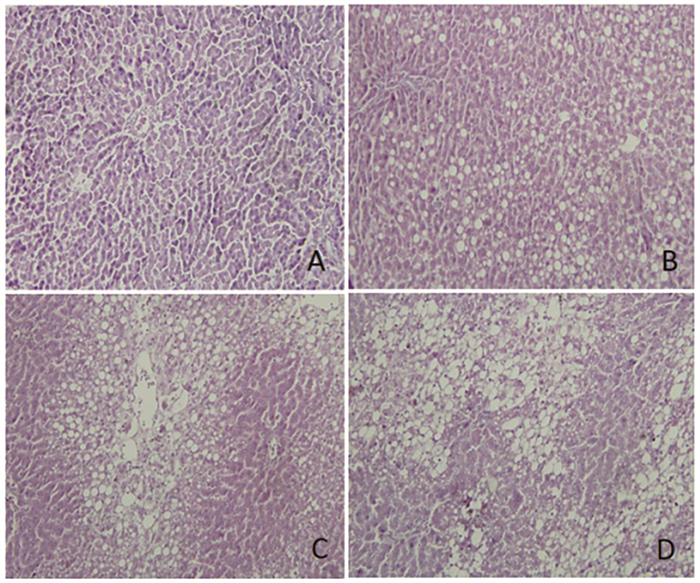
|
图 2 大鼠肝脏病理学动态变化过程(HE×100) 注:A.0周; B.2周; C.3周; D.4周 |
与正常对照组相比,模型组血清ALT、AST、LDL、TC、TG含量升高(P < 0.05),HDL含量降低(P < 0.05),FFA含量升高(P < 0.05)。见表 2。
| 表 2 两组大鼠血清生化指标比较(x±s) |
模型组肝组织中TC、TG和FFA含量高于正常对照组(P < 0.001)。见表 3。
| 表 3 两组大鼠组织TC、TG、FFA含量比较(x±s) |
我国FL的发病率呈逐年上升趋势,并呈现年轻化趋势。关于FL的相关研究报道也成为研究热点之一,而复制与人类FL发生、发展过程相似的FL动物模型更是其重要研究基础。本次研究我们采用灌胃适度浓度白酒和脂肪乳剂的方法接近我们日常生活中FL病程发展的实际情况,白酒灌胃可以掌握固定的酒精浓度,符合人类饮酒的方式;附加皮下注射适宜浓度的CCl4则有助于缩短动物模型复制周期。
本文结果显示模型组与对照组相比SD大鼠的体重、肝指数有显著性差异;血清中与脂肪代谢相关的指标ALT、AST、LDL、TC、TG含量显著升高,HDL含量显著降低,FFA含量显著升高;肝组织中TC、TG和FFA含量显著高于正常对照组;肝脏病理切片显示模型组大鼠在试验4周末出现肝细胞脂肪变性,肝脏脂变程度已达1/3,提示已经成功复制FL模型。
在前期多次预试验基础上,我们确定了每日灌胃脂肪乳剂(1ml/100g)和30%白酒(1ml/100g),2次/周皮下注射40%CCl4花生油溶液(0.3ml/100g)的配方具体用量。该方法复制的FL模型,成功率高,周期短,重复性好;模型符合人类FL病理演变的过程,灌胃脂肪乳剂和白酒接近人类日常饮食与饮酒导致的FL,注射适宜浓度的CCl4能够缩短常规方法模型复制周期。但脂肪乳剂较黏稠,灌胃时不宜抽取,这是复制模型的不利因素;关于CCl4浓度的高低对模型复制的影响以及本模型的发病机制有待于进一步深入研究。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Kucera O, Garnol T, Lotkova H, et al. The effect of rat strain, diet composition and feeding period on the development of a nutritional model of non-alcoholic fatty liver disease in rats[J]. Physiol Res, 2011, 60(2): 317-328. DOI:10.33549/physiolres.932022 |
| [2] |
Rosenstengel S, Stoeppeler S, Bahde R, et al. Type of steatosis influences microcirculation and fibrogenesis in different rat strains[J]. J Invest Surg, 2011, 24(6): 273-282. DOI:10.3109/08941939.2011.586094 |
| [3] |
Stoppeler S, Palmes D, Fehr M, et al. Gender and strain-specific differences in the development of steatosis in rats[J]. Lab Anim, 2013, 47(1): 43-52. DOI:10.1177/0023677212473717 |
| [4] |
敬梦辉, 蒋元烨, 范伏岗, 等. 非白酒性脂肪性肝病动物实验模型最新研究进展[J]. 现代中西医结合杂志, 2017, 26(18): 2049-2052. DOI:10.3969/j.issn.1008-8849.2017.18.040 |
| [5] |
Takahashi Y, Soejima Y, Fukusato T. Animal models of nonalcoholic fatty liver disease/nonalcoholic steatohepatitis[J]. World J Gastroenterol, 2012, iS(19): 2300-2308. DOI:10.3748/wjg.v18.i19.2300 |
| [6] |
黄海燕, 辛永宁, 姜曼, 等. 非白酒性脂肪性肝病动物实验模型研究进展[J]. 临床肝胆病杂志, 2014, 30(9): 948-953. DOI:10.3969/j.issn.1001-5256.2014.09.028 |
| [7] |
倪鸿昌, 李俊, 金涌, 等. 大鼠实验性高脂血症和高脂血症性脂肪肝模型研究[J]. 中国药理学通报, 2004, 20(6): 703-706. DOI:10.3321/j.issn:1001-1978.2004.06.025 |
| [8] |
李寅超, 邓莉, 李承平, 等. 十二味穿甲片原料抗大鼠高脂性脂肪肝的作用[J]. 中国医院药学杂志, 2017, 37(15): 1463-1467. DOI:10.13286/j.cnki.chinhosppharmacyj.2017.15.10 |
| [9] |
Ye X, Yang B, Zhu W, et al. Six-year pilot study on nucleic acid testing for blood donations in China[J]. Transfus Apher Sci, 2013, 49(2): 318-322. DOI:10.1016/j.transci.2013.08.005 |

