2. 济宁医学院附属医院, 济宁 272029
2. Affiliated Hospital of Jining Medical University, Jining 272029, China
线粒体是细胞内产生能量的主要场所,通过氧化磷酸化产生三磷酸腺苷,同时也产生活性氧簇(reactive oxygen species,ROS),维持线粒体稳态即线粒体质量控制包括线粒体融合、分裂、自噬等,其中自噬作为细胞高选择性移除功能障碍或剩余线粒体的途径之一对细胞的正常生理功能至关重要。有两种不同的线粒体自噬途径,分别是PINK1/Parkin途径和受体介导的途径[1]。后者以受体BNIP3、NIX /BNIP3L、含FUN14域蛋白1(FUN14 domain containing 1,FUNDC1)和PHB2(Prohibitin 2)与微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3,LC3)相互作用介导自噬[2]。线粒体自噬的失调导致癌症、神经退行性疾病(如帕金森病)、肌肉萎缩、衰老、糖尿病和心力衰竭等多种疾病的发生[3]。因此,对线粒体自噬调控机制的解读,为我们更好地研究相关疾病的发病机制奠定了基础。本文就FUNDC1介导线粒体自噬的机制以及与相关疾病的关系做一综述。
1 FUNDC1结构与功能FUNDC1蛋白由155个氨基酸构成,是哺乳动物细胞中介导线粒体自噬的一种新型线粒体膜蛋白,其包含3个高疏水性的斜螺旋延伸跨膜结构域和LC3相互作用区(LC3-interacting region,LIR),其N端位于细胞质中,C端位于线粒体内外膜间隙中[2](见图 1)。FUNDC1是一种高度保守的蛋白,其同源蛋白从低级的细菌酵母菌到高级灵长类动物中均可见[4]。内源性FUNDC1仅定位于线粒体外膜上,并在缺氧条件下被激活[2],而后通过信号级联反应介导线粒体自噬。LIR是一个短序列LC3结合区域:Y(18)xxL(21),通过在细胞质暴露的N端与LC3相互作用,可以与LC3和GABARAP(gamma-aminobutyric acid receptor-associated protein)家族的相关成员结合在自噬分离膜上;Y18和L21的突变或LIR的缺失会破坏FUNDC1与LC3的相互作用及其介导的线粒体自噬功能[2]。在正常情况下,FUNDC1在Y18被肉瘤基因(Sarcoma gene,Src)激酶磷酸化,在S13被肌酸激酶2(creatine kinase 2,CK2)磷酸化形成p-FUNDC1(非活性形式)抑制线粒体自噬。而在低氧条件下相关残基去磷酸化,从而使FUNDC1可以与LC3相互作用[2, 5]。这说明FUNDC1蛋白磷酸化/去磷酸化是线粒体自噬中重要的一环。
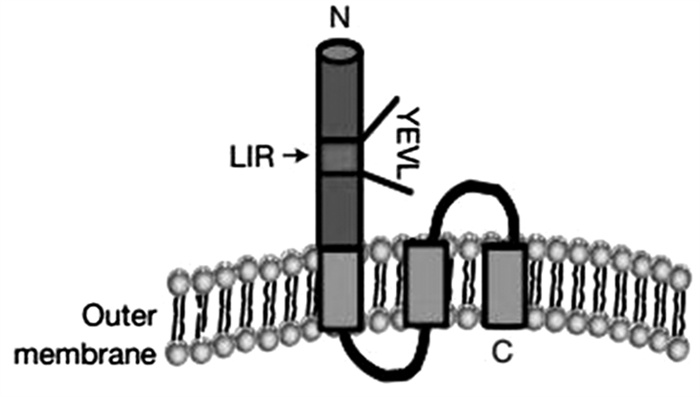
|
图 1 线粒体外膜FUNDC1蛋白的结构[5] |
FUNDC1在线粒体和内质网之间的界面MAMs上发挥其功能。MAMs汇集了关键的信号通路,这些信号通路有助于在细胞应激反应中在凋亡和自噬之间做出决定;它还通过吸收和释放通道的紧密耦合参与细胞器之间的钙转移。MAMs在线粒体分裂、凋亡和线粒体自噬中起重要作用。此外,在位于线粒体-内质网接触处存在一个电压依赖阴离子通道(voltage dependent anion channels,VDAC)、75kDa葡萄糖调节蛋白(GRP75)和肌醇1,4,5-三磷酸受体(inositol 1,4,5-trisphosphate receptor, IP3R)蛋白复合体,复合体介导Ca2+在内质网和线粒体之间的转移[6](见图 2)。FUNDC1与IP3R2受体相互作用,一方面可以促进MAMs的稳定,同时还可促进内质网Ca2+转移到线粒体和细胞质[7]。在缺血、缺氧引起的心肌疾病中,FUNDC1的增加促进MAMs的稳定,引起线粒体内Ca2+增加和线粒体裂变1蛋白(fisson1,Fis1)的表达增加,促进了线粒体自噬与分裂,并且FUNDC1的遗传缺失(FUNDC1 KO)会导致心功能障碍和心力衰竭[7]。Wu等[8]发现在小鼠糖尿病模型心肌细胞中FUNDC1水平升高,与IP3R2的结合增加MAMs形成,从而引起线粒体内Ca2+增加与Fis1的表达增加,导致线粒体功能障碍,进而损害了心肌结构与功能。在不同的疾病进展中,FUNDC1介导的病理机制也不尽相同。FUNDC1是否通过调控IP3R2表达或降解来促进MAMs的形成,这一点还有待于进一步研究证实。
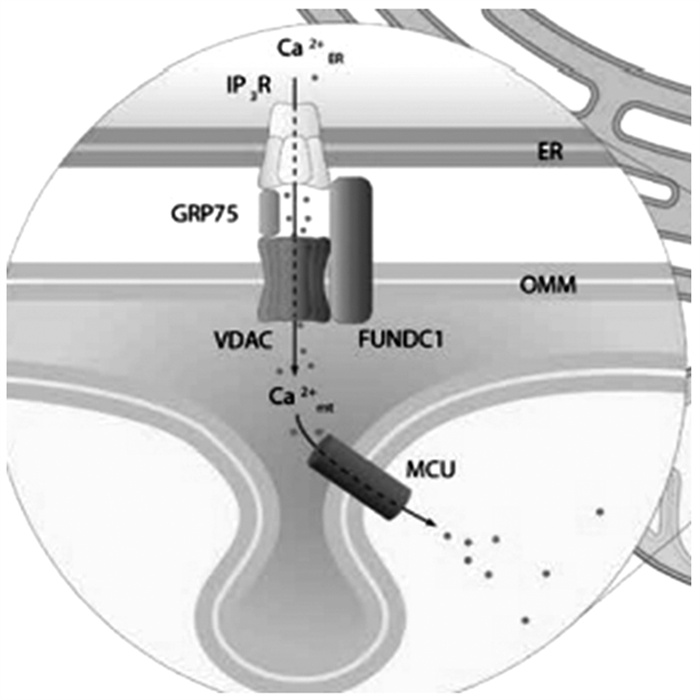
|
图 2 线粒体相关内质网膜[6] 注:MCU,线粒体钙单向转运体;OMM,线粒体外膜 |
unc-51样激酶1(unc-51 like kinase 1,ULK1)参与了细胞自噬的诱导,但其具体作用机制仍不清楚。ULK1也参与了FUNDC1受体介导的线粒体自噬。ULK1是激活FUNDC1的一种调控方式,它是自噬的关键调节因子,通过Ser17位点磷酸化激活FUNDC1[2]。在低氧处理的大鼠嗜铬细胞瘤PC-12细胞中,ULK1的mRNA和蛋白水平显著提高,并明显上调了FUNDC1的表达,提示低氧促进了细胞线粒体自噬[9]。ULK1是由腺苷酸活化蛋白激酶(AMP-activated protein kinase,AMPK)控制的,在低氧条件下,AMPK能磷酸化ULK1 S555,导致转位复合物转到线粒体,并磷酸化FUNDC1[10]。ULK1在线粒体自噬过程中是引导溶酶体进入线粒体所必需的。细胞磷酸化蛋白质组分析和质谱分析表明,FUNDC1 Ser17是一个潜在的磷酸化位点。ULK1的异位表达显著增强了FUNDC1的Ser17磷酸化,而敲除ULK1则显著抑制了FUNDC1的Ser17磷酸化[11]。ULK1在Ser17位点磷酸化FUNDC1并相互作用,促进FUNDC1与LC3的结合,增强线粒体自噬。这是连接自噬小体和线粒体片段的重要过程。综上所述,FUNDC1可以将ULK1招募到功能失调的线粒体中,ULK1通过Ser17位点磷酸化激活FUNDC1,以加速线粒体自噬。
2.2.2 蛋白激酶Src与FUNDC1Src激酶是一种酪氨酸激酶和调节蛋白,在细胞生长、分化、增殖和存活中起关键作用。位于线粒体的Src激酶可能负责FUNDC1 Tyr18位点的磷酸化。在生理条件下,活化的Src激酶磷酸化Tyr18抑制FUNDC1介导的线粒体自噬。此外,由于磷酸化的FUNDC1可能会与LC3的疏水囊发生冲突,从而消除其与LC3的结合亲和性,因此,LC3优先与去磷酸化的FUNDC1相互作用[2]。在低氧条件下,失活的Src激酶引起FUNDC1去磷酸化诱导自噬[2]。低氧下,FUNDC1通过去磷酸化进行构象修饰,这可能会减弱LC3相互作用的空间干扰,导致FUNDC1与LC3-II的共定位。综上所述,Src激酶在生理条件下磷酸化FUNDC1的Tyr18可抑制FUNDC1介导的自噬。相反,低氧条件下去磷酸化的FUNDC1和失活的Src激酶导致FUNDC1和LC3-II之间的相互作用和共定位显著增加,促使线粒体自噬的发生。这些发现对线粒体外膜蛋白FUNDC1如何调控自噬,以及Src激酶是如何调控FUNDC1介导的线粒体自噬提供了最新的见解。
2.3 FUNDC1去磷酸化 2.3.1 PGAM5与FUNDC1磷酸甘油变位酶家族蛋白5(phosphoglycerate mutase family member 5,PGAM5)作为线粒体Ser/Thr磷酸酶,参与调节线粒体内稳态的多个过程[12]。PGAM5被线粒体膜电位缺失激活,可能与PINK1激酶同时触发线粒体自噬,它通过Ser13位点去磷酸化激活FUNDC1[13],去磷酸化的FUNDC1对LC3有明显更高的亲和力,从而导致FUNDC1和LC3相互作用,导致选择性的自噬结合和随后受影响的线粒体的自噬移除[2, 5]。PGAM5对FUNDC1的去磷酸作用可以通过CK2磷酸化FUNDC1来逆转。PGAM5和CK2组成的调节回路将线粒体应激信号与FUNDC1的磷酸化/去磷酸化连接起来,从而调节线粒体自噬。
2.3.2 BCL2L1与FUNDC1BCL2家族控制线粒体凋亡、线粒体自噬和线粒体稳态[14]。PGAM5的激活与抗凋亡蛋白Bcl2 Like 1(BCL2L1)密切相关。在正常条件下,BCL2L1通过BH3结构域与PGAM5相互作用,抑制PGAM5的激活,进而阻止Ser13去磷酸化[15]。在低氧条件下,BCL2L1降解,PGAM5释放,促进Ser13去磷酸化,从而启动FUNDC1介导的自噬。因此,BCL2L1-PGAM5-FUNDC1轴在响应低氧诱导的自噬中起关键作用。在多种病理生理条件下,细胞如何感知外界刺激来调节FUNDC1的去磷酸化状态将是未来研究的重点。在不同人群中可能存在PGAM5/BCL2L1基因多态性,该基因多态性将是未来基因治疗的关键。
3 FUNDC1与疾病 3.1 癌症癌症是由癌细胞恶性增殖所致,癌细胞的代谢重编程发生异常[16]。线粒体作为代谢重编程的主要细胞器参与了癌症的发生与发展过程。FUNDC1在癌症中的作用尚未得到充分的研究。近年来,乳腺癌的发病率位列女性恶性肿瘤之首,成为威胁女性健康的重要因素[17]。FUNDC1作为一种新发现的线粒体自噬蛋白,其在乳腺癌中的表达模式和功能尚不清楚。相关研究探索了FUNDC1在乳腺癌组织中的表达谱[18-21],数据显示,FUNDC1在乳腺癌组织中的表达明显高于正常乳腺上皮组织;FUNDC1 mRNA水平升高与乳腺癌患者生存期呈负相关;FUNDC1蛋白在乳腺癌组织中的表达水平分别与肿瘤大小、转移和死亡呈正相关;FUNDC1水平高的乳腺癌患者预后较差,这表明FUNDC1相关表达水平的上调可能增强了乳腺癌细胞的增殖、迁移和侵袭。同时有研究表明FUNDC1可能通过与浸润的免疫细胞相互作用来影响癌症患者的预后[22]。在FUNDC1高表达的癌症中,脑癌、皮肤癌、肝癌预后较差,肺癌、卵巢癌、肾癌、甲状腺癌预后较好[22]。FUNDC1参与了癌症的发病、进展和预后,FUNDC1可能是癌症治疗的一个有前景的生物标志物和靶点。
3.2 心血管疾病线粒体功能障碍与各种心血管疾病的发生和发展密切相关。研究表明,在病理条件下,FUNDC1在维持心血管细胞稳态方面发挥着重要作用[3, 23-24]。心肌细胞含有大量线粒体,约占心肌总体积的30%~40%,成人心脏每天通过线粒体氧化磷酸化系统消耗大量ATP来支持心脏功能。Zhou等[25]报道在急性心肌缺血-再灌注后CK2水平以时间依赖性的方式升高,导致线粒体损伤和心功能障碍。功能分析显示,CK2的增加上调了磷酸化的FUNDC1的表达,同时这一结果还伴随着线粒体自噬停止和心肌细胞线粒体功能障碍。敲除CK2可恢复FUNDC1介导的自噬,从而形成保护线粒体和心脏免受缺-再灌注损伤。心肌细胞和血小板在缺血-再灌注期间均检测到自噬。在低氧处理和缺血-再灌注小鼠中血小板总FUNDC1和Tyr18位磷酸化FUNDC1的水平均降低,提示Tyr18位磷酸化FUNDC1可能与缺血-再灌注的发病机制有关[26]。另外FUNDC1介导的线粒体自噬可以调节血小板活化及细胞凋亡,促进血小板活化,增加血小板聚集、黏附分子的表达和微血栓的形成[27]。总之,FUNDC1介导的线粒体自噬与心血管疾病的发生密切相关,未来FUNDC1可成为心血管疾病的治疗靶点之一。
3.3 眼部疾病糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病常见的一种特殊的微血管并发症。目前在DR中线粒体自噬的研究尚少。由于DR和视网膜脱离病理机制均包括视网膜缺血缺氧,并且研究表明在大鼠视网膜脱离模型中,脯氨酰羟化酶抑制剂可通过稳定缺氧诱导因子-1a(hypoxia inducible factor-1a,HIF-1a)增强FUNDC1介导的线粒体自噬,减少因ROS过量引起的光感受器细胞损伤[28]。这提示在视网膜中FUNDC1介导的线粒体自噬极有可能也参与DR的发病。目前眼科疾病中FUNDC1介导的线粒体自噬的研究尚少,其机制仍需深入探讨。FUNDC1介导线粒体自噬的干预可能为眼科疾病的治疗提供一种新的策略。
4 小结与展望线粒体自噬与人体细胞稳态的维持和疾病息息相关,密不可分。FUNDC1介导的线粒体自噬可选择性地清除功能障碍的线粒体,进而减少对细胞和组织的损伤,在疾病的发生发展中起重要作用。尽管FUNDC1介导的线粒体自噬在许多线粒体相关疾病中的作用正在显现,但阐明这些复杂的病理生理过程并将分子信息转化为医学仍有很长的路要走。鉴于不同的疾病条件下可能存在不同的应激信号,因此,有必要确定具体的上游信号分子,特别是发病机制中的蛋白激酶和磷酸酶。
未来在细胞和分子水平上对FUNDC1机制的研究将有助于阐明FUNDC1的作用,更加深入了解线粒体自噬的调控机制,掌握其在相关疾病中的作用,将为疾病的治疗提供一种新的方法。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Park SY, Koh HC. FUNDC1 regulates receptor-mediated mitophagy independently of the PINK1/Parkin-dependent pathway in rotenone-treated SH-SY5Y cells[J]. Food Chem Toxicol, 2020, 137: 111163. DOI:10.1016/j.fct.2020.111163 |
| [2] |
Liu L, Feng D, Chen G, et al. Mitochondrial outer-membrane protein FUNDC1 mediates hypoxia-induced mitophagy in mammalian cells[J]. Nat Cell Biol, 2012, 14(2): 177-185. DOI:10.1038/ncb2422 |
| [3] |
Ren J, Sun M, Zhou H, et al. FUNDC1 interacts with FBXL2 to govern mitochondrial integrity and cardiac function through an IP3R3-dependent manner in obesity[J]. Sci Adv, 2020, 6(38): eabc8561. DOI:10.1126/sciadv.abc8561 |
| [4] |
Mao C, Hu C, Zhou Y, et al. Electroacupuncture pretreatment against cerebral ischemia/reperfusion injury through mitophagy[J]. Evid Based Complement Alternat Med, 2020, 2020: 7486041. DOI:10.1155/2020/7486041 |
| [5] |
Chen G, Han Z, Feng D, et al. A regulatory signaling loop comprising the PGAM5 phosphatase and CK2 controls receptor-mediated mitophagy[J]. Mol Cell, 2014, 54(3): 362-377. DOI:10.1016/j.molcel.2014.02.034 |
| [6] |
Munoz J P, Zorzano A. FUNDC1:A Novel protein in cardiac health[J]. Circulation, 2017, 136(23): 2267-2270. DOI:10.1161/CIRCULATIONAHA.117.031417 |
| [7] |
Wu S, Lu Q, Wang Q, et al. Binding of FUN14 domain containing 1 with inositol 1, 4, 5-trisphosphate receptor in mitochondria-associated endoplasmic reticulum membranes maintains mitochondrial dynamics and function in hearts in vivo[J]. Circulation, 2017, 136(23): 2248-2266. DOI:10.1161/CIRCULATIONAHA.117.030235 |
| [8] |
Wu S, Lu Q, Ding Y, et al. Hyperglycemia-driven inhibition of AMP-activated protein kinase alpha2 induces diabetic cardiomyopathy by promoting mitochondria-associated endoplasmic reticulum membranes in vivo[J]. Circulation, 2019, 139(16): 1913-1936. DOI:10.1161/CIRCULATIONAHA.118.033552 |
| [9] |
Wang L, Wang P, Dong H, et al. Ulk1/FUNDC1 prevents nerve cells from hypoxia-induced apoptosis by promoting cell autophagy[J]. Neurochem Res, 2018, 43(8): 1539-1548. DOI:10.1007/s11064-018-2568-x |
| [10] |
Tian W, Li W, Chen Y, et al. Phosphorylation of ULK1 by AMPK regulates translocation of ULK1 to mitochondria and mitophagy[J]. FEBS Lett, 2015, 589(15): 1847-1854. DOI:10.1016/j.febslet.2015.05.020 |
| [11] |
Wu W, Tian W, Hu Z, et al. ULK1 translocates to mitochondria and phosphorylates FUNDC1 to regulate mitophagy[J]. EMBO Rep, 2014, 15(5): 566-575. DOI:10.1002/embr.201438501 |
| [12] |
Ma K, Zhang Z, Chang R, et al. Dynamic PGAM5 multimers dephosphorylate BCL-xL or FUNDC1 to regulate mitochondrial and cellular fate[J]. Cell Death Differ, 2020, 27(3): 1036-1051. DOI:10.1038/s41418-019-0396-4 |
| [13] |
van der Bliek AM. Mitochondria just wanna have FUN(DC1)[J]. EMBO J, 2016, 35(13): 1365-1367. DOI:10.15252/embj.201694759 |
| [14] |
Lee KH, Kang TB. The molecular links between cell death and inflammasome[J]. Cells, 2019, 8(9): 1057. DOI:10.3390/cells8091057 |
| [15] |
Murakawa T, Yamaguchi O, Hashimoto A, et al. Bcl-2-like protein 13 is a mammalian Atg32 homologue that mediates mitophagy and mitochondrial fragmentation[J]. Nat Commun, 2015, 66: 7527. DOI:10.1038/ncomms8527 |
| [16] |
赵梓圳, 付爱玲. 线粒体治疗: 一种新型的线粒体相关疾病的生物疗法[J]. 生物工程学报, 2021, 37(4): 1168-1177. DOI:10.13345/j.cjb.200383 |
| [17] |
秦瑞, 张仁亚. 易误诊为恶性肿瘤的乳腺良性病变[J]. 济宁医学院学报, 2019, 42(5): 321-326. DOI:10.3969/j.issn.1000-9760.2019.05.004 |
| [18] |
Wu L, Zhang D, Zhou L, et al. FUN14 domain-containing 1 promotes breast cancer proliferation and migration by activating calcium-NFATC1-BMI1 axis[J]. EBio Medicine, 2019, 41: 384-394. DOI:10.1016/j.ebiom.2019.02.032 |
| [19] |
Yuan Q, Sun N, Zheng J, et al. Prognostic and immunological role of FUN14 domain containing 1 in pan-cancer: friend or foe?[J]. Front Oncol, 2019, 9: 1502. DOI:10.3389/fonc.2019.01502 |
| [20] |
Hui L, Wu H, Wang TW, et al. Hydrogen peroxide-induced mitophagy contributes to laryngeal cancer cells survival via the upregulation of FUNDC1[J]. Clin Transl Oncol, 2019, 21(5): 596-606. DOI:10.1007/s12094-018-1958-5 |
| [21] |
Roperto S, Russo V, De Falco F, et al. FUNDC1-mediated mitophagy in bovine papillomavirus-infected urothelial cells[J]. Vet Microbiol, 2019, 234: 51-60. DOI:10.1016/j.vetmic.2019.05.017 |
| [22] |
Wu H, Wang Y, Li W, et al. Deficiency of mitophagy receptor FUNDC1 impairs mitochondrial quality and aggravates dietary-induced obesity and metabolic syndrome[J]. Autophagy, 2019, 15(11): 1882-1898. DOI:10.1080/15548627.2019.1596482 |
| [23] |
Wang J, Zhu P, Li R, et al. Fundc1-dependent mitophagy is obligatory to ischemic preconditioning-conferred renoprotection in ischemic AKI via suppression of Drp1-mediated mitochondrial fission[J]. Redox Biol, 2020, 30: 101415. DOI:10.1016/j.redox.2019.101415 |
| [24] |
Xiao Y, Chen W, Zhong Z, et al. Electroacupuncture preconditioning attenuates myocardial ischemia-reperfusion injury by inhibiting mitophagy mediated by the mTORC1-ULK1-FUNDC1 pathway[J]. Biomed Pharmacother, 2020, 127: 110148. DOI:10.1016/j.biopha.2020.110148 |
| [25] |
Zhou H, Zhu P, Guo J, et al. Ripk3 induces mitochondrial apoptosis via inhibition of FUNDC1 mitophagy in cardiac IR injury[J]. Redox Biol, 2017, 13: 498-507. DOI:10.1016/j.redox.2017.07.007 |
| [26] |
Zhang W, Siraj S, Zhang R, et al. Mitophagy receptor FUNDC1 regulates mitochondrial homeostasis and protects the heart from I/R injury[J]. Autophagy, 2017, 13(6): 1080-1081. DOI:10.1080/15548627.2017.1300224 |
| [27] |
Zhou H, Li D, Zhu P, et al. Melatonin suppresses platelet activation and function against cardiac ischemia/reperfusion injury via PPARgamma/FUNDC1/mitophagy pathways[J]. J Pineal Res, 2017, 63(4). DOI:10.1111/jpi.12438 |
| [28] |
Hui L, Wu H, Wang T W, et al. Hydrogen peroxide-induced mitophagy contributes to laryngeal cancer cells survival via the upregulation of FUNDC1[J]. Clin Transl Oncol, 2019, 21(5): 596-606. DOI:10.1007/s12094-018-1958-5 |



