2. 济宁医学院附属医院, 济宁 272029
2. Affiliated Hospital of Jining Medical University, Jining 272029, China
因纳米材料具有较好的韧性[1]和较低的熔点,故许多纳米粒子,包括金[2]、银[3-4]、铂[5]都得到了广泛研究。在生命科学领域,基于纳米金良好的生物相容性使得纳米金可以作为体外成像的对比剂[6-7],从而应用于体外成像。基于纳米金与蛋白质相互作用[8],可以用于光热疗法[9-10],从而达到体内治疗的目的。另外,纳米金可应用于癌症的诊断和治疗[11-14]。
蛋白质是一切生命的物质基础,生物体内各种化学反应都离不开蛋白质的参与[15]。牛血清白蛋白(bovine serum albumin, BSA)是牛肝细胞中合成的蛋白,其可与多种内源性和外源性物质结合[16-17]。
本文以球形纳米金与BSA作为研究对象,运用光谱、色谱等技术研究两者的相互作用,为金纳米材料在生物医学等领域的应用提供理论基础。
1 材料与方法 1.1 材料二水合柠檬酸三钠(Na3C6H5O7·2H2O, 天津市博迪化工有限公司);氯金酸(HAuCl4, 国药集团化学试剂有限公司);抗坏血酸(北京百灵威科技有限公司);硼氢化钠(NaBH4, 纯度98%, Alfa公司);溴代十六烷基三甲胺铵(CTAB, C19H42NBr, 纯度99%, 北京欣科中晶生物科技有限公司);BSA(纯度99%, Mw=66.0kg·mol-1, 北京欣科中晶生物科技有限公司);羟甲基氨基甲烷(Tris, Alfa公司);BSA溶液在4℃冰箱中保存;试验中所用的水均为三次去离子水。
电子天平(EL 204, 梅特勒-托利多仪器有限公司,上海),紫外分光光度计(岛津UV-2501PC, 日本),荧光光度计(日立F-4600, 带恒温样品支架,型号为250-0346, 日本),德国艾本德可调移液器,优普系列超纯水器(UPD-II-10T, 四川)。
1.2 方法 1.2.1 球形纳米金的制备将20mL氯金酸(2.5×10-4mol·L-1) 和柠檬酸三钠(2.5×10-4mol·L-1) 在烧杯中混合。然后,边搅拌边加入0.6mL 0.1mol·L-1的NaBH4溶液,此后混合溶液立刻变为粉红色,表明形成了金种子。在2~5h内此溶液可用作种子溶液。在此实验中柠檬酸盐用作封端剂,得到的金种子直径为3.5nm。
金纳米制备采用三步种子法。将3个试管分别标记A、B、C,每个试管中都含有9.0mL 2.5×10-4mol·L-1 HAuCl4和0.1mol·L-1 CTAB生长液。在每个试管中都加入0.05mL 0.1mol·L-1的抗坏血酸溶液。然后,将1.0mL金种子溶液与样品A混合。A溶液颜色在2~3min内变红。4~5h后,从试管A中取出1.0mL溶液加入试管B中,然后混合均匀。溶液B在4~5min内呈红色。4~5h后,从试管B中取出1.0mL溶液加入试管C中,然后混合均匀。溶液在10min内呈红色,所得溶液即为球形纳米金。
1.2.2 紫外光谱测定利用紫外分光光度计,在200nm到900nm的扫描范围内,以1200nm/min的速度来测定溶液吸光度。固定比色皿中BSA的浓度为0.13μmol·L-1,改变球形纳米金的浓度依次为:0、0.83×10-5、2.50×10-5、4.17×10-5、5.83×10-5、7.50×10-5和9.17×10-5mol·L-1, 测定两者相互作用的紫外光谱图。
1.2.3 荧光光谱测定利用荧光分光光度计,激发波长为280nm,相对应扫描波段为300nm到500nm,发射和激发狭缝的宽度均设定为5nm。固定比色皿中BSA溶液的浓度为0.13μmol·L-1,球形纳米金的浓度同1.2.2,测定两者相互作用的光谱图。
1.2.4 变温荧光光谱测定变温荧光是测定球形纳米金与BSA结合能力大小的有效方法,本实验利用荧光分光光度计,测定了当激发波长为280nm时,球形纳米金与BSA在298K、303K、308K时的荧光强度,其中BSA的浓度为0.13μmol·L-1,球形纳米金的浓度同1.2.2,测定两者相互作用的光谱图。
1.2.5 圆二色谱测定实验所用仪器为J-810圆二色谱仪(日本),此仪器带有程序控温系统控制的Jasco温控仪,光源系统用氮气保护(流量为5L·min-1),扫描速率为100nm·min-1,扫描波段为220~320nm,扫描结果是此范围内的二次平均值,并且以千分度(mdeg) 表示。
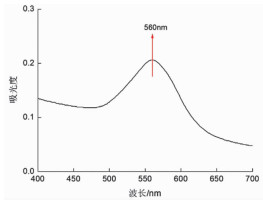
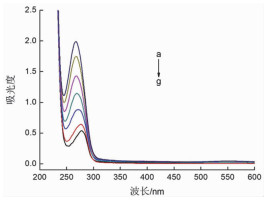
2 结果与讨论 2.1 球形纳米金与BSA相互作用的紫外光谱分析金属粒子在紫外可见光区有吸收带或者吸收区,这是由于等离子共振激发或者带间跃迁形成的吸收[18]。球形纳米金在560nm处有最大吸收峰(图 1)。空白BSA溶液的吸收峰在280nm左右,随着不同浓度球形纳米金溶液的加入,BSA的紫外吸收强度随之有规律地递增,即随着球形纳米金浓度的增加,BSA的溶液发生了增色效应,且其特征吸收峰由278nm蓝移到了268nm,此结果表明,球形纳米金与BSA发生了相互作用。见图 2。
|
图 1 球形纳米金的紫外吸收光谱图 |
|
图 2 球形纳米金与BSA相互作用的紫外可见吸收光谱图 注:从(a)到(g)球形纳米金的浓度依次为0.0、8.3、25.0、41.7、58.3、75.0、91.7μM |
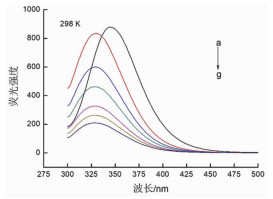
在BSA分子中,存在3个固有的荧光残基:色氨酸(Trp)、酪氨酸(Tyr) 和苯丙氨酸(Phe),BSA与其他物质相互作用而导致其荧光强度降低的现象称为荧光猝灭。随着溶液中球形纳米金浓度的增加,BSA的荧光强度不断降低,荧光峰逐渐蓝移(向左移动了约15nm),说明球形纳米金与BSA发生了相互作用,这种作用可能引起BSA中荧光发色团的微环境及蛋白质分子构象行为的变化(图 3)。结合紫外光谱图,可以得知球形纳米金不仅与BSA发生相互作用,还使其结构发生了变化。
|
图 3 球形纳米金与BSA相互作用的荧光光谱图 |
为了更好地理解球形纳米金与BSA的相互作用机理,本实验开展了298K、303K、308K的变温荧光实验。荧光猝灭机理通常分为静态猝灭和动态猝灭,动态猝灭遵循Stern-Volmer方程[19]:
| $ {\mathit{F}_0}/\mathit{F} = 1 + {\mathit{K}_{{\rm{sv}}}}[\mathit{Q}] = 1 + {\mathit{K}_{\rm{q}}}{\mathit{\tau }_0}[\mathit{Q}] $ | (1) |
其中:F0和F分别表示不存在和存在猝灭剂物质的荧光强度;[Q]为猝灭剂的浓度;Ksv是动态猝灭常数;Kq为猝灭速率常数;τ0为没有猝灭剂存在下荧光分子平均寿命,生物大分子荧光寿命约为10-8s。而静态猝灭过程遵循下式:
| $ {\mathit{F}_0}/\mathit{F} = 1 + {\mathit{K}_{\rm{s}}}[\mathit{Q}] $ | (2) |
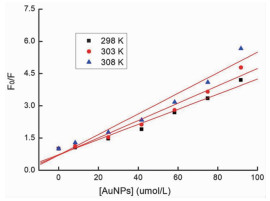
式中,Ks是静态猝灭常数。随温度升高,动态猝灭常数会增大,而静态猝灭常数随之减小,可由此判断荧光猝灭类型。也可以通过比较Kq值来区分,如果Kq值大于生物大分子的最大扩散碰撞猝灭常数(2.0×1010 L·mol-1·s-1),则静态猝灭为主要作用机理,反之,则为动态猝灭。通过F0/F作图(见图 4),可以确定Ksv的数值(见表 1),如表所示,Ksv的值均随着温度上升而增大,但由于Kq均远大于2.0×1010 L·mol-1·s-1,说明球形金纳米对BSA的荧光猝灭以静态猝灭为主。
|
图 4 不同温度下球形纳米金对BSA猝灭的Stern-Volmer方程图 |
| 表 1 不同温度下球形纳米金与BSA相互作用的猝灭常数 |
荧光猝灭是猝灭剂和荧光物质激发态分子的相互作用过程,为了更好地理解球形纳米金与BSA相互作用的机理,还分析了荧光强度与猝灭剂之间的关系。对于静态猝灭来说,可以用方程Double-logarithm(公式3)来探讨。
| $ {\rm{log}}\frac{{{\mathit{F}_0} - \mathit{F}}}{\mathit{F}} = {\rm{log}}{\mathit{K}_{\rm{a}}} + \mathit{n}{\rm{log}}[\mathit{Q}] $ | (3) |
式中F和F0分别为有无球形纳米金存在时牛血清白蛋白溶液的荧光强度,[Q]为球形纳米金的浓度。以log(F0-F)/F对log[Q]作图,由图 5的直线斜率和截距可求出球形纳米金与BSA分子的Hill常数n和平衡常数Ka,见表 2。由数据可知,随着温度的升高,结合常数和n均减小,也就是说随着温度的升高,BSA与球形纳米金的结合能力降低。分子间的作用力包括氢键,范德华力,静电引力,疏水作用力等。当温度变化不大时,反应的焓变ΔH可认为是常数。由热力学公式(4, 5)可以计算出不同温度下球形纳米金和BSA相互作用的热力学参数,见表 3。由ΔG < 0可知两者之间的相互作用是自发进行的。另外,ΔH < 0和ΔS < 0,根据Ross等[20]总结的热力学规律可推断出球形纳米金与BSA之间的主要作用力是氢键和范德华力。
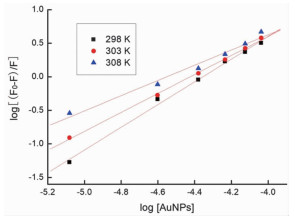
|
图 5 不同温度下球形纳米金对BSA猝灭的双倒数方程图 |
| 表 2 在不同温度下球形纳米金与BSA的结合常数和Hill常数 |
| 表 3 球形纳米金与BSA相互作用的热力学参数 |
| $ {\rm{ln}}(\frac{{{\mathit{K}_2}}}{{{\mathit{K}_1}}}) = \frac{{\Delta \mathit{H}}}{{\rm{R}}}(\frac{1}{{{\mathit{T}_1}}} - \frac{1}{{{\mathit{T}_2}}}) $ | (4) |
| $ \Delta \mathit{G} = \Delta \mathit{H} - \mathit{T}\Delta \mathit{S} = - \mathit{RTlnK} $ | (5) |
球形纳米金与BSA相互作用后,峰位a(λex=λem) 为瑞利散射峰,其峰强度增加,峰位b(λex=2λem) 为二阶散射峰,其峰强度降低。峰1(λex=280.0nm, λem=351.5nm)为色氨酸和酪氨酸残基的特征峰,其强度降低。峰2(λex=225.0nm, λem=351.5nm)为多肽骨架的特征峰,其强度也发生了降低。此实验结果表明,球形纳米金与BSA之间确实发生了相互作用,并且纳米材料的存在改变了蛋白质的肽链结构。见图 6。
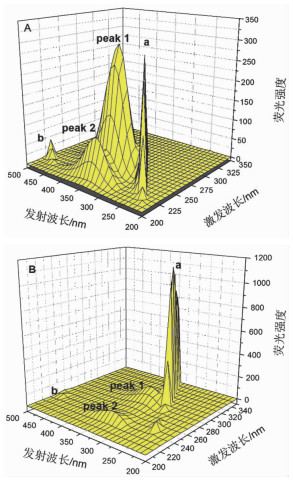
|
图 6 球形纳米金与BSA相互作用的3D荧光光谱图 注:(A)空白BSA, (B)球形纳米金与BSA相互作用体系 |
为了研究相互作用过程中BSA分子的结构变化,开展了圆二色谱实验(CD)。BSA分子的圆二色谱在紫外区域的208nm和220nm处存在两个负的肩缝,这是典型的蛋白质α-螺旋结构[21]。两个肩缝强度都显著的减少,这说明蛋白质结构中α-螺旋结构含量减少了。α-螺旋结构含量的减少表明球形纳米金与蛋白质多肽链的氨基酸发生了相互作用。然而,在有无球形纳米金时,BSA分子的圆二色光谱的形状较相近,这意味着当加入球形纳米金之后BSA分子的结构仍然是α-螺旋结构占主导地位。见图 7。
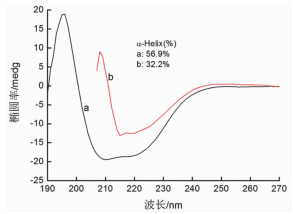
|
图 7 球形纳米金与BSA相互作用的圆二色谱图 注:从(a)到(b)BSA的浓度固定为1.67×10-6L·mol-1,球形纳米金的浓度为0、8.33×10-5L·mol-1 |
本论文合成并表征了球形金纳米粒子,利用紫外可见光谱、荧光光谱以及圆二色谱相结合的方法研究了其与BSA的相互作用。由实验结果可知,随着球形纳米金浓度的增加,BSA的紫外吸收峰强度有所增加,而荧光强度却降低。利用变温荧光实验得到了两者相互作用的吉布斯自由能变、熵变、焓变等热力学参数,得知荧光猝灭机理是静态猝灭。加入球形纳米金之后,BSA分子结构仍然是α-螺旋结构占主导地位。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Truong GT, Tran HV, Choi KK. Investigation on mode I fracture toughness of woven carbon fiber-reinforced polymer composites incorporating nanomaterials[J]. Polymers, 2020, 12(11): 2512-2534. DOI:10.3390/polym12112512 |
| [2] |
Yang X, Yang MX, Pang B, et al. Gold nanomaterials at work in biomedicine[J]. Chem Rev, 2015, 115(19): 10410-10488. DOI:10.1021/acs.chemrev.5b00193 |
| [3] |
徐香玉, 王浩, 杜中玉, 等. 球形纳米银颗粒与人血清白蛋白相互作用的研究[J]. 化学通报, 2016, 79(3): 279-282. DOI:10.14159/j.cnki.0441-3776.2016.03.016 |
| [4] |
刘雯, 高硕, 朱帅, 等. 银纳米线与BSA相互作用的光谱学研究[J]. 化学研究, 2019, 30(4): 372-377. DOI:10.14002/j.hxya.2019.04.009 |
| [5] |
Dai K, Zheng L, Xu NY, et al. The preparation of c-reactive protein immunosensor based on amino graphene and hollow silver platinum nanomaterials[J]. J Nanosci Nanotechno, 2017, 17(1): 115-122. DOI:10.1166/jnn.2017.12381 |
| [6] |
Fan L, Lou D, Zhang Y, et al. Rituximab-Au nanoprobes for simultaneous dark-field imaging and DAB staining of CD20 over-expressed on Raji cells[J]. Analyst, 2014, 139(22): 5660-5663. DOI:10.1039/c4an01342e |
| [7] |
Huang QQ, Zou Y, Zhong SC, et al. Silica-coated gold nanorods with high photothermal efficiency and biocompatibility as a contrast agent for in vitro terahertz imaging[J]. J Biomed Nanotechnol, 2019, 15(5): 910-920. DOI:10.1166/jbn.2019.2738 |
| [8] |
Garcia, J, Fernández-Pradas, M, Lladó A, et al. The combined use of gold nanoparticles and infrared radiation enables cytosolic protein delivery[J]. Chem Eur J, 2020, 27(14): 4670-4675. DOI:10.1002/chem.202005000 |
| [9] |
汪静, 高晓娟, 赵启鹏. 谷胱甘肽修饰金纳米棒用于肿瘤细胞光敏热疗的疗效及相关机制[J]. 生物物理学报, 2015, 31(2): 125-135. DOI:10.3724/SP.J.1260.2015.50004 |
| [10] |
Sofla SFI, Abbasian M, Mirzaei M. A novel gold nanorods-based pH-sensitive thiol-ended triblock copolymer for chemo-photothermo therapy of cancer cells[J]. J Biomat Sci-polym E, 2019, 30(1): 12-33. DOI:10.1080/09205063.2018.1504193 |
| [11] |
Mahmoud NN, Aqabani H, Hikmat S, et al. Colloidal stability and cytotoxicity of polydopamine-conjugated gold nanorods against prostate cancer cell lines[J]. Molecules, 2021, 26(5): 1299-1319. DOI:10.3390/molecules26051299 |
| [12] |
李林甲, 金静, 宋薇, 等. 碳点/金纳米复合材料的SERS及催化性质研究[J]. 光谱学与光谱分析, 2020, 40(S1): 145-146. |
| [13] |
Niloy MS, Shakil MS, Hossen MS, et al. Promise of gold nanomaterials as a lung cancer theranostic agent: a systematic review[J]. Int Nano Lett, 2021, 1-19. DOI:10.1007/s40089-021-00332-2 |
| [14] |
Wang J, Zhang RY, Ji XT, et al. SERS and fluorescence detection of circulating tumor cells (CTCs) with specific capture-release mode based on multifunctional gold nanomaterials and dual-selective recognition[J]. Anal Chim Acta, 2021, 1141: 206-213. DOI:10.1016/j.aca.2020.10.033 |
| [15] |
Levak M, Burić P, Sikirić MD, et al. Effect of protein coronaonsilvernanoparticlestabilization andionreleasekineticsinartificialsea water[J]. Environ Sci Technol, 2017, 51(3): 1259-1266. DOI:10.1021/acs.est.6b03161 |
| [16] |
Seedher N, Kanojia M. Fluorescence spectroscopic study for competitive binding of antidiabetic drugs and endogenous substances on serum albumin[J]. Drug Metabol Drug Interact, 2013, 28(2): 107-114. DOI:10.1515/dmdi-2012-0044 |
| [17] |
Sandu N, Chilom C, David M, et al. Evaluation of the interaction of levothyroxine with bovine serum albumin using spectroscopic and molecular docking studies[J]. J Biomol Struct Dyn, 2020, 11-13. DOI:10.1080/07391102.2020.1822919 |
| [18] |
Li X, Yang LQ, Wang YF, et al. Studies on binding of single-stranded DNA with reduced graphene oxide-silver nanocomposites[J]. IET Nanobiotechnol, 2020, 14(4): 308-313. DOI:10.1049/iet-nbt.2019.0377 |
| [19] |
Xu X, Mao X, Wang Y, et al. Study on the interaction of grapheneoxide-silver nanocomposites with bovine serum albumin and the formation of nanoparticle-protein corona[J]. Int J Biol Macromol, 2018, 116: 492-501. DOI:10.1016/j.ijbiomac.2018.05.043 |
| [20] |
Ross PD, Subramanian S. Thermodynamics of protein association reactions: forces contributing to stability[J]. Biochemistry, 1981, 20(11): 3096-3102. DOI:10.1021/bi00514a017 |
| [21] |
Xu XY, Du ZY, Wu WH, et al. Synthesis of triangular silver nanoprisms and spectroscopic analysis on the interaction with bovine serum albumin[J]. Anal Bioanal Chem, 2017, 409(12): 5327-5336. DOI:10.1007/s00216-017-0478-4 |



