2. 山东省职业卫生与职业病防治研究院, 济南 250062
2. Shandong Academy of Occupational Health and Occupational Medicine, Ji'nan 250062, China
紫茎泽兰(Eupatorium adenophorum spreng)系菊科泽兰属多年生半灌木草本植物,是我国首位的外来入侵植物,它侵占农田、果园、林地,与农作物争水、争肥、争阳光和空间。其可堵塞水渠,阻碍交通,危害畜牧业,对农业生产及环境生态的危害性极大。为了防控紫茎泽兰的传播蔓延,保护生态环境,人们对紫茎泽兰进行了开发利用[1-3]。紫茎泽兰羟基泽兰酮(Euptox A)是从紫茎泽兰中分离出的化合物,具有很好的杀虫及抑菌效果,可作为一类较好的生物农药资源进行开发利用[4-6]。但是,紫茎泽兰作为一种有毒杂草,牲畜食用后会导致肝、肾毒性[7]。因此,其对于人类健康的影响也不容忽视。为此,我们对Euptox A进行了系统的毒理学研究[8-10]。本实验通过研究大鼠静脉给予Euptox A的毒代动力学与组织分布,揭示Euptox A在动物体内的动态变化规律,为紫茎泽兰的安全利用提供理论依据。
1 材料与方法 1.1 仪器及试剂1100系列高效液相色谱仪,包括G1311A四元泵、G1379A在线脱氧机、G1316A柱温箱、G1315BDAD检测器和G1313A进样器,美国Agilent公司;AB204-A电子分析天平,梅特勒-托利多上海仪器公司;高速离心机,美国Thermo Fisher Scientific公司;Euptox A标准品室温下呈浅黄色固体,不溶于水,由中国农业科学院植物保护研究所提供,纯度99%。实验时用注射用大豆油为溶剂,配制后的Euptox A溶液经0.22 μm无菌滤膜过滤后备用。
1.2 动物分组、处理及样品采集健康Wistar雄性大鼠33只,体质量240~260g,由山东大学实验动物中心提供,动物许可证号为:SCXK (鲁)2012-0001。饲养环境:室温20.0℃~23.0℃,相对湿度为45%~55%。实验动物房合格证号:SYXK(鲁)2011-0001号。
1.2.1 毒代动力学研究健康雄性Wistar大鼠15只,随机分为3组,每组5只,以尾静脉给药的方式,一次性静脉给予Euptox A 25、50和100mg·kg-1。各组分别于给药前和给药后5、10、15、20、30、45、60、90、120、180、270和360min于颈静脉窦处取血0.25mL,肝素抗凝,1000g离心10min,取血浆,-20℃冰箱保存备用。
1.2.2 组织分布研究健康雄性Wistar大鼠18只,随机分为3组,每组6只,以尾静脉给药的方式,一次性静脉给予Euptox A 50mg·kg-1。分别于静脉给药后10、60和120min处死大鼠,迅速取其心、肝、脾、肺、肾、脑、胃、肠、睾丸和肌肉组织,用生理盐水将组织样品冲洗去除残留物,滤纸吸干,准确称量一定的质量,加入4倍生理盐水,制成20%的组织匀浆,1000g离心10min, 取上清放置于-20℃冰箱保存备用。
1.3 生物样品处理取100μL血浆或组织样品加100μL乙腈混匀,8708g离心5min, 取上清100μL加400μL流动相稀释混匀,经0.45μL滤膜过滤后进样20μL测定。取空白血浆及组织样品配成1、5、10、20、40、60、80、100mg·L-1的Euptox A标准系列溶液,经预处理后记录色谱图及峰面积,以Euptox A浓度(X)对峰面积(Y)进行线性回归,计算出标准曲线方程
1.4 Euptox A浓度测定采用1100系列高效液相色谱仪测量生物样品中Euptox A浓度。色谱柱SB-C18 (250mm×4.6mm, 5.0μm),流动相为甲醇: 水=60 ∶40(v/v),流速为0.8mL·min-1,进样量20μL,检测波长为255nm,190~400nm波段全扫描。
1.5 统计学方法实验数据采用x±s表示,采用DAS 2.0药代动力学智能分析软件对所测数据进行分析,计算毒代动力学参数。
2 结果 2.1 高效液相测定生物样品Euptox A含量的方法学确认 2.1.1 Euptox A全血样品浓度测定方法确认本实验前期已按照《化学药物非临床毒代动力学研究技术指导原则》完成Euptox A在大鼠全血中含量的方法学验证。大鼠全血空白杂质对检测无干扰,Euptox A在2~2000 μg·L-1范围内线性关系良好,Euptox A在20、200、2000 μg·L-1的精密度均<15%,日内和日间准确度在85%~115%之间,回收率为90.4%~109.1%,符合生物样品定量测定要求。
2.1.2 Euptox A组织样品中浓度测定方法确认Euptox A色谱图峰形良好,分离完全,心、肝、脾、肺、肾、脑、胃等各组织杂质对检测无干扰,样品于室温放置12h及-20℃放置1周稳定,精密度均<15%,准确度在85%~115%之间,回收率为93.8%~104.7%。结果表明本实验方法符合生物样品分析指导原则的要求,具有较高的专属性。以Euptox A浓度(X)对峰面积(Y)进行线性回归,得标准曲线方程。见表 1。
| 表 1 大鼠组织中紫茎泽兰羟基泽兰酮(Euptox A)的校正标准曲线和相关系数 |
大鼠静脉给予Euptox A后,Euptox A的毒代动力学符合线性毒代动力学特点。大鼠单次静脉给予Euptox A 25、50和100 mg·kg-1后,5min血药浓度达到最高值分别为(2.57±0.60)、(5.83±0.94)和(10.72±2.08)mg·L-1,60min血药浓度已降至峰浓度的1/10~1/5;消除半衰期分别为(27.4±6.7)、(21.6±5.4)和(18.3±5.8)min;AUC分别为(2039.4±835.3)、(4277.2±1194.6)和(7842.7±1077.8)mg·min-1·L-1;清除率无明显差异,表明在给药范围内无消除饱和现象。见图 1、表 2。
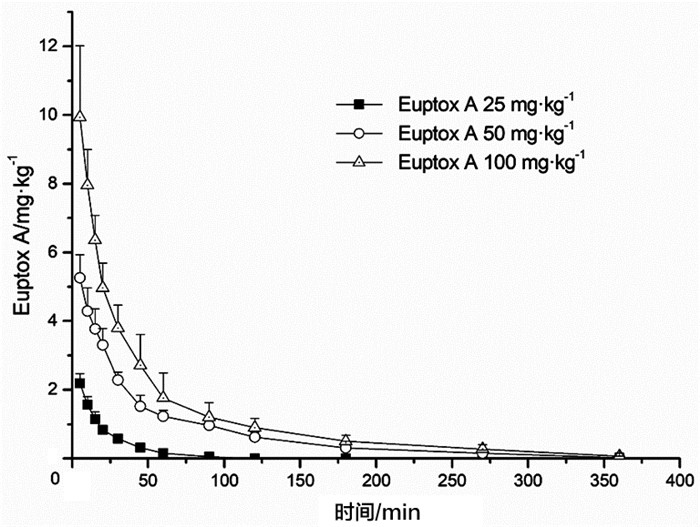
|
图 1 大鼠静脉给予Euptox A后的血药浓度-时间曲线(x±s,n=5) |
| 表 2 大鼠静脉给予Euptox A的主要毒代动力学参数(x±s,n=5) |
大鼠静脉给予Euptox A 50mg·kg-1后,在血液、心、肝、脾、肺、肾、脑、胃、睾丸和肌肉组织中均有分布,以血液、肝和心较高,给药后10min达到最高值,60min后显著下降,Euptox A在大鼠各组织分布后,消除也较快,给药后120min各组织中的含量仅为给药后10min的1/15~1/7,说明Euptox A不会在组织中蓄积。见表 3。
| 表 3 大鼠静脉给予Euptox A 50mg·kg-1各组织中的分布(μg·g-1,x±s) |
紫茎泽兰作为具有毒性的一类外来入侵植物,大面积及高密度是其入侵过程中最为显著的特征。随着其研究深入,发现紫茎泽兰叶片提取物Euptox A在抑菌及杀虫中具有较好的作用。但是,其可导致动物肝脏损伤[11]。目前,还未见对Euptox A相关毒代动力学及组织分布的研究。
本文结果显示,Euptox A最大血药浓度与给药剂量呈良好的线性关系,平均消除半衰期最长约30 min,清除率为0.24~0.39 L·min-1·kg-1。提示,在本研究剂量范围内,Euptox A在体内代谢转化较快,具有吸收快及清除快的特点。在大鼠静脉给予Euptox A 50 mg·kg-1后,Euptox A在所测定的各组织中均有分布,给药10 min后各组织中的含量达最高,然后逐渐下降,120 min后大部分组织含量降至较低。Euptox A在大鼠脑和睾丸中均可测出,说明Euptox A通过血脑屏障和血睾屏障,可能与其相对分子量较小有关。有研究发现,紫茎泽兰草粉对小鼠睾丸精母细胞染色体畸变率未见明显影响,这可能由于紫茎泽兰相关提取物在睾丸中浓度较低,且消除较快,以上特征与本研究中Euptox A相似。Euptox A在血浆中含量较高,谢鹏等[12]研究发现,Euptox A可诱发小鼠血液感染性损伤。同时我们发现心脏和肝脏中Euptox A含量较高,这可能由于该组织器官血流丰富。叶妍琳等[13]发现,紫茎泽兰中毒马匹的谷丙转氨酶、谷草转苷酶、碱性磷酸水平显著升高,而肌酐水平下降,紫茎泽兰中毒会对马的肝脏以及肾脏功能产生损伤;董强等[14]同样发现,紫茎泽兰全草对小鼠肝脏、肾脏有中等毒性,但以上研究均未证实紫茎泽兰中何种物质可造成肝脏损伤。基于以上研究,我们课题组进一步通过亚慢性毒性实验发现,Euptox A对小鼠肝脏有较强的毒性作用。
通过研究Euptox A在大鼠体内的毒代动力学和组织分布特征,揭示其代谢规律及分布特征,为Euptox A的进一步开发利用提供毒性评价相关的科学依据。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
赵国晶, 马云萍. 云南省紫茎泽兰的分布与危害的调查研究[J]. 杂草学报, 1989, 3(2): 37-40. |
| [2] |
闫乾胜, 杨婕, 李华民, 等. 入侵物种紫茎泽兰化学成分及生物活性研究进展[J]. 北京师范大学学报(自然科学版), 2006, 42(1): 70-73. DOI:10.3321/j.issn:0476-0301.2006.01.016 |
| [3] |
王林, 秦瑞豪. 外来恶性杂草紫茎泽兰研究进展[J]. 西南林学院学报, 2004, 24(3): 72-75. |
| [4] |
王一丁, 高平, 郑勇, 等. 紫茎泽兰提取物对棉蚜的毒力及其灭蚜机理研究[J]. 植物保护学报, 2002, 29(4): 337-340. DOI:10.3321/j.issn:0577-7518.2002.04.010 |
| [5] |
刘朦, 王琦, 鲁一薇, 等. 紫茎泽兰提取物对番茄病害致病菌的抑制作用[J]. 山西农业科学, 2020, 48(5): 784-788. DOI:10.3969/j.issn.1002-2481.2020.05.28 |
| [6] |
Liao F, Hu Y, Tan H, et al. Acaricidal activity of 9-Oxo-10, 11-dehydroageraphorone extracted from eupatorium adenophorum in vitro[J]. Exp Parasitol, 2014, 140: 8-11. DOI:10.1016/j.exppara.2014.02.009 |
| [7] |
周自玮, 段新慧, 徐驰, 等. 紫茎泽兰饲喂山羊试验研究[J]. 饲料工业, 2006, 27(19): 25-28. DOI:10.3969/j.issn.1001-991X.2006.19.009 |
| [8] |
李厚勇, 王蕊, 张振铃, 等. 紫茎泽兰醇提取物对大鼠致畸作用[J]. 中国公共卫生, 2011, 27(12): 1593-1594. DOI:10.11847/zgggws2011-27-12-39 |
| [9] |
修海迪, 李超, 李厚勇, 等. 紫茎泽兰提取物对小鼠脾细胞凋亡的影响[J]. 中国辐射卫生, 2013, 22(6): 751-753. DOI:10.13491/j.cnki.issn.1004-714x.2013.06.046 |
| [10] |
李超, 李厚勇, 张振铃, 等. 紫茎泽兰提取物对小鼠免疫毒性的研究[J]. 毒理学杂志, 2015, 29(3): 190-192. |
| [11] |
Oelrichs PB, Calanasan CA, Macleod JK, et al. Isolation of a compound from Eupatorium adenophorum (Spreng.)]causing hepatotoxicity in mice[J]. Natural Toxins, 2010, 3(5): 350-354. DOI:10.1002/nt.2620030505 |
| [12] |
谢鹏, 李庆庆, 莫全, 等. Euptox A对小鼠血液学及肝肾功能影响的研究[J]. 黑龙江畜牧兽医, 2017(11): 220-222, 225. DOI:10.13881/j.cnki.hljxmsy.2017.1003 |
| [13] |
叶妍琳, 扬子江, 付偲, 等. 紫茎泽兰对马肝肾功能的影响[J]. 中兽医医药杂志, 2016, 35(4): 47-48. DOI:10.13823/j.cnki.jtcvm.2016.04.014 |
| [14] |
董强, 赵宝玉, 顾强, 等. 紫茎泽兰全草对小鼠毒性试验[J]. 西北大学学报(自然科学版), 2011, 41(3): 469-472. |



