缺血性卒中发病率高于出血性卒中,占脑卒中总数的60%~70%。已成为老年人致残致死的最主要原因,给社会和家庭带来沉重经济和精神负担。对女性来讲,绝经前卒中发病率显著低于同年龄段男性,但绝经后则显著高于同年龄段男性,且预后更差[1],说明雌激素对脑卒中具有保护作用[2]。Gibson等[3]证实雌激素能够减少脑卒中梗死容积。大样本临床研究显示,雌激素可减轻脑卒中发病率和死亡率,但同时也可以增加乳腺癌和子宫内膜癌等风险[4]。而植物雌激素对乳腺癌、子宫内膜癌、结肠癌等多种肿瘤细胞的增殖均有抑制作用[5]。葛根素是从野葛的根部分离出的一种异黄酮类化合物,属于植物性雌激素,具有和雌激素相似的作用,其对不同类型的神经性疾病具有一定保护作用,并且能增强去势大鼠的学习和记忆认知功能,减少海马CA1区神经元的凋亡[6]。
葛根素对去势脑缺血大鼠有何影响未见报道,本课题组拟利用去势脑缺血大鼠模型,观察葛根素对其学习记忆功能的影响并进一步探讨其机制。
1 材料与方法 1.1 材料 1.1.1 实验仪器低速自动平衡离心机(北京医用离心机厂,LDZ5-2);组织匀浆机(IKA,KB5/10);722型紫外分光光度计(上海精密科学仪器有限公司,707040913);跳台仪(中国医学科学院药研所);Multiskan FC型酶标仪(赛默飞世尔上海仪器有限公司,357-906301);电热恒温培养箱(上海龙跃仪器设备有限公司,LI-9082)。
1.1.2 试剂葛根素注射液(山东方明药业集团股份有限公司,H20033292);TTC染色液(美国索来宝公司,T8170);丙二醛(MDA)测试盒(南京建成生物工程研究所,A003-1-2);超氧化物歧化酶(SOD)测试盒(南京建成生物工程研究所,A001-3-2);总蛋白定量测试盒(BCA法)(南京建成生物工程研究所,A045-4-2);乙酰胆碱(Ach)测试盒(南京建成生物工程研究所);乙酰胆碱酯酶(AchE)测试盒(南京建成生物工程研究所,A024)。
1.1.3 实验动物及分组清洁级健康SD雌性大鼠,15月龄,体重约220g,山东鲁抗医药股份有限公司提供(许可证号:SCXK(鲁)20130001)。实验前在恒温、恒湿实验室饲养1周,自由进食进水。将大鼠随机分为6组,正常对照组、OVX+2VO组、Sham-OVX+2VO组、葛根素低剂量组(25mg·kg-1)、中剂量组(50mg·kg-1)、高剂量组(100mg·kg-1),每组8只。葛根素低剂量组(25mg·kg-1)、中剂量组(50mg·kg-1)、高剂量组(100mg·kg-1)在OVX和单侧颈总动脉结扎后,分别给予葛根素注射液0.2ml·100g-1腹腔注射,每天1次。其它组给予等体积蒸馏水,方法同上。所有动物实验符合动物伦理学要求。
1.2 方法 1.2.1 OVX+2VO大鼠模型制备10%水合氯醛(0.35ml/100g)腹腔注射将大鼠麻醉后,俯卧位固定,备皮并消毒,于雌性大鼠背外侧髋关节部位纵行剪开皮肤约1.5cm,钝性分离皮下组织和肌层,于腹腔内找到“菜花样”卵巢组织,结扎输卵管,切除双侧卵巢后闭合伤口。接着行颈部手术,暴露一侧颈总动脉,小心将血管和神经分离,结扎血管远心端和近心端,从中间将血管剪断,缝合伤口。1周后相同方法结扎另一侧颈总动脉,OVX+2VO模型制备成功。Sham-OVX+2VO大鼠只结扎双侧颈总动脉不切除卵巢。
1.2.2 TTC染色将大鼠麻醉(方法同上)后断头取脑,在-18℃冰箱中冷冻约20min,将鼠脑置入专用脑槽,连续切成6片,厚度2mm,依次放入十二孔板中,注入2% TTC染色液,避光,放入37℃恒温培养箱25min后,用无菌注射器将染色液抽出后,用4%多聚甲醛固定24h,正常大脑组织染成鲜红色,缺血组织呈苍白色,将染色完成的大脑组织按切片顺序排列,用数码相机拍照[7]。
1.2.3 WST-1法测定SOD活力将大鼠麻醉后断头取脑,立即放入装有冷生理盐水培养皿中,取出海马,称重后加9倍体积的生理盐水,剪碎组织,冰水浴制备匀浆,3000rpm,离心10min,取上清即10%组织原浆备用。严格按照试剂盒说明书提供步骤进行操作,各孔混匀后,37℃孵育20min,450nm处酶标仪读数,得到各孔OD值,将数据代入公式进行计算:SOD活力(U/mgprot)=SOD抑制率÷50%×反应体系稀释倍数(0.24ml/0.02ml)÷待测样本蛋白浓度(mgprot/ml)。
1.2.4 TBA法测定MDA含量按以上方法制备海马组织匀浆,严格按照试剂盒说明书提供步骤进行操作,离心管混匀后,95℃水浴40min,取出后流水冷却,然后4000rpm离心10min。取上清,532nm处,1cm光径,蒸馏水调零,测各管OD值。利用公式计算MDA含量:MDA含量(nmol/mgprot)=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度(10nmol/ml)÷待测样本蛋白浓度(mgprot/ml)。
1.2.5 AchE测定按以上方法制备海马组织匀浆,严格按照试剂盒说明书步骤操作。各管混匀后静置15min,波长412nm,0.5cm光径,双蒸水调零,测定各管OD值,利用公式计算组织中的AchE活力:AchE活力(U/mgprot)=(测定OD值-对照OD值)/(标准OD值-空白OD值)×标准品浓度(1μmol/ml)÷待测样本蛋白浓度(mgprot/ml)。
1.2.6 Ach测定按以上方法制备海马组织匀浆,严格按照试剂盒说明书步骤操作。各孔混匀后,静置10min,550nm处,取200ul于96孔板在550nm处酶标仪测定各孔OD值,利用公式计算Ach含量:Ach含量(ug/mgprot)=(测定OD值-测定空白OD值)/(标准OD值-空白OD值)×标准品浓度(400μg/ml)×样本测试前稀释倍数÷蛋白浓度(mgprot/ml)。
1.2.7 跳台实验实验分为训练期和实验期。训练期,将大鼠放到跳台箱内熟悉3min,然后通36V交流电5min,大鼠受到电击后,正常反应是跳上平台逃脱电击。如果大鼠始终没有跳上平台则弃去不用。训练结束24h后,再次将大鼠放入跳台内适应3min,通电5min,记录大鼠第一次跳上平台的时间(即跳台潜伏期),观察大鼠在5min内跳下平台的次数(即错误次数),若5min内大鼠未跳下平台,错误次数为0,跳台潜伏期为5min[8]。
1.3 统计学方法应用SPSS 19.0软件进行统计学分析。定量数据以x±s表示,多组间比较采用方差分析,进一步两两比较采用Dunnett-t检验,P<0.05为差异有统计学意义。
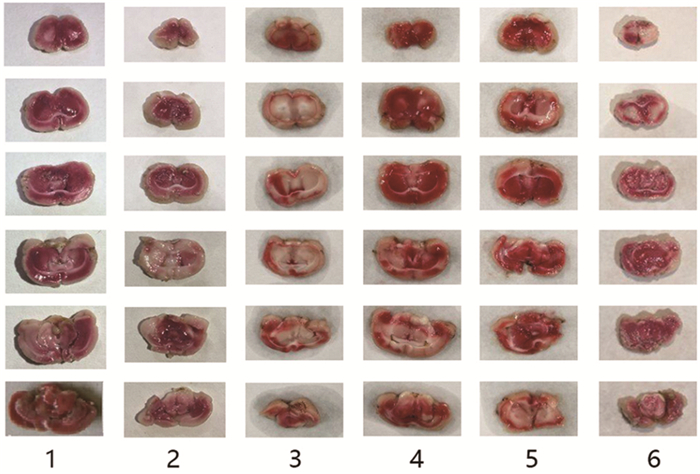
2 结果 2.1 各组大鼠脑缺血情况正常对照组大鼠脑组织染成鲜红色,Sham-OVX+2VO组和OVX+2VO组脑缺血组织呈苍白色,给予葛根素治疗后,葛根素干预组脑缺血情况得到明显改善,随剂量增加,缺血面积逐渐减少。见图 1。
|
图 1 TTC染色后各组大鼠脑切片缺血区比较 注:1-正常对照组;2-Sham-OVX+2VO组;3-OVX+2VO组;4-葛根素低剂量组;5-葛根素中剂量组;6-葛根素高剂量组。 |
与正常对照组比,Sham-OVX+2VO组和OVX+2VO组SOD活力均降低、AchE活性升高、Ach含量减少(P<0.05),OVX+2VO组MDA含量明显升高(P<0.05)。与OVX+2VO组比,葛根素使SOD活力升高,且随剂量增加,作用明显增强(P<0.05);葛根素100mg·kg-1组能减低MDA含量(P<0.05),降低AchE活性(P<0.05)升高Ach含量(P<0.05)。见表 1。
| 表 1 各组SOD活力、MDA含量、AchE活性及Ach含量比较(x±s) |
与正常对照组相比,Sham-OVX+2VO组和OVX+2VO组的潜伏期明显缩短(P<0.05),错误次数增多(P<0.05);与OVX+2VO组相比,葛根素50mg/kg组、葛根素100mg/kg组潜伏期明显延长(P<0.05),错误次数减少(P<0.05)。见表 2。
| 表 2 各组大鼠跳台实验潜伏期和错误次数比较(x±s) |
绝经后女性缺血性脑卒中发病率逐年上升,其所致患者死亡数约占女性死亡人数的1/6[9]。缺血后的后遗症多见,除引起运动和感觉异常外,还伴有认知功能障碍,严重影响患者的生活质量[10]。如何防治绝经后女性脑卒中已成为亟待解决的社会和医学难题。
本课题组采用OVX合并2VO制备去势脑缺血实验模型,能够较好地模拟绝经后女性伴发脑缺血的状态。TTC染色后,Sham-OVX+2VO组和OVX+2VO组脑缺血组织呈苍白色,且OVX+2VO组脑缺血更明显,说明OVX合并2VO加重脑缺血,可以解释为何绝经后女性缺血性脑卒中的发病率高于男性,且更严重。葛根素随剂量增加,大鼠脑缺血情况逐渐减轻,提示其对OVX合并2VO大鼠的缺血性损伤有保护作用。
脑组织发生缺血缺氧后,通过酶系或非酶系统产生氧自由基,过量的自由基攻击细胞膜中的多不饱和脂肪酸,引起脂质的过氧化反应,并形成MDA、酮基、羟基等脂质过氧化物,以及新的氧自由基。可见测定MDA含量能够反映体内脂质过氧化程度,间接反映缺血对细胞造成的损伤[11]。SOD对机体氧自由基具有清除能力,以防止自由基对细胞造成的损伤[12]。葛根素能降低MDA含量并随剂量增加升高SOD活力升高,提示其对缺血性脑损伤具有保护作用。
Ach是第一个被发现的脑内神经递质,主要涉及记忆、学习、运动和觉醒的调节。胆碱能神经末梢以胆碱和乙酰辅酶A为原料,在胆碱乙酰化酶的作用下合成Ach,合成后储存在突触前膜的囊泡内。当神经冲动到达神经末梢时,突触前膜与囊泡膜融合发生破裂,以胞裂外排的方式释放Ach,释放出的Ach在AchE的作用下水解失活。脑内的AchE主要分布在大脑额叶、顶叶和海马,而海马与学习记忆的关系最为密切,若海马组织中AchE活性增强,可降低神经突触间隙Ach水平,影响神经突触传递,导致学习记忆和认知功能降低[13-14]。本实验中,OVX+2VO组大鼠海马组织中AChE活性升高,Ach含量降低。葛根素干预后海马组织中AchE活性降低,Ach含量提高。在跳台实验中,葛根素组大鼠跳台潜伏期明显延长,错误次数减少,说明葛根素可能通过增强AchE活性提高去卵巢合并慢性脑缺血大鼠的学习记忆功能。
综上所述, 葛根素对去势脑缺血大鼠的学习记忆功能有改善作用,其机制可能与其抗氧化自由基作用减轻脑缺血所致损伤,同时抑制AchE活力,促进Ach的突触传递功能有关。
利益冲突:所有作者均申明不存在利益冲突。
| [1] |
Haast RA, Gustafson DR, Kiliaan AJ. Sex differences in stroke[J]. J Cereb Blood Flow Metab, 2012, 32(12): 2100-2107. DOI:10.1038/sj.jcbfm.2012.141 |
| [2] |
Persky RW, Turtzo LC, Mc Cullough LD. Stroke in women: disparities and outcomes[J]. Curr Cardiol Rep, 2010, 12(1): 6-13. DOI:10.1007/s11886-009-0080-2 |
| [3] |
Gibson CL, Gray LJ, Murphy SP, et al. Estrogens and experimental ischemic stroke: asystematic review[J]. J Cereb Blood Flow Metab, 2006, 26(9): 1103-1113. DOI:10.1038/sj.jcbfm.9600270 |
| [4] |
Rossouw JE, Anderson GL, Prentice RL, et al. Risks and benefits of estrogen plus progestin inhealthy postmenopausal women: principal results From the Women's Health Initiative randomizedcontrolled trial[J]. JAMA, 2002, 288(3): 321-333. DOI:10.1001/jama.288.3.321 |
| [5] |
Ward HA, Kuhnle GG, Mulligan AA, et al. Breast, colorectal, and prostate cancer risk in the European Prospective investigation into cancer and Nutrition-Norfolk in relation to phytoestrogen intake derived from an improved database[J]. Am J Clin Nutr, 2010, 91(2): 440-448. DOI:10.3945/ajcn.2009.28.282 |
| [6] |
王爱岳, 王良, 李强, 等. 葛根素联合胞磷胆碱钠治疗脑梗塞的临床观察[J]. 海南医学, 2005, 16(4): 63. |
| [7] |
Li H, Zhang N, Lin HY, et al. Histological, cellularand behavioral assessments of stroke outcomes after photothrombosis-induced ischemia in adult mice[J]. BMC Neurosci, 2014, 15(1): 58-66. DOI:10.1186/1471-2202-15-58 |
| [8] |
Ning N, Hu JF, Sun JD, et al. Clausenamide facilitates synaptic transmission at hippocampal Schaffer collateral-CA1 synapses[J]. Eur J Pharmacol, 2012, 682(1): 50-55. DOI:10.1016/j.ejphar.2012.02.004 |
| [9] |
Caso V, Falorni A, Bushnell CD, et al. Pregnancy, Hormonal Treatments for Infertility, Contraception, and Menopause in women after ischemic stroke: a consensus document[J]. Stroke, 2017, 48(2): 501-506. DOI:10.1161/STROKEAHA.116.013964 |
| [10] |
Robinson RG, Jorge RE. Post-stroke depression: a review[J]. Am J Psychiatry, 2016, 173(3): 221-231. |
| [11] |
Gao Q, Ji ZH, Yang Y, et al. Neuroprotective effect of Rhizoma Atractylodismacrocephalaeagainst excitotoxicityinduced apoptosis in cultured cerebral cortical neurons[J]. Phytother Res, 2012, 26(4): 557-561. DOI:10.1002/ptr.3595 |
| [12] |
Liu C, Zhao H, Ji ZH, et al. Neuroprotection of atractylenolide Ⅲ from Atractylodis macrocephalae against glutamate-induced neuronal apoptosis via inhibiting caspase signaling pathway[J]. Neurochem Res, 2014, 39(9): 1753-1758. DOI:10.1007/s11064-014-1370-7 |
| [13] |
Zhang H, Lai Q, Li Y, et al. Learning and memory im-provement and neuroprotection of Gardenia jasminoides(Fructus gardenia) extract on ischemic brain injury rats[J]. J Ethnopharmacol, 2017, 196: 225-235. DOI:10.1016/j.jep.2016.11.042 |
| [14] |
Liu JM, Wu PF, Rao J, et al. ST09, a novel thioester derivative of tacrine, alleviates cognitive deficits and enhances glucose metabolism in vascular dementia rats[J]. CNS Neurosci Ther, 2016, 22(3): 220-229. DOI:10.1111/cns.12495 |



