2. 苏州大学附属第一医院,苏州 215006
2. The First Hospital Affiliated to Soochow University, Suzhou 215006, China
葫芦素B(Cucurbitacin B)是从葫芦科植物中提取的四环三萜类化合物, 是葫芦素家族中含量最丰富的成员, 具有广泛的药理活性, 如抗炎、保肝、提高机体免疫力等作用[1-2]。葫芦素B在体内外实验均被证实可发挥有效抗肿瘤活性, 且无明显毒副作用。本文将探讨葫芦素B对激素受体阳性的人MCF-7乳腺癌细胞生物学行为的影响及其机制。
1 材料与方法 1.1 材料人MCF-7细胞购自中国科学院上海细胞库。纯化葫芦素B购自中国舜博生物工程科技公司, 溶剂为二甲基亚砜(DMSO), 本实验所有抗体购自Cell Signaling公司。
1.2 方法 1.2.1 细胞培养DMEM培养基(美国纽约格兰德岛Gibco公司, 其中含链霉素100U/ml、青霉素100μ/ml以抑制杂菌生长, 外加10%胎牛血清适量)培养细胞, 保持温度37℃, CO2体积分数5%。当细胞处于对数生长期时胰酶消化、备用。
1.2.2 SRB实验备用细胞制成单细胞悬液。96孔培养板上各滴加100μl细胞悬液, 37℃, 5%CO2, 培养24h。去上清液, 实验组分别加入20μM、50μM、100μM葫芦素B, 对照组加入等体积的DMSO。每个药物浓度组做5个平行孔, 经48h充分反应后三氯醋酸(中国舜博生物工程科技公司)固定。去离子水洗涤, 干燥后加入0.4% SRB(中国舜博生物工程科技公司)充分反应。10mmol/L的Tris溶液(中国舜博生物工程科技公司)加入经醋酸洗涤的溶液中, 以获取结合型SRB。空白孔吸光度(OD)值设为零, 利用酶标仪(Amersham公司)在490nm波长下测量各组标本OD值并计算抑制率。抑制率(%)=1-[(药物组OD值-空白组OD值)/(对照组OD值-空白组OD值)×100%]
1.2.3 Hoechst 33258凋亡实验取备用细胞以4×104个/孔的密度接种于覆灭菌盖玻片的6孔培养板内过夜。设对照组和20μM、50μM、100μM葫芦素B组, 48h后去培养液, 固定, 漂洗。移液枪移取0.5ml稀释的Hoechst 33258溶液(上海碧云天生物科技有限公司)加入上标本, 反应后洗涤、封片, 在倒置光学显微镜(日本Olympus公司)下详细观察记录细胞核染色情况。
凋亡率(%)=凋亡小体个数/整张片子细胞数量×100%
1.2.4 Western blotting收集培养12、24h的实验组和对照组细胞于EP管中, 2500rpm离心5min, 弃上清, 收集细胞, PBS洗涤。加入含PMSF的细胞裂解液(上海碧云天生物科技有限公司), 轻轻吹打充分反应后置于冰浴中30min。再次离心, 上清液-20℃保存。BCA试剂盒(上海碧云天生物科技有限公司)检测总蛋白浓度, 调节所用标本至相同浓度。加上样缓冲液, 按照SDS-PAGE电泳操作流程逐步进行电泳、分离蛋白、转膜、封闭。稀释LC3-Ⅰ、LC3-Ⅱ、P62等一抗, 4℃在摇床上孵育过夜, 之后TBST洗膜。同样方法孵育已做好标记的二抗, 充分反应1h, 洗膜, 借助Clinx science instruments co进行发光显影, 利用Image J Program软件进行图像分析。GAPDH为内参。
1.3 统计学方法所有实验均重复3次。实验结果以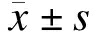 表示。SRB实验及凋亡实验资料为多组重复测量资料, 通过SPSS23.0软件进行多因素重复测量方差分析, 两两比较用t检验。自噬相关蛋白表达分析采用单因素方差分析, 两两比较采用Bonferroni检验。P < 0.05为差异具有统计学意义。
表示。SRB实验及凋亡实验资料为多组重复测量资料, 通过SPSS23.0软件进行多因素重复测量方差分析, 两两比较用t检验。自噬相关蛋白表达分析采用单因素方差分析, 两两比较采用Bonferroni检验。P < 0.05为差异具有统计学意义。
与对照组相比, 葫芦素B各浓度组能显著抑制人MCF-7细胞增殖, 差异具有统计学意义(P < 0.05), 且随着药物浓度的增加及作用时间的延长, 对人MCF-7细胞增殖抑制作用增强。见图 1、表 1。
|
图 1 葫芦素B抑制MCF-7增殖活性 |
| 表 1 各组葫芦素B不同时间点对MCF-7抑制率比较(%,x±s) |
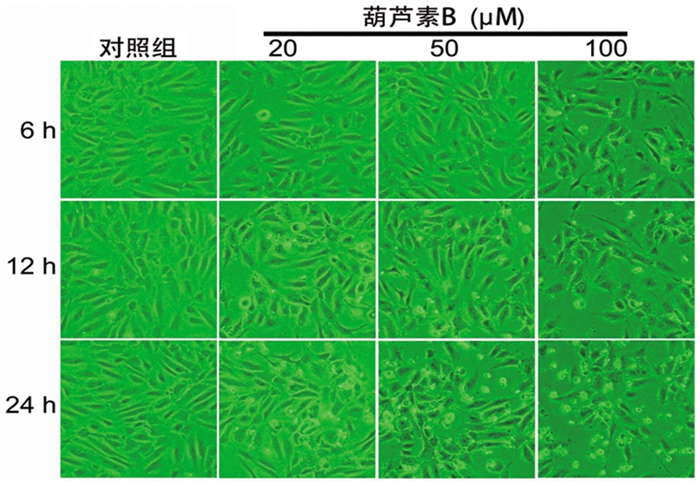
因6h时各浓度组增殖抑制率均无明显变化, Hoechst 33258染色实验仅进行12h、24h时的检测。与对照组相比, 葫芦素B各浓度组能显著增强人MCF-7细胞凋亡, 差异具有统计学意义(均P < 0.05), 且随着药物浓度的增加, 作用时间的延长, 凋亡小体明显增多。见图 2、表 2。
|
图 2 葫芦素B对人MCF-7细胞凋亡的影响 注:白色箭头为凋亡小体。 |
| 表 2 各组不同时间细胞凋亡率比较(%,x ±s) |
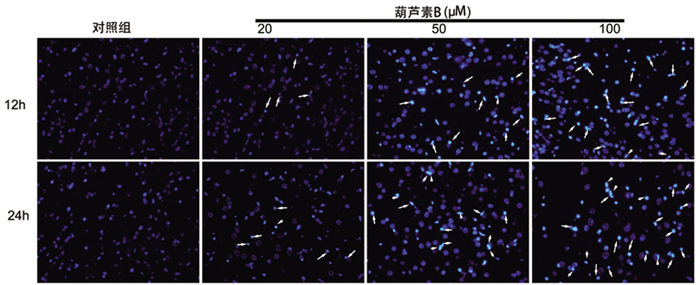
与对照组相比, 葫芦素B各浓度组LC3-Ⅱ表达水平显著升高, LC3-Ⅰ、P62表达水平显著下降(均P < 0.05)。见图 3。
|
图 3 葫芦素B可激活MCF-7细胞自噬 注:a,c为葫芦素B作用12h,24h自噬相关蛋白的表达,b为a中LC3-Ⅱ/LC3-Ⅰ对应柱状图,d为c中LC3-Ⅱ/LC3-Ⅰ对应柱状图。*表示20μM组与对照组相比P<0.05,#表示50μM组与20μM组相比P<0.05、##表示100μM组与50μM组比较P<0.05。 |
乳腺癌是严重威胁女性生命健康的疾病, 目前发病率已居女性恶性肿瘤第一位[3-4]。化疗、内分泌治疗、放疗以及靶向治疗可改善部分患者预后。其中Luminal亚型的乳腺癌约占乳腺癌患者70%, 因激素受体表达阳性, 此分子分型的患者可通过内分泌治疗药物如三苯氧胺获益[5]。但同其他治疗方法一样, 原发性或继发性耐药对部分患者而言不可避免。中药提取物葫芦素B可逆转乳腺癌细胞对多柔比星的耐药, 还可抑制乳腺癌细胞的迁移和侵袭、诱导三阴性乳腺癌细胞的凋亡[6-7]。
乳腺癌Luminal亚型常用的细胞株为MCF-7细胞株, 此类细胞虽因表达雌激素受体和/或孕激素受体而预后稍好, 但同样具有癌细胞的特点: 通过一系列分子机制改变细胞生物学行为, 增强增殖活性, 抑制凋亡、自噬。葫芦素B是从葫芦科植物中提取的四环三萜类化合物, Sinha等报道葫芦素B可通过调控VEGF参与的FAK/MMP-9信号轴抑制血管的生成, 从而抑制癌细胞增殖和转移[8]。本实验中, 我们发现升高葫芦素B的浓度或延长作用时间, 可明显抑制MCF-7细胞的增殖活性。结肠癌中研究显示葫芦素B10μM作用24h可使细胞增殖活性下降30%[9], 本结果显示葫芦素B 100μM作用24h对肿瘤细胞增殖活性抑制率仅24%左右, 可能与细胞株分化程度、对药物的敏感性、所用药物纯度不同有关。本实验观察到葫芦素B抗癌效果具有时间和浓度依赖性, 该特征在乳腺癌MDA-MB-231细胞株中也得到证实[10]。另有文献报道, 葫芦素B可通过调控AKT和CDK2抑制乳腺癌细胞生长, 诱导其凋亡, 并使细胞周期阻滞于G2/M期[11]。本研究中, 凋亡小体的形成也证实葫芦素B具有诱导MCF-7细胞凋亡的作用, 100μM组在12h和24h时凋亡率基本稳定在13%。此外, 数据表明葫芦素B可促进MCF-7细胞中氧自由基的生成, 诱导DNA损伤, 增强自噬。自噬是细胞自我降解以再次利用细胞内成分的过程, 参与癌症的发生和进展。LC3是一种微管蛋白, 自噬信号使其活化成为LC3-Ⅰ, 后者再通过Atg5-Atg12-Atg16L复合物的催化反应形成LC3-Ⅱ, LC3-Ⅰ与LC3-Ⅱ对自噬活性的参考价值已被普遍接受。P62是自噬过程中经典的底物蛋白, 其通过与LC3相互作用使自噬溶酶体降解, P62水平随LC3-Ⅱ表达的增高而降低。研究显示葫芦素B可通过调控CIP2A/PP2A/mTORC1信号轴升高自噬相关蛋白LC3-Ⅱ的表达水平[12]。本文结果显示随药物浓度及作用时间增加, LC3-Ⅱ表达水平升高, P62表达水平下降, 100μM组作用12h时自噬活性基本稳定。
葫芦素B对乳腺癌小鼠肿瘤生长的抑制作用已经体内实验验证, 仅有部分病例出现血糖水平降低, 对动物组织、器官的相关分析未见明显毒副作用[3]。相比化疗药物及放疗的毒副反应、靶向治疗费用昂贵等缺点, 中药提取物葫芦素B抑制人MCF-7细胞增殖、诱导凋亡和自噬作用效果温和、费用低廉, 将来有望成为乳腺癌的辅助治疗药物。
| [1] |
Sukant G, Sunil K, Renu W. Cucurbitacin B and cancer intervention: Chemistry, biology and mechanisms(Review)[J]. Int J Oncol, 2017, 52(1): 19-32. DOI:10.3892/ijo.2017.4203 |
| [2] |
Ren G, Sha T, Guo J, et al. Cucurbitacin B induces DNA damage and autophagy mediated by reactive oxygen species(ROS)in MCF-7 breast cancer cells[J]. J Nat Med, 2015, 69(4): 522-530. DOI:10.1007/s11418-015-0918-4 |
| [3] |
张淑君, 单梦圆, 翟羽佳, 等. PIWIL1基因沉默对人乳腺癌MCF-7细胞增殖的影响[J]. 济宁医学院学报, 2019, 42(2): 117-121. DOI:10.3969/j.issn.1000-9760.2019.02.010 |
| [4] |
肖斌, 温嘉欣, 赵超然, 等. Luminal亚型乳腺癌细胞与正常乳腺细胞的circRNA表达谱差异分析[J]. 南方医科大学学报, 2018, 38(8): 1014-1019. DOI:10.3969/j.issn.1673-4254.2018.08.19 |
| [5] |
Siegel RL, Miller KD, Dvm AJ, et al. Cancer statistics, 2017[J]. CA: A Cancer J Clin, 2017, 67(1): 7-30. DOI:10.3322/caac.21387 |
| [6] |
蔡芬, 段超, 黄秋月, 等. 葫芦素B逆转人乳腺癌细胞MCF-7/Dox多柔比星耐药的作用及机制研究[J]. 湖北医药学院学报, 2017, 36(1): 28-35. DOI:10.13819/j.issn.1006-9674.2017.01.007 |
| [7] |
梁菁. 葫芦素B通过改变细胞生物力学性质抑制乳腺癌细胞迁移和侵袭[D]. 天津: 天津医科大学, 2019.
|
| [8] |
Sinha S, Khan S, Shukla S, et al. Cucurbitacin B inhibits breast cancer metastasis and angiogenesis through VEGF-mediated suppression of FAK/MMP-9 signaling axis[J]. Int J Biochem & Cell Biol, 2016, 77(Pt A): 41-56. DOI:10.1016/j.biocel.2016.05.014 |
| [9] |
Dandawate P, Subramaniam D, Panovich P, et al. Cucurbitacin B and I inhibits colon cancer growth by targeting the Notch signaling pathway[J]. Sci Rep, 2020, 10(1): 1290-1305. DOI:10.1038/s41598-020-57940-9 |
| [10] |
Luo WW, Zhao WW, Lu JJ, et al. Cucurbitacin B suppresses metastasis mediated by reactive oxygen species(ROS)via focal adhesion kinase(FAK)in breast cancer MDA-MB-231 cells[J]. 中国天然药物: 英文版, 2018, 16(1): 10-19. DOI:10.1016/S1875-5364(18)30025-6 |
| [11] |
Jin ZQ, Hao J, Yang X, et al. Higenamine enhances the antitumor effects of cucurbitacin B in breast cancer by inhibiting the interaction of AKT and CDK2[J]. Oncol Rep, 2018, 40(4): 2127-2136. DOI:10.3892/or.2018.6629 |
| [12] |
Duangmano S, Sae-Lim P, Suksamrarn A, et al. Cucurbitacin B inhibits human breast cancer cell proliferation through disruption of microtubule polymerization and nucleophosmin/B23 translocation[J]. BMC Complement Altern Med, 2012, 12: 185-210. DOI:10.1186/1472-6882-12-185 |



