2. 济宁医学院基础医学院, 济宁 272067
2. College of Basic Medicine, Jining Medical University, Jining 272067, China
正己烷是一种具有高度挥发性、脂溶性,在体内具有蓄积作用的高危害性直链烷烃类毒物,主要通过呼吸道进入人体并产生毒性作用。近年来由于长期接触正己烷引起的职业性慢性中毒患者数量呈上升趋势[1-2]。长期接触较高水平正己烷可以引起以多发性周围神经损害为主的慢性、亚急性中毒或中枢神经系统损伤[2-4],可引起肢体骨骼肌萎缩、肌力下降等,影响运动功能[5-6]。后者可能与周围运动神经的损伤有关,目前尚未阐明正己烷直接损伤骨骼肌的作用机制。骨骼肌主司机体运动,对能量的需求量较大,而线粒体是组织细胞的主要功能结构。鉴于此,本研究对正己烷亚急性染毒小鼠骨骼肌线粒体融合与分裂基因mRNA进行测定,观察小鼠骨骼肌超微机构,旨在为正己烷对骨骼肌毒性作用发生机制的研究提供基础资料。
1 材料与方法 1.1 材料 1.1.1 实验动物及分组选用40只成年昆明小鼠,雌雄各半,体重(20±2)g,由山东省实验动物中心提供,实验动物合格号:SCXK(鲁)20140006。将小鼠随机分为高、中、低染毒剂量组和对照组,每组10只。所有实验动物均遵循国家实验动物饲养管理条例和使用指南以及济宁医学院实验动物管理条例。
1.1.2 仪器与试剂正己烷(天津市科密欧化学试剂有限公司);C1000 Touch荧光定量PCR仪(Bio-Rad Laboratories)、Arktik5020型多功能PCR仪(Thermo Fisher Scientific)、Trizol试剂(上海生工生物有限公司)、M-MuLV第一链cDNA合成试剂盒(上海生工生物有限公司)、2×SG Fast Qpcr Master Mix(上海生工生物有限公司);JEOL-1200EX射透电镜(日本)。
1.2 方法 1.2.1 正己烷亚急性染毒实验根据预实验结果,确定高、中、低染毒剂量组染毒剂量分别为2000mg/kg、1000mg/kg、500mg/kg。使用市售食用豆油对正己烷原液稀释,每只小鼠灌胃量为0.2ml/d,染毒1次/d,共28d。对照组采用0.2ml/d豆油灌胃,每天灌胃1次,共28d。
1.2.2 标本采集染毒实验结束后,将小鼠脱臼处死,在冰盘上迅速取小鼠一侧腓肠肌置于-80℃冰箱中用于骨骼肌融合与分裂基因mRNA的测定。用刀片迅速取小鼠另一侧小腿腓肠肌,大小约为1mm×1mm×1mm,立刻放入3%戊二醛固定液内,用于超微结构的观察。只对对照组和高剂量染毒组进行超微结构的观察。
1.2.3 骨骼肌超微结构观察按常规TEM样品制备法依次进行漂洗、1%锇酸(OsO4)固定、漂洗、脱水、浸透、Epon812包埋;半薄切片定位后用LKB-V型超薄切片机进行超薄切片;柠檬酸铅和醋酸铀电子染色。用JEOL-1200EX射透电镜观察腓肠肌细胞的超微结构。
1.2.4 Mfn1、Mfn2与Fis1mRNA表达的检测将各组骨骼肌制成匀浆并提取总RNA,在PCR仪中逆转录反应,反应结束后配制逆转录反应混合液。对逆转录所取得的cDNA进行实时荧光定量PCR,以对照组表达量为基准,计算各组Mfn1、Mfn2与Fis1mRNA的相对含量。Mfn1基因引物序列, 上游:5′-TGAGATTTGTCGCCTGTCTG-3′,下游:5′-TTTCTTCCCATGCCATCTTC-3′;Mfn2基因引物序列, 上游:5′-GTCTTGAAATGCGGGAAGAG-3′,下游:5′-CTGCCTTTCCACTTCCTCTG-3′;Fis1基因引物序列, 上游:5′-GCAGTTTGAATACGCCTGGT-3′,下游5′-ATAATCCCGCTGCTCCTC TT-3′。
1.3 统计学方法使用SPSS 21.0软件对数据进行统计学分析和描述,计量资料的表示用x±s。采用方差分析进行各组间总体比较,Dunnett-t检验作进一步两两比较,P < 0.0167为差异具有统计学意义。
2 结果 2.1 动物一般情况高、中、低染毒剂量组小鼠染毒5~10d后,出现活动减少、饮食量减少、毛色暗淡、脱毛等表现,高、中剂量染毒组表现尤其明显,各组小鼠无死亡。
2.2 各组骨骼肌线粒体分裂与融合基因mRNA的表达各组骨骼肌线粒体分裂融合基因Mfn1、Mfn2 mRNA的表达差异具有统计学意义(FMfn1=47.37, FMfn2=29.59, P均 < 0.001)。与对照组比较,Mfn1mRNA、Mfn2mRNA的表达均显著降低(F=0.63,P < 0.01)。各组间Fis1mRNA的表达无统计学差异(P=0.06)。见图 1。
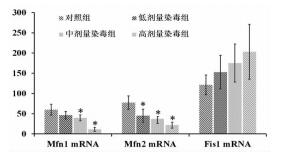
|
图 1 各组骨骼肌线粒体分裂与融合基因的表达情况 注:与对照组相比,*P < 0.01 |
对照组可见肌原纤维长轴呈规则的明暗交替,明带(I带)和暗带(M带)清晰可见,线粒体数量多且形态饱满。高剂量染毒组可见肌原纤维排列紊乱且不规则,发生扭曲、缺失,肌小节和肌丝溶解,局部肌小节被细胞器占据,同时伴线粒体数量减少、有些线粒体嵴缺失而呈空泡化。见图 2。

|
图 2 各组小鼠骨骼肌超微结构(15000×) 注:对照组,肌小节排列整齐,形态完整(A); 肌原纤维分布有序,呈现规则的明暗交替,线粒体聚集且结构正常(B); 高剂量染毒组,部分肌小节出现排列紊乱无序,Z线不对称,肌小节被细胞器占据(C); 部分肌小节Z线消失,肌小节有溶解趋势(D); 线粒体分布不均且密度较低,线粒体基质空化(E); 肌小节溶解,线粒体分布不均且密度较低(F) |
由线粒体Mfn编码的线粒体融合蛋白共包含两种分子,即Mfn1与Mfn2,两者都位于且作用于线粒体外膜,在调节控制线粒体进行融合的过程中具有重要作用[7]。线粒体分裂蛋白1(Fis1)同样定位在线粒体外膜上,可以把胞浆中的动力相关蛋白1募集到线粒体外膜上对应的分裂点,是线粒体分裂的重要调控蛋白[8]。研究表明线粒体表面存在的Fis1分子数量能够决定该线粒体的分裂频率,并通过促进线粒体裂解的机制来诱导细胞凋亡[9-10]。本实验通过对正己烷染毒小鼠骨骼肌线粒体中融合分裂相关基因的相对含量进行测定,以探讨正己烷是否可能通过对线粒体融合与分裂基因的影响而影响骨骼肌的功能。
本文结果显示,正己烷亚急性染毒后,染毒小鼠骨骼肌Mfn1、Mfn2 mRNA的表达均较对照组出现明显下降趋势,且这种趋势会随着染毒剂量的增加而更为明显。但Fis1 mRNA的表达在各组间无显著性差异。Mfn1、Mfn2 mRNA表达显著下降而Fis1 mRNA的表达相对正常,则可能影响到骨骼肌线粒体的稳态。此时由于Mfn1、Mfn2 mRNA表达受到抑制,线粒体的稳态向分裂趋势转移,导致线粒体数量增多、功能下降,其能量代谢出现紊乱。而骨骼肌在实现机体运动功能时对于能量的需求较为旺盛,线粒体过度分裂将损害线粒体能量代谢[11],后者即可造成骨骼肌功能的下降。
高剂量染毒组骨骼肌超微结构则表现为线粒体分布不均且密度降低,有些线粒体出现嵴缺失而呈空泡化;肌小节出现排列紊乱、扭曲,Z线不对称,有溶解趋势,有些肌小节被细胞器占据。超微结构的这些变化,可能与线粒体能量代谢紊乱有关。线粒体融合-分裂失衡,导致其数量变化;而线粒体嵴的基粒中含有ATP合成酶,能利用呼吸链产生的能量合成ATP,嵴的缺失必然导致线粒体能量代谢异常。这可能是线粒体分布不均和密度下降的主要原因[12]。线粒体能量代谢异常又使肌纤维处于相对缺氧状态,从而出现其结构的变化[13-14]。
总之,在正己烷亚急性染毒的作用下,小鼠骨骼肌的线粒体形态与功能出现异常,导致骨骼肌形态和功能的变化。这种变化与正己烷所致周围神经损伤的联系及其深层机制,尚需进一步研究。
| [1] |
张健杰, 司徒洁, 邓立华, 等. 62例亚急性正己烷中毒临床分析[J]. 中华劳动卫生职业病杂志, 2013, 31(8): 622-623. DOI:10.3760/cma.j.issn.1001-9391.2013.08.023 |
| [2] |
Vyskocil A, Leroux T, Truchon G, et al. Occupational ototoxicity of n-hexane[J]. Hum Exp Toxicol, 2008, 27(6): 471-476. DOI:10.1177/0960327108093719 |
| [3] |
Puri V, Gupta AD, Chaudhry N, et al. Reversible cerebral and brain stem dysfunction in n-Hexane neuropathy[J]. Ann Indian Acad Neurol, 2015, 18(4): 464-467. DOI:10.4103/0972-2327.160088 |
| [4] |
高俊发, 张秀英, 林青, 等. 正己烷染毒小鼠学习记忆能力与脑组织神经生长因子及其手提表达的变化[J]. 中华劳动卫生职业病杂志, 2019, 37(3): 217-220. DOI:10.3760/cma.j.issn.100-9391.2019.03.013 |
| [5] |
樊春月, 黄汉林, 陈嘉斌, 等. 38例职业性慢性正己烷中毒的临床及神经-肌电图特点[J]. 中国工业医学杂志, 2016, 29(5): 323-328. DOI:10.13631/j.cnki.zggyyx.2016.05.001 |
| [6] |
Asaduzzaman AK, Chun BS. Characterization of digestive enzymes from de-oiled mackerel (Scomber japonicus) muscleobtained by supercritical carbon dioxide and n-hexane extraction as a comparative study[J]. J Food Sci Technol, 2015, 52(6): 3494-3503. DOI:10.1007/s13197-014-1408-5 |
| [7] |
付玉环, 姜广建, 夏庆安, 等. 线粒体融合蛋白Mfn1/2的结构和功能[J]. 生命的化学, 2007, 27(6): 511-513. DOI:10.3969/j.issn.1000-1336.2007.06.015 |
| [8] |
Zhang Z, Sliter DA, Bleck CKE, et al. Fis1deficiencies differentially affect mitochondrial quality in skeletal muscle[J]. Mitochondrion, 2019, 49: 217-226. DOI:10.1016/j.mito.2019.09.005 |
| [9] |
Yu R, Jin SB, Lendahl U, et al. Human Fis1 regulates mitochondrial dynamics through inhibition of the fusion machinery[J]. EMBO J, 2019, 38(8): e99748. DOI:10.15252/embj.201899748 |
| [10] |
孙卫东, 刘晓然, 姜宁, 等. 骨骼肌线粒体对细胞能量需求的快速应答:mfn1/2与fis1基因在急性运动中的动态表达[J]. 中国运动医学杂志, 2008, 27(5): 544-550. DOI:10.3969/j.issn.1000-6710.2008.05.001 |
| [11] |
赵斐, 靳庆勋, 乔海荣, 等. 有氧运动改善高脂膳食诱导的胰岛素抵抗:增强骨骼肌线粒体融合与分裂及功能[J]. 中国运动医学杂志, 2012, 31(1): 24-30. DOI:10.16038/j.1000-6710.2012.01.006 |
| [12] |
王雅一. 大鼠骨骼肌超微结构及恢复因子的变化[J]. 体育科学研究, 2014, 18(3): 62-65. DOI:10.19715/j.tiyukexueyanjiu.2014.03.014 |
| [13] |
Bigler M, Koutsantonis D, Odriozola A, et al. Morphometry of skeletal muscle capillaries:the relationship between capillary ultrastructure and ageing in humans[J]. Acta Physiol (Oxf), 2016, 218(2): 98-111. DOI:10.1111/apha.12709 |
| [14] |
Rengo JL, Callahan DM, Savage PD, et al. Skeletal muscle ultrastructure and function in statin-tolerant individuals[J]. Muscle Nerve, 2016, 53(2): 242-251. DOI:10.1002/mus.24722 |



