2. 济宁医学院基础医学院, 济宁 272067
2. College of Basic Medicine, Jining Medical University, Jining 272067, China
к-卡拉胶(к-carrageenan, к-CA)是从红色海藻中提取的一种天然多糖[1]。由于提取工艺简单、高效,к-CA这种海洋多糖作为原材料得以大规模应用。к-CA分子链是由β-(1, 3)-D-半乳糖-4-硫酸基与α-(1, 4)-(3, 6-内醚)-D-半乳糖组成的二糖交替共聚物[2],这条链在降温的水溶液里或加入某种盐(如KCl)可以完成由杂乱线状的线圈向有序螺旋的构象变化[3];通过氢键作用或者离子间作用更容易形成双螺旋结构,实现凝胶化过程。然而,单纯к-CA凝胶脆弱且有刚性,并且可能严重析出水分[4]。因而,к-CA复合凝胶在科研领域和制药工业应用中越来越受关注[4-7]。由于复合凝胶内部不同多糖分子链的极性基团影响而发生协同作用[8],极大改善了CA凝胶的性能,如凝胶强度增大等[9]。天然多糖黄原胶(Xanthan gum, XG),是医药工业应用价值较高的微生物多糖辅料[10]。它是由油菜黄单孢菌分泌的多糖,分子主链由β-(1, 4)-D-葡萄糖构成,主链每间隔两个葡萄糖单元就出现一个短的侧链,其侧链由相连的三个单糖组成:甘露糖-葡萄糖-甘露糖,其中第一个甘露糖通常被乙酰基修饰而连接着主链,末端的甘露糖常与丙酮酸发生缩醛反应而被结合,中间的葡萄糖一般为葡萄糖醛酸的形式[11]。XG分子主链可以被侧链缠绕进而形成有序螺旋,其二级结构可以由两个单链或者一个双螺旋构成[12],XG的分子结构特点使它可以充当к-CA凝胶的稳定剂。单独XG水凝胶具有弱凝胶性质,至今没有用于载药的报道[13]。而利用к-CA水凝胶进行制剂学研究的报道也不多见[14]。目前关于к-CA和XG的复合凝胶体系研究未见报道。本文研究合成了新型к-CA/XG复合凝胶,观测了其结构形貌、流变学特性和形成机制等,并应用其制备了左氧氟沙星(levofloxacin, LVFX)新型抗菌制剂。
1 实验部分 1.1 试剂与仪器к-CA(试剂级,福建绿麒食品胶体有限公司),其平均分子量4.2×105 Dalton,含SO42-为20.5wt%;原子吸收光谱法测得干样品中K+含量为5.23%,而痕量的Na+ 或Ca2+未检出。XG(试剂级,安徽酷尔生物工程有限公司),其平均分子量5.1×106 Dalton;采用文献方法[15]测得其分子内丙酮酸含量为5.07wt%;原子吸收光谱法测得干样品中K+含量为0.049%。Mueller-Hinton 琼脂(杭州微生物试剂有限公司),大肠埃希氏菌(ATCC25922)和金黄色葡萄球菌(ATCC25923)由济宁医学院病原生物学教研室提供。乳酸LVFX(原料药,北京亚赛尔科技有限公司);丙酮酸(生化试剂,国药集团化学试剂有限公司),其它试剂均为分析纯。
Olympus BX51光学显微镜;German Zeiss FESEM扫描电子显微镜;German Bruker/D8ADVANCE X射线衍射仪;Thermo Haake RS300流变仪;岛津IRAffinity-1S傅里叶变换红外光谱仪;PerkinElmer AAnalyst 800原子吸收光谱仪。
1.2 复合凝胶的制备称取0.1754g к-CA和0.0753g XG放入比色管中,然后加蒸馏水6ml,超声20min,于65℃下恒温搅拌8h,冷却到室温直至凝胶形成,倒置比色管后凝胶不能流动即可。将所得凝胶,置于真空干燥箱内40℃干燥24h,得到干凝胶样品。
1.3 光学显微镜(OM)和电子显微镜(SEM)观察用OM观察凝胶样品结构形貌,并对典型形貌拍照记录。将干燥所得的干凝胶样品进行喷金,并用SEM观察干凝胶结构形貌,得到SEM图片。
1.4 流变学分析采用Thermo Haake RS300流变仪堆板系统(直径35mm,间隙0.105mm),25℃进行动态应变扫描,在线性粘弹范围内对各凝胶样品扫频分析。随机抽取水凝胶样品,平行测定三次求平均值。
1.5 红外光谱(FTIR)分析采用岛津IRAffinity-1S傅里叶变换红外光谱仪,KBr压片法,得干凝胶样品的红外光谱图。
1.6 X光粉末衍射法(XRD)将干凝胶样品置于样品池,采用German Bruker/D8ADVANCE X射线衍射仪扫描,并记录谱图。
1.7 载药凝胶的制备首先,使用灭菌蒸馏水配制一定浓度的LVFX溶液,然后分别稀释成16μg/ml(用于金黄色葡萄球菌)和4μg/ml(用于大肠埃希氏菌)两种LVFX稀溶液。称取0.1754g к-CA和0.0753g XG放入比色管中,然后在搅拌下加入6ml LVFX溶液,超声20min,65℃恒温搅拌8h,冷却到室温直至凝胶形成,倒置比色管后凝胶不能流动即可。所得两种载药量不同的凝胶(备用),可分别用于金黄色葡萄球菌和大肠埃希氏菌的抑菌测试。
1.8 载药凝胶的抑菌测试采用自制的牛津杯法测试LVFX载药凝胶的抑菌效果,模型菌株是金黄色葡萄球菌和大肠埃希氏菌,采用无菌条件下涂布划线法接种。分别将200μl药物凝胶和200μl空白对照凝胶注入含有105CFU/ml测试菌液的培养皿,37℃培育24h。通过测量凝胶斑点区的抑菌圈直径大小来确定药物凝胶的抑菌效果,使用与药物凝胶中同浓度的LVFX溶液做阳性抗菌对照物。所有试验结果都是三次平行测定的平均值,利用SPSS 19.0统计软件,方差分析采用Duncan法,P<0.05为差异有统计学意义。
2 结果与讨论 2.1 溶胶与凝胶相变过程在65℃加热和搅拌8h下,热к-CA/XG溶胶(图 1a)经过冷却形成了半透明的复合凝胶(图 1b);若在к-CA/XG溶胶体系中加入少量LVFX,可以得到载药凝胶(图 1c)。另一个试验表明,单独的к-CA溶胶冷却后形成凝胶的最低浓度不能低于2.0wt%,这与Iijima等[16]研究结果是一致的。而复合凝胶体系中,我们采用к-CA/XG质量配比7 ∶3,总浓度4.0wt%,足以形成稳定的典型凝胶体系(见1.2部分)。采用65℃加热条件,能够使多糖形成线状的线圈高分子溶液[17],但过高的温度不利于所载药物稳定存在。к-CA原料中的KCl含量为K+ 5.23%,有利于凝胶的形成[18]。试验表明,所载药物LVFX不利于凝胶的形成,但16μg/ml的LVFX浓度足以满足抑菌试验要求。

|
图 1 一定条件下к-CA/XG复合凝胶体系的相变过程 |
鲜凝胶具有光滑和连续的表面(图 2a),无任何裂缝,说明复合凝胶具有一个黏性的基质,两种多糖分子构筑了持续稳定的混合体系,大量水分子被捕获和吸附在凝胶网络中。然而,SEM可以观察到干凝胶纤维状纹理为主的多形态结构(图 2b, c, d)。首先,复合凝胶的表面呈现了一些带状和层状结构(图 2b),这是去除溶剂水之后所暴露的凝胶真实情况。带状结构宽度0.5~1.0μm且长度约3.0μm,它们被黏附在凝胶表层保住水分,也保护内部结构。我们推断,这可能是两种多糖分子链交织形成的螺旋状结构的聚集体。从图 2c和图 2d可以更清晰地观察到不同角度刚性纤维状的凝胶基质断面,主要是由к-CA形成的凝胶骨架结构。这是体系在溶胶状态下随机地、以不同胶凝速率进行凝胶化的结果[16]。这些纤维之间的间隙,为装载药物分子提供了空间。由于添加的药物量很小,载药凝胶的形貌和结构没有受到影响,依然保持着空白凝胶的结构形貌。

|
图 2 к-CA/XG复合凝胶的光学显微镜与扫描电镜图 |
复合凝胶样品的流变学测量,按正弦剪切模式提供了储能模量(G’)和耗能模量(G”)。在频率扫描测试中(图 3a),在1Pa的外加应力条件下,复合凝胶样品的G’和G”值随着频率的增加有轻微的增长。因此,某种程度上,该复合凝胶仍呈现出弱凝胶的性质[3]。这可能是由于凝胶中黄原胶侧链参与影响的结果。但是,在整个频率扫描过程中,随着扫描频率越来越大,G’>G”是保持不变的。这说明复合凝胶中多糖分子链被剪切形变释放的能量更多的转化并储存成弹性形变,在黏性流动中损失较少,表现出正常的凝胶特性。在振幅扫描测试过程中(图 3b),在频率1Hz下以指数形式施加应力,复合凝胶结构的应力屈服值只有25Pa左右,这说明黄原胶分子的参与使得复合凝胶成为一个柔软、富有黏弹性的胶状网络结构,这可能更有利于药物的吸附和控制释放。
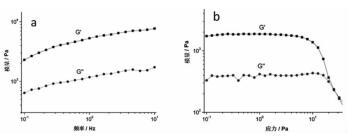
|
图 3 к-CA/XG复合凝胶的动态流变图 注:a.频率扫描图;b.振幅扫描图 |
复合凝胶内部分子的官能团之间的相互作用情况可以由红外光谱来反映。首先,3100cm-1~3500cm-1之间的吸收带归属为多糖分子内O-H键的伸缩振动吸收(图 4)。复合凝胶干样品呈现3392cm-1的吸收(图 4a)反映了к-CA/XG混合体系中两种多糖分子的-OH之间氢键作用(图 5)。因为这是к-CA分子O-H键的3376cm-1吸收(图 4b)与XG分子O-H键的3427cm-1吸收迁移所致[19-20],即两个к-CA分子之间O-H氢键弱化而к-CA分子与XG分子之间O-H氢键增强。此外,XG的原料图 4c中,两个吸收峰1718cm-1和1419cm-1可归属为–COO-基团中C=O的不对称伸缩振动和C-O对称振动吸收[8-23],但在干凝胶样品吸收中后者发生红移至1406cm-1的位置(图 4a)。这很有可能是XG分子中–COO-基团通过K+-离子桥(图 5)与к-CA分子发生了作用[8-23]。比较图 4a和图 4b,846cm-1吸收峰归属为半乳糖-4-硫酸基中糖环C4-OSO3-键的吸收,形成凝胶前后这个C-O键的846cm-1吸收未受影响,说明K+-离子桥不会完全通过硫酸基结合[24],也有可能通过3, 6-内醚的氧原子结合(图 5),甚至部分硫酸基还未被XG分子打扰。因为从к-CA原料(图 4b)到干凝胶(图 4a),硫酸基中S=O键的1157cm-1吸收[25],以及3, 6-内醚的929cm-1吸收[26],均发生很小的迁移现象。通过以上分析,我们可以推断к-CA分子与XG分子之间的作用力,主要是氢键作用和K+-离子桥(图 5),这有助于我们理解两种多糖分子之间的物理交联所形成凝胶的微结构及其形成机制。另外,载药凝胶中,因为载药量甚微,药物分子的红外吸收峰被凝胶基质掩盖。
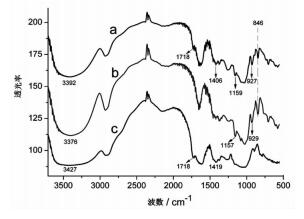
|
图 4 к-CA/XG复合凝胶及其原料的红外光谱对比图 注:a.к-CA/XG复合干凝胶;b.к-CA原料;c.XG原料 |
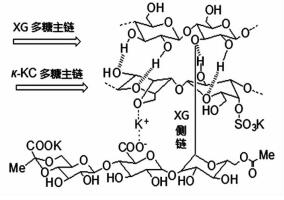
|
图 5 复合凝胶内部к-CA/XG分子之间的氢键作用(虚线)和K+-离子桥(斑点线)示意图 |
在к-CA原料中,呈现以2θ=20°为中心的一个宽泛峰值,表明к-CA原料是无定形状态[27-28]。к-CA原料还有一个明显的2θ=28.4°尖峰,这是原料中无机盐KCl晶体的存在,而非卡拉胶本身结构造成的[27-28](图 6a)。形成复合凝胶后,2θ=28.4°的尖峰基本消失了(图 6b)。这说明K+不再以无机盐形式存在,而是被溶解后参与了两个多糖分子间的结合位点以形成凝胶。另一个原料XG,也呈现出一个宽泛2θ=21°峰(图 6c),表明了它的无定形结构[29]。以此为基础所形成的复合凝胶(图 6b),也只有一个宽泛2θ=20.2°峰,说明复合凝胶也是无定形结构,并没有十分有序的新结构形成。
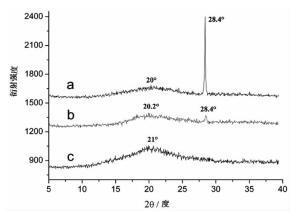
|
图 6 к-CA/XG复合凝胶及其原料的XRD图谱对比 注:a.к-CA原料;b.к-CA/XG复合干凝胶;c.XG原料 |
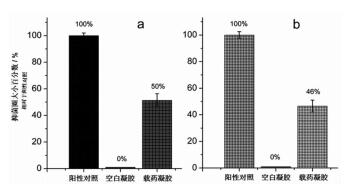
利用革兰阳性金黄色葡萄球菌和革兰阴性大肠埃希氏菌为模型菌株,自制的牛津杯法测试LVFX载药凝胶的抑菌效果,所得载药凝胶的斑点区抑菌圈增长情况拍照如图 7。我们观察到,无论是对于金黄色葡萄球菌(图 7a)还是对于大肠埃希氏菌(图 7b),载药凝胶斑点周围都出现了十分清晰抑菌圈。而同样条件下,未加LVFX的空白凝胶斑点周围则存在密集的细菌菌落。对于金黄色葡萄球菌(图 8a)的作用,载药凝胶斑点周围呈现的抑菌圈直径相对于阳性对照物来说达到50%;对于大肠埃希氏菌(图 8b)的作用,载药凝胶斑点周围呈现的抑菌圈直径相对于阳性对照物的作用达到46%。这些现象表明,к-CA/XG复合凝胶本身没有抑菌作用,而装载了LVFX的载药凝胶直接地表现出抑菌效果。因此,新获得的к-CA/XG复合凝胶可以应用于抗菌药物的制剂工业生产。

|
图 7 к-CA/XG载药凝胶及空白凝胶抑制菌株的抑菌圈照片 注:a. 金黄色葡萄球菌;b. 大肠埃希氏菌;与载药凝胶中同浓度LVFX溶液作阳性对照,37℃下培育24h |
|
图 8 к-CA/XG载药凝胶和空白凝胶抑制菌株的抑菌圈定量分析 注:a.金黄色葡萄球菌;b.大肠埃希氏菌;阳性对照为相同浓度LVFX溶液 |
利用廉价易得、生物兼容的天然多糖к-CA和XG做原料,可以开发研究新型的复合凝胶。研究表明,к-CA/XG复合凝胶中两种多糖分子之间主要以氢键和离子桥相结合,形成带状或纤维状纹理的微结构形貌、表现为弱凝胶的流变学特性等。к-CA/XG复合凝胶是一种良好的药物载体,将к-CA/XG复合凝胶应用于制作抗菌药物制剂,取得了明显的抗菌效果。
| [1] |
van de Velde F. Structure and function of hybrid carrageenans[J]. Food Hydrocolloid, 2008, 22(5): 727-734. DOI:10.1016/j.foodhyd.2007.05.013 |
| [2] |
Viebke C, BorgstrSm J, Piculell L. Characterisation of kappa-andiota-carrageenan coils and helices by MALLS/GPC[J]. Carbohydr Polym, 1995, 27(2): 145-154. DOI:10.1016/0144-8617(95)00017-2 |
| [3] |
Chen Y, Liao ML, Dunstan DE. The rheology of K+-к-Carrageenan as a weak gel[J]. Carbohydr Polym, 2002, 50(2): 109-116. DOI:10.1016/s0144-8617(02)00009-7 |
| [4] |
Mihaila SM, Gaharwar AK, Reis RL, et al. Photocrosslinkable kappa-carrageenan hydrogels for tissue engineering applications[J]. Adv Healthc Mater, 2013, 2(6): 895-907. DOI:10.1002/adhm.201200317 |
| [5] |
Yegappan R, Selvaprithiviraj V, Amirthalingam S, et al. Carrageenan based hydrogels for drug delivery,tissue engineering and wound healing[J]. Carbohydr Polym, 2018, 198: 385-400. DOI:10.1016/j.carbpol.2018.06.086 |
| [6] |
Brenner T, Wang Z, Achayuthakan P, et al. Rheology and synergy of κ-carrageenan/locust bean gum/konjac glucomannan gels[J]. Carbohydr Polym, 2013, 98(1): 754-760. DOI:10.1016/j.carbpol.2013.04.020 |
| [7] |
El-Aassar MR, El Fawal GF, Kamoun EA, et al. Controlled drug release from cross-linked κ-Carrageenan/hyaluronic acid membranes[J]. Int J Biol Macromol, 2015, 77: 322-329. DOI:10.1016/j.ijbiomac.2015.03.055 |
| [8] |
Tako M, Nakamura S. Synergistic interaction between kappa-carrageenan and locust bean gum in aqueous media[J]. Agric Biol Chem, 1986, 50(11): 2817-2822. DOI:10.1271/bbb1961.50.2817 |
| [9] |
Murayamaa A, Ichikawaa Y, Kawabata A. Rheological properties of mixed gels of κ-carrageenan with galactomannan[J]. Biosci Biotech Bioch, 1995, 59(1): 5-10. DOI:10.1271/bbb.59.5 |
| [10] |
Badwaik HR, Giri TK, Nakhate KT, et al. Xanthan gum and its derivatives as a potential bio-polymeric carrier for drug delivery system[J]. Curr Drug Deliv, 2013, 10(5): 587-600. DOI:10.2174/1567201811310050010 |
| [11] |
Gao L, Dai W, Chen J, et al. Enhanced electro-responsive behaviors of agar/xanthan gum interpenetrating compound hydrogel[J]. Soft Mater, 2017, 15(2): 163-172. DOI:10.1080/1539445x.2017.1282872 |
| [12] |
Morris ER. Ordered conformation of xanthan in solutions and “weak gels”:single helix,double helix-or both[J]. Food Hydrocolloid, 2019, 86: 18-25. DOI:10.1016/j.foodhyd.2017.11.036 |
| [13] |
Zhang B, Wang J, Li Z, et al. Use of hydroxypropyl β-cyclodextrin as a dual functional component in xanthan hydrogel for sustained drug release and antibacterial activity[J]. Colloid Surface A, 2020, 587: 124368. DOI:10.1016/j.colsurfa.2019.124368 |
| [14] |
Hezaveh H, Muhamad II. Modification and swelling kinetic study of kappa-carrageenan-based hydrogel for controlled release study[J]. J Taiwan Inst Chem Eng, 2013, 44(2): 182-191. DOI:10.1016/j.jtice.2012.10.011 |
| [15] |
Sloneker JH, Orentas DG. Pyruvate acid,a unique component of an exocelluar bacterial polysaccharide[J]. Nature, 1962, 194(4827): 478-479. DOI:10.1038/194478a0 |
| [16] |
Iijima M, Hatakeyama T, Takahashi M, et al. Effect of thermal history on kappa-carrageenan hydrogelation by differential scanning calorimetry[J]. Thermochim Acta, 2007, 452(1): 53-58. DOI:10.1016/j.tca.2006.10.019 |
| [17] |
Ikeda S, Nishinari K. “Weak gel”-type rheological properties of aqueous dispersions of nonaggregatedκ-carrageenan helices[J]. J Agr Food Chem, 2001, 49(9): 4436-4441. DOI:10.1016/1021/jf0103065 |
| [18] |
Wang Y, Yuan C, Cui B, et al. Influence of cations on texture,compressive elastic modulus,sol-gel transition and freeze-thaw properties of kappa-carrageenan gel[J]. Carbohydr Polym, 2018, 22: 530-535. DOI:10.1016/j.carbpol.2018.08.146 |
| [19] |
Martins JT, Cerqueira MA, Bourbon AI, et al. Synergistic effects between к-carrageenan and locust bean gum on physicochemical properties of edible films made thereof[J]. Food Hydrocolloid, 2012, 29(2): 280-289. DOI:10.1016/j.foodhyd.2012.03.004 |
| [20] |
He H, Ye J, Zhang X, et al. κ-Carrageenan/locust bean gum as hard capsule gelling agents[J]. Carbohydr Polym, 2017, 175: 417-424. DOI:10.1016/j.carbpol.2017.07.049 |
| [21] |
Kim J, Hwang J, Seo Y, et al. Engineered chitosan–xanthan gum biopolymers effectively adhere to cells and readily release incorporated antiseptic molecules in a sustained manner[J]. J Ind Eng Chem, 2017, 46: 68-79. DOI:10.1016/j.jiec.2016.10.017 |
| [22] |
Liu S, Yao F, Kang M, et al. Hierarchical xanthan gum/graphene oxide nanocomposite film induced by ferric ions coordination[J]. Mater Design, 2017, 113: 232-239. DOI:10.1016/j.matdes.2016.09.105 |
| [23] |
Tako M, Nakamura S. Indicative evidence for a conformational transition in kappa-carrageenan from studies of viscosity-shear rate dependence[J]. Carbohyd Res, 1986, 155(1): 200-205. DOI:10.1016/S0008-6215(00)90146-0 |
| [24] |
Braudo EE, Muratalieva IR, Plashchina IG, et al. Studies on the mechanisms of gelation of к-carrageenan and agarose[J]. Colloid Polym Sci, 1991, 269: 1148-1156. DOI:10.1007/BF00654123 |
| [25] |
Bardajee GR, Hooshyar Z, Rastgo F. Kappa carrageenan-g-poly (acrylic acid)/SPION nanocomposite as a novel stimuli-sensitive drug delivery system[J]. Colloid Polym Sci, 2013, 291(12): 2791-2803. DOI:10.1007/s00396-013-3018-6 |
| [26] |
Sharifzadeh G, Wahit MU, Soheilmoghaddam M, et al. Kappa-carrageenan/halloysite nanocomposite hydrogels as potential drug delivery systems[J]. J Taiwan Inst Chem Eng, 2016, 67(1): 426-434. DOI:10.1016/j.jtice.2016.07.027 |
| [27] |
Bajpai SK, Daheriya P. Kappa-carrageenan/PVA films with antibacterial properties:part 1.optimization of preparation conditions and preliminary drug release studies[J]. J Macromol Sci A, 2014, 51(4): 286-295. DOI:10.1080/10601325.2014.882687 |
| [28] |
Di Palma TM, Migliardini F, Caputo D, et al. Xanthan and κ-carrageenan based alkaline hydrogels as electrolytes for Al/air batteries[J]. CarbohydrPolym, 2017, 157: 122-127. DOI:10.1016/j.carbpol.2016.09.076 |
| [29] |
Jin W, Song R, Xu W, et al. Analysis of deacetylated konjac glucomannan and xanthan gum phase separation by film forming[J]. Food Hydrocolloid, 2015, 48: 320-326. DOI:10.1016/j.foodhyd.2015.02.007 |



