蒲公英(Taraxacum mongolicum Hand.-Mazz.)为菊科多年生草本植物,别名黄花地丁、婆婆丁、黄花三七等,其嫩苗是人们喜爱的野菜,食用历史悠久,始载于《唐本草》,另外《本草纲目》《本草新编》等本草著作中也有记载[1]。蒲公英含有多种人体所必需的氨基酸,Ca、P、Fe等多种矿物质的含量也显著高于普通果蔬[2]。研究表明,蒲公英含多种化学成分,如黄酮类[3-4]、萜类[5-6]、香豆素类[7]等,有降血脂、降血糖[8]、抗氧化、抗炎[9]、抗肿瘤等生物活性[10]。半仿生提取法是模仿人体胃肠道环境,在特定的酸碱环境下提取化学成分,从生物药剂学角度为口服给药制剂提供一种新技术[11-12]。本文对蒲公英所含有的黄酮类成分超声辅助半仿生提取工艺进行研究,并对不同采收时间蒲公英地上部分及根中所含黄酮类成分槲皮素、木犀草素和芦丁含量进行测定,为蒲公英合理采收和有效利用提供科学依据。
1 材料及仪器 1.1 材料试剂蒲公英采自山东日照(采集时间2017年3月3日- 6月1日,期间每10天采集1次),洗净,50℃烘干,粉碎过40目筛备用。芦丁对照品(上海源叶生物科技有限公司,批号:Y05M6S1);木犀草素对照品(上海源叶生物科技有限公司,批号:YA0408YA14);槲皮素对照品(上海源叶生物科技有限公司,批号:Y26D5Y1);甲醇(色谱纯);其它试剂为分析纯。
1.2 仪器设备SHIMADZU LC-20AT双泵高效液相色谱仪(日本岛津公司);超声波清洗机(深圳市深华泰超声洗净设备有限公司);FA1004电子分析秤(常州市幸运电子设备有限公司);101-OS电热鼓风干燥箱(天津宏诺仪器有限公司);Q-250B高速多功能粉碎机(上海冰都电器有限公司)。
2 方法与结果 2.1 蒲公英总黄酮半仿生提取 2.1.1 供试品溶液的制备准确称量蒲公英(采于2017年3月23日)地上部分粉末4.5g,加入一定量的提取溶剂,超声提取3次(3次提取溶剂的pH分别为2.0、7.5和8.3),超声提取一定时间,合并提取液,旋转蒸发回收溶剂,定容于100ml容量瓶中,作为待测液。
2.1.2 芦丁标准品溶液的制备用分析天平精密称取4.5mg芦丁标准品,95%乙醇定容至25ml容量瓶中,得浓度为0.18mg/ml的标准品溶液。
2.1.3 测定波长的确定按照文献[13]显色方法分别对供试品溶液和标准品溶液显色,在200~700nm波长范围内进行波谱扫描,结果表明,在502nm波长处二者均出现了最大吸收峰,所以确定502nm为测定波长。见图 1。
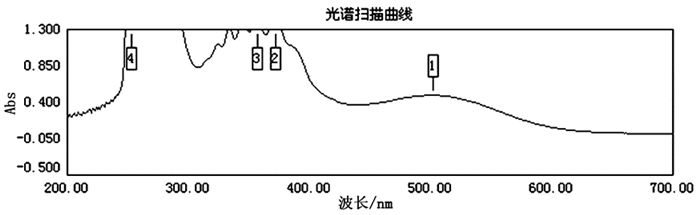
|
图 1 供试品溶液和标准品溶液紫外光谱扫描图 |
用移液管分别量取0.0、1.0、2.0、3.0、4.0、5.0ml的芦丁标准品母液,置于6个10ml的容量瓶中,按文献[13]所示方法显色配制溶液,最终得0.000、0.018、0.036、0.054、0.072、0.090mg/ml不同浓度的标准品溶液,在502nm波长处分别测定其吸光度。以芦丁标准品溶液浓度C(mg/ml)为横坐标,以吸光度A为纵坐标,得到标准曲线的回归方程:A=0.10565C+0.00081,r2=0.9995.
2.1.5 总黄酮含量测定精密量取“2.1.1”项下的蒲公英待测溶液4ml至250ml容量瓶中,按照文献[13]方法配制溶液,在502nm波长处测定其吸光度,代入“1.3.4”项下的回归方程计算,得出提取液中黄酮类化合物的浓度,最终得出蒲公英总黄酮提取率。
总黄酮提取率(%)=C×V×n/1000m×100%
此公式中,C:提取液中黄酮类化合物的浓度(mg/ml);V:被测液体积(ml);n:稀释倍数;m:蒲公英粉末的质量(g)。
2.1.6 单因素试验1) 乙醇浓度对提取率的影响。分别以10倍量的45%、55%、75%、85%、95%乙醇为提取溶剂,40℃,按照“2.1.1”项下方法超声提取2次,每次20min,测定蒲公英总黄酮提取率。结果显示,随着乙醇浓度增大提取率不断提高,75%时达到最高值,之后逐渐降低。
2) 料液比对提取率的影响。以75%乙醇为提取溶剂,40℃,分别考察8、10、20、25、30倍量提取溶剂对提取率的影响。结果显示,随着料液比的增加提取率不断提高,20倍量时达到最高值,之后提高不明显。
3) 提取温度对提取率的影响。以20倍量的75%乙醇为提取溶剂,分别考察30℃、40℃、50℃、60℃、70℃不同温度对提取率的影响。结果显示,温度不断升高提取率随之提高,50℃达到最高,之后明显下降。
4) 提取时间对提取率的影响。以20倍量的75%乙醇为提取溶剂,50℃,分别考察10、15、20、30、40min不同提取时间对提取率的影响。结果显示,随着提取时间的延长提取率随之提高,30min时达到最高,之后有所下降。
2.1.7 正交试验为系统考察提取条件参数,在单因素研究结果基础上,确定其因素水平(见表 1),选用L9(34)正交表进行正交设计,进一步优化半仿生超声提取蒲公英总黄酮的工艺条件。正交试验结果和直观分析见表 2,方差分析见表 3。
| 表 1 正交试验因素水平表 |
| 表 2 正交试验结果和直观分析 |
| 表 3 方差分析 |
按照“2.1.1”项下的供试品溶液制备方法分别制备表 2所列各提取条件样品,分别计算其提取率。结果显示,各因素对蒲公英总黄酮提取率影响大小顺序为:A>D> B>C,即乙醇浓度>料液比>超声时间>超声温度,其中乙醇浓度和料液比为显著性影响因素;最佳提取工艺条件为A3B2C1D2,即乙醇浓度为95%,料液比为1 :20,超声时间30 min,超声温度为40℃。
2.1.8 验证试验准确称取5份蒲公英粉末各50 g,按照最佳工艺条件A3B2C1D2进行提取,计算总黄酮提取率,结果平均提取率为5.75%,RSD为0.31%,表明此工艺条件稳定可行。
2.2 不同采收时间蒲公英中槲皮素、木犀草素、芦丁含量测定 2.2.1 色谱条件色谱柱:Agilent HC-C18 (250mm×4.6mm,5μm);流动相:甲醇-0.2%磷酸水溶液(52 :48);流速:0.8ml/min;检测波长:360nm;柱温:室温;进样量:10μl。在该色谱条件下,槲皮素的保留时间为7.5min,木犀草素保留时间19.0min,芦丁保留时间23.7min。见图 2。
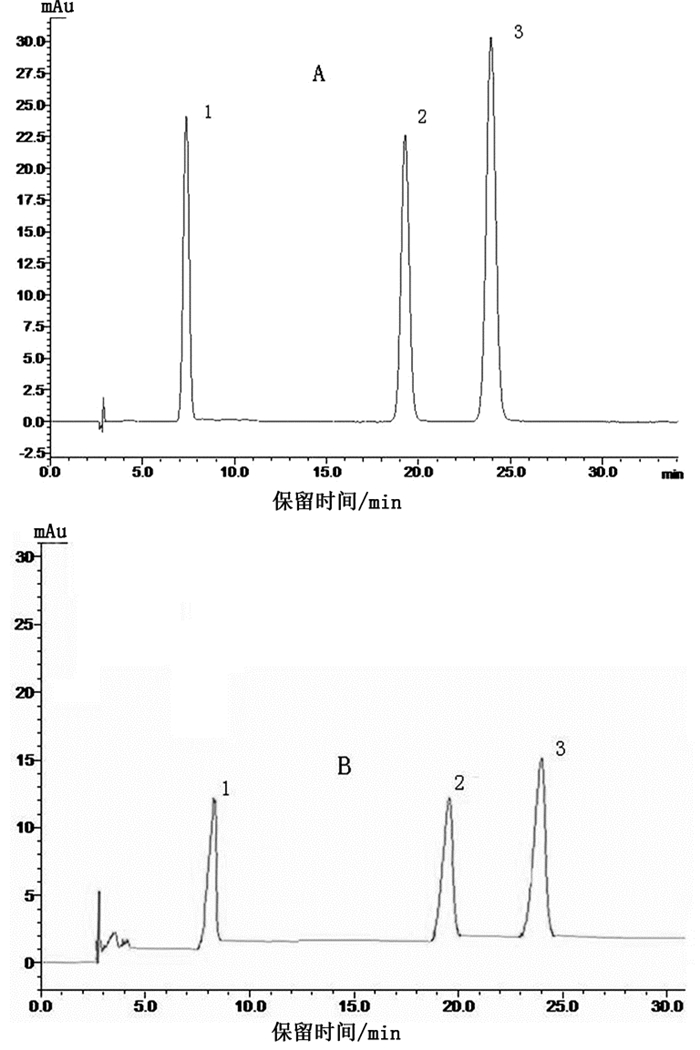
|
图 2 混合对照品(A)和蒲公英样品(B)的HPLC色谱图 注:1.槲皮素;2.木犀草素;3.芦丁 |
分别精密称取干燥至恒重的槲皮素对照品22.00mg,木犀草素对照品14.00mg和芦丁对照品21.20mg,分别用甲醇定容至100ml容量瓶中,配制成0.2200mg/ml的槲皮素溶液, 0.1400mg/ml的木犀草素溶液和0.2120mg/ml的芦丁溶液。分别吸取槲皮素对照品溶液5ml,木犀草素对照品溶液10ml, 芦丁对照品溶液10ml,用甲醇定容于100ml容量瓶中,得三者混合对照品溶液。
2.2.3 供试品溶液的配制分别称取不同采收时间的蒲公英地上部分和根部粉末3g,按照所得的半仿生最佳提取工艺条件(乙醇浓度为95%,超声时间30min,超声温度为40℃,料液比为1 :20)进行提取,提取液浓缩成浸膏,用甲醇定容于25ml容量瓶中,得供试品溶液。
2.2.4 线性关系考察精密吸取混合对照品溶液1.0、2.0、4.0、6.0、8.0、10.0ml,用甲醇分别定容于10ml容量瓶中,得到一系列不同浓度的混合对照品溶液,在“2.2.1”项色谱条件下,测定不同浓度溶液中槲皮素、木犀草素、芦丁的峰面积,以浓度X为横坐标,峰面积Y为纵坐标分别绘制槲皮素、木犀草素、芦丁的标准曲线,得到槲皮素的回归方程为y=4000000x-840.73(r=0.9999),木犀草素的回归方程为y=4000000x-3408.7(r=0.9999),芦丁的回归方程为y=4000000x-5090.4(r=0.9999)。结果表明,槲皮素、木犀草素、芦丁分别在1.10~11.00μg/ml、1.14~14.00μg/ml和2.12~21.20μg/ml范围内线性关系良好。
2.2.5 精密度试验取“2.2.2”项下混合对照品溶液,连续进样6次,分别记录各成分峰面积,计算槲皮素的峰面积RSD为0.36%,木犀草素的峰面积RSD为0.46%,芦丁的峰面积RSD为0.79%,表明仪器精密度良好。
2.2.6 稳定性试验取3月23日采集的蒲公英地上部分,按“2.2.3”项下制备供试品溶液,在“2.2.1”项的色谱条件下分别于0、2、4、6、8、10、12h进样分析,计算槲皮素、木犀草素、芦丁峰面积的RSD分别为0.42%、2.73%和1.12%,可见在12h内供试品溶液稳定性良好。
2.2.7 重复性试验取3月23日采集的蒲公英地上部分,按“2.2.3”项下平行制备6份供试品溶液,在“2.2.1”项下色谱条件分别进样,记录峰面积,计算槲皮素、木犀草素、芦丁峰面积的RSD分别为1.31%、2.31%和1.52%,说明所建立的方法重复性良好。
2.2.8 加样回收率试验精密秤取已知含量的蒲公英地上部分(3月23日)6份,按“2.2.3”项下制备供试品溶液,按照文献[14]的方法进行加样回收率试验,结果为槲皮素的平均加样回收率是91.1%,木犀草素为93.0%,芦丁为98.0%;槲皮素、木犀草素、芦丁的RSD分别为1.21%、1.81%和1.42%。考察结果说明建立的方法准确性良好。
2.2.9 样品测定制备各个时期采集的蒲公英地上部分和根部样品溶液,在“2.2.1”项的色谱条件下进行色谱分析,测定各个样品的槲皮素、木犀草素、芦丁的含量,色谱图见图 2,测定结果见表 4。
| 表 4 各个时期蒲公英地上部分和根部槲皮素、木犀草素、芦丁的含量(mg·g-1) |
结果可见蒲公英中槲皮素、木犀草素、芦丁的含量高低顺序为芦丁>槲皮素>木犀草素;4月份采收的蒲公英中三者的含量高于其他月份,同一时期采收的蒲公英地上部分三者的含量都明显较根部含量高。
3 讨论随着生活水平的不断提高,人们对绿色保健品需求逐渐增加。绿色保健品特别是以中草药为原料提取加工生产的受到了人们的青睐。蒲公英在我国分布广泛,资源丰富,用经历史悠久。蒲公英营养丰富具有多方面的保健功能,激发了广大研究者的兴趣,世界各国均在积极研制蒲公英保健产品,目前已有蒲公英酒、蒲公英咖啡、蒲公英饮料、蒲公英粥、蒲公英花粉等商品上市[15]。黄酮类成分具有降血脂、降胆固醇、抗氧化等活性,可用于治疗心血管疾病[16]。本研究通过正交试验优化了半仿生提取蒲公英总黄酮的工艺条件,最佳工艺条件为乙醇浓度为95%,超声时间30min,超声温度为40℃,料液比为1 :20,提取率为5.75 %,高于董默等[17]的提取结果4.33 %。该提取工艺可保障蒲公英中黄酮类成分的高效提取,确保蒲公英资源的充分利用。
中药材的质量好坏取决于所含有效成分高低,与众多因素有关,其中采收时间是重要影响因素之一。在不同时期,中药中的有效成分含量不同,通过探索其变化规律寻求最佳采收时间对保证中药材的质量起着至关重要的作用。我们按照所得最佳提取条件,对不同采收时间蒲公英地上部分和根部所含黄酮类成分槲皮素、木犀草素和芦丁进行了含量测定。通过研究,不但建立了同时测定蒲公英中三种黄酮类成分的HPLC方法,而且探究了蒲公英中所含三种成分在不同时期的含量变化规律,结果表明地上部分含量明显高于根部,4月份采收的样品含量高于其它采收时间,三种成分含量高低顺序为芦丁>槲皮素>木犀草素。该研究结果为蒲公英的合理采收和质量控制提供了科学依据。
蒲公英作为药食两用的常用中药材,不但具有多方面的生物活性,如清热解毒、抗炎、健胃、利尿等功效,可治疗咽炎、急性扁桃腺炎及妇女乳痛等;而且具有多种保健功能,如抗氧化、免疫调节[18]等。随着人们对其广泛和深入研究,必将在医药、食品、保健等领域具有广阔的市场前景。
| [1] |
丁惠, 张馨方, 纪文华, 等. 蒲公英药用研究进展[J]. 辽宁中医药大学学报, 2018, 20(9): 156-159. |
| [2] |
李伟民, 王军宝, 张苗苗, 等. 蒲公英-苹果复合功能饮料的研制[J]. 许昌学院学报, 2018, 37(8): 50-54. DOI:10.3969/j.issn.1671-9824.2018.08.013 |
| [3] |
施树云, 周宏灏, 张宇平, 等. 管花蒲公英化学成分研究[J]. 中国中药杂志, 2009, 34(8): 1002-1004. DOI:10.3321/j.issn:1001-5302.2009.08.018 |
| [4] |
Yadava RN, Khan S. A new flavonoidal constituent from Taraxacum Officinale (L.) Weber[J]. Asian Journal of Chemistry, 2013, 25(7): 4117-4118. DOI:10.14233/ajchem.2013.14046 |
| [5] |
Daisuke S, Takeshi Y, Yasuko I, et al. Officinatrione:an unusual(17S)-17, 18-seco-lupane skeleton, and four novel lupane-type triterpenoids from the roots of Taraxacum officinale[J]. Tetrahedron, 2013, 69: 1583-1589. DOI:10.1016/j.tet.2012.12.001 |
| [6] |
Tsutomu W, Kaoru U, Toshio M. Constituents from the roots of Taraxacum platycarpum and their effect on proliferation of human skin fibroblasts[J]. Chem Pharm Bull, 2012, 60(2): 205-212. DOI:10.1248/cpb.60.205 |
| [7] |
许丹, 侯凤飞, 吴立军, 等. 蒲公英的化学研究[J]. 中国中药杂志, 2004, 29(3): 278-278. DOI:10.3321/j.issn:1001-5302.2004.03.029 |
| [8] |
王亚茹, 李雅萌, 杨娜, 等. 蒲公英属植物的化学成分和药理作用研究进展[J]. 特产研究, 2017, 4: 67-75. |
| [9] |
赵惠茹, 郭婷. 反相高效液相色谱法同时测定蒲公英中槲皮素和木犀草素的含量[J]. 中国药师, 2014, 17(7): 1106-1108. |
| [10] |
谢沈阳, 杨晓源, 丁章贵, 等. 蒲公英的化学成份及其药理作用[J]. 天然产物研究与开发, 2012, 24(S1): 141-151. |
| [11] |
王京龙, 郑丹丹, 王磊, 等. 均匀设计法优化葛根半仿生提取工艺[J]. 中成药, 2017, 39(5): 1084-1087. |
| [12] |
薛璇玑, 罗俊, 张新新, 等. 半仿生酶法提取柿叶中总黄酮的工艺筛选及优化[J]. 中国药房, 2017, 28(13): 1813-1816. DOI:10.6039/j.issn.1001-0408.2017.13.24 |
| [13] |
陈桂, 刘跃进, 肖翠. 超声辅助半仿生提取半枝莲总黄酮的实验研究[J]. 湘潭大学自然科学学报, 2014, 36(2): 77-80. DOI:10.3969/j.issn.1000-5900.2014.02.015 |
| [14] |
刘爱朋, 郭利霄, 薛紫鲸, 等. 基于指纹图谱和多组分含量测定的蒲公英药材质量控制研究[J]. 中国中药杂志, 2018, 43(18): 3715-3721. |
| [15] |
刘萍. 蒲公英腌制菜的工艺研究[J]. 吉林农业科技学院学报, 2017, 26(4): 7-10. DOI:10.3969/j.issn.1674-7852.2017.04.003 |
| [16] |
田梦南, 周秀秀, 周欣, 等. 魔芋中黄酮类化合物的提取工艺及挥发油成分研究[J]. 食品研究与开发, 2019, 40(1): 124-131. DOI:10.3969/j.issn.1005-6521.2019.01.021 |
| [17] |
董默, 韩婷. 蒲公英黄酮类物质提取条件的优化与含量测定[J]. 氨基酸和生物资源, 2014, 36(3): 72-74. |
| [18] |
孙珊珊, 张千, 丁林, 等. 蒲公英总黄酮含量测定及对小鼠体液免疫功能的影响[J]. 济宁医学院学报, 2018, 41(4): 235-237. DOI:10.3969/j.issn.1000-9760.2018.04.002 |

