骨改建是指骨组织在成骨细胞、破骨细胞及骨细胞的作用下不断生成和吸收的过程。成骨细胞产生骨基质,破骨细胞降解骨,二者处于一个动态平衡。成骨细胞与破骨细胞的数量和活性的平衡决定骨量。雌激素与成骨细胞、破骨细胞、骨细胞及部分细胞因子有着密切关系,其通过多种方式调控骨改建的进程,对骨改建具有重要作用。
1 雌激素及其受体雌激素主要包括雌酮(estrone, E1)、17β-雌二醇(17-β estradiol, E2)和雌三醇(estriol, E3)等,在体内主要由卵巢分泌。妇女绝经后,由于卵巢分泌的雌激素大量减少,一些非性腺组织,如骨细胞、血管内皮细胞、间充质干细胞、下丘脑等分泌的雌激素水平可代偿性增高,并作用于局部组织和器官,发挥生理调控功能。
雌激素受体(estrogen receptor, ER)包括核型受体和膜型受体。核型雌激素受体位于细胞核内,分为雌激素α受体(ERα)、雌激素β受体(ERβ)和雌激素γ受体(ERγ)[1]。ERα有ERα-36、ERα-46、ERα-66 3种亚型,其中ERα-36主要存在于膜组分和线粒体中,属于核型雌激素受体的膜型成分[2]。ERβ具有5种亚型,分别为ERβ1~5, ERβ1是唯一的功能型受体,其在E2的调控下可以和自身或其它亚型形成二聚体而发挥作用,而ERβ的其他亚型无此功能[1]。ERα和ERβ通过信号通路以相反的方式作用在核转录因子激活蛋白(AP-1)[3],这提示ERα和ERβ可能存在拮抗作用。破骨细胞和成骨细胞谱系中存在ER的差异化表达,ERα在皮质骨中高度表达,ERβ则在骨小梁中有较高的表达水平,这表明它们在这些组织中可能具有不同的功能。在破骨细胞和成骨细胞成熟过程中也可以观察到ER表达的变化,ERα在破骨前和成骨细胞前系中高表达,在成熟细胞中低表达,这表明ERα可能参与细胞分化,进而参与骨改建。与ERα相反,ERβ的表达水平在成骨细胞分化中保持不变,这进一步提示了ER在成骨过程中可能具有不同作用[4]。ERγ相关研究较少,在与骨改建的关系方面未见报道。膜型雌激素受体位于细胞膜上,包括核型雌激素受体的膜型成分、G蛋白偶联受体30(G protein coupled receptor 30, GPR-30)和Gaq-ER等,其在中枢系统、心血管系统、生殖系统及泌尿系统中发挥着重要作用[5-6]。
2 雌激素在骨改建中的作用 2.1 雌激素对骨吸收的影响雌激素通过介导破骨细胞的雌激素受体,抑制破骨细胞溶酶体酶活性并增加破骨细胞的凋亡,减少破骨细胞的存活时间,抑制破骨细胞的分化,从而减少骨吸收。雌激素还可以作用于破骨细胞前体,抑制破骨细胞的生长分化,延缓骨量丢失的进程。雌激素缺乏后,其对破骨细胞和破骨细胞前体的抑制作用降低,破骨细胞的骨吸收大于成骨细胞的骨形成,表现为骨基质破坏。
2.2 雌激素对骨形成的影响雌激素可以与成骨细胞表面的雌激素受体结合,上调胶原酶,抗氧化酶及相关生长因子的水平,增加成骨细胞的代谢活性,进而诱导Ⅰ型胶原,蛋白多糖和磷酸钙晶体的合成,促进骨量的增加。雌激素还可以通过激活Notch通路促进成骨分化,抑制成脂分化,上调成骨细胞的活性与数量,使骨形成增加[7]。
3 雌激素在骨改建过程中的调节机制 3.1 雌激素与破骨细胞 3.1.1 雌激素对破骨细胞的直接作用雌激素通过RANKL-RANK-OPG系统直接作用于破骨细胞。骨保护素(osteoprotegerin, OPG)主要由成骨细胞和血管内皮细胞分泌,可以竞争性的与RANKL结合,进而抑制RANKL诱导的破骨细胞分化。研究显示,E2通过提高OPG的转录活性和影响成骨细胞表面的RANKL位点来减少RANKL诱导的破骨细胞分化[9]。雌激素可以促进乳腺癌抗雌激素药物耐药性基因(Recombinant Breast Cancer Anti-Estrogen Resistance 1, BCAR1)与ER的相互作用,形成E2-ER-BCAR1复合体,从而抑制了E2-ER-肿瘤细胞坏死因子相关受体6(TRAF6)复合体的形成,进而抑制了经典细胞核因子κB(NF-κB)信号通路,减少了RANKL诱导的破骨细胞分化[10]。E2可以通过调控细胞外信号调节激酶(extracellular regulating kinase, ERK)磷酸化时间的长短,在破骨细胞中产生促进凋亡和抑制凋亡两种不同的作用效果,E2通过延长破骨细胞ERK磷酸化持续的时间,可以逆转IL-1、IL-6及TNF-α等细胞因子诱导的ERK信号瞬时激活产生的抗凋亡作用,使破骨细胞凋亡[11]。此外,E2可以降低c-jun和c-jun末端氨基激酶(c-jun N-terminal kinase, JNK)的活性,抑制破骨细胞的形成,促进破骨细胞的凋亡,减少骨基质的吸收[12]。见图 1。
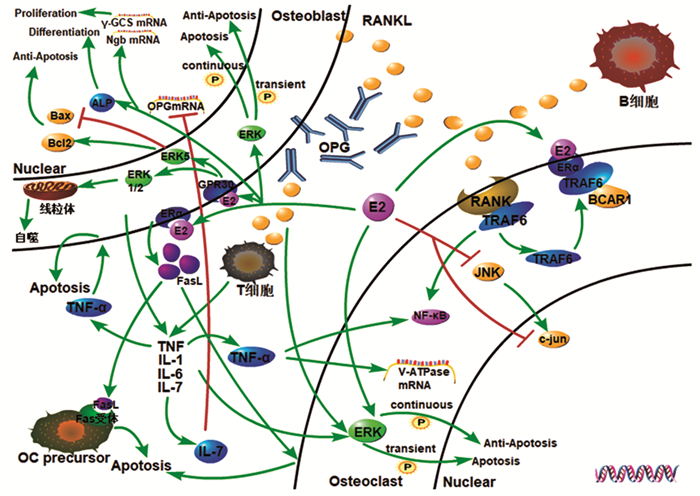
|
图 1 雌激素对成骨细胞及破骨细胞的作用机制(原创) |
E2可通过调节TNF-α的水平来调控破骨细胞的活性。相关研究表明,OVX小鼠TNF-α生成增加,促进IL-7的产生,OPGmRNA表达下降,OPG和RANK竞争性结合RANKL的作用降低,从而促进破骨细胞活化,使骨量丢失[13-14]。E2缺乏除了可以上调TNF-α激活NF-κB来促进RANKL诱导破骨细胞的形成之外,还可以诱导破骨细胞V-ATP酶的表达来增加破骨细胞的活性:TNF-α干预破骨细胞后,破骨细胞液泡ATP(vacuolar-ATP, V-ATP)酶的mRNA表达增加,破骨细胞的骨吸收能力增强[15]。IL-6是另一影响破骨细胞分化的重要细胞因子,其作用尚有争议。有学者发现,IL-6可以促进破骨细胞的分化和介导雌激素缺乏引起的骨小梁丢失[16],抑制IL-6可以防止与OVX相关的破骨细胞数量增加;但王信等[17]研究发现,IL-6可以抑制破骨细胞分化因子诱导的RAW264.7细胞分化,并减少破骨细胞所致的骨吸收。IL-1在破骨细胞的分化过程中也起着重要作用,抑制IL-1后,OVX小鼠的骨丢失减少[3]。E2可以促使FasL的转录与释放,FasL可与破骨细胞前体细胞上的Fas受体结合从而诱导破骨细胞前体细胞凋亡[18]。见图 1。
3.2 雌激素与成骨细胞 3.2.1 雌激素对成骨细胞的直接作用雌激素对成骨细胞的抗凋亡作用是通过激活ERK实现的,雌激素介导的成骨细胞短暂的ERK磷酸化可抑制成骨细胞凋亡,若延长ERK在成骨细胞中的磷酸化作用时间,那么雌激素的抗凋亡作用会转化为促凋亡作用。雌二醇还可以活化成骨细胞中的GPR30,通过ERK1/2通路促进成骨细胞线粒体自噬,减少成骨细胞凋亡,进而防止骨质疏松[19]。雌激素还可以呈时间、浓度依赖性激活成骨细胞中的ERK5,通过促进Bcl-2表达,抑制Bax表达,从而增加Bcl-2/Bax比例,进而抑制Caspase级联反应,抑制成骨细胞凋亡[20]。
3.2.2 雌激素对成骨细胞的间接作用OVX会使成骨细胞凋亡增加,可能与OVX小鼠体内TNF-α的表达上调有关,而E2可以抑制TNF-α诱导的成骨细胞的凋亡。碱性磷酸酶(alkaline phosphatase, ALP)转录是成骨细胞分化的标志[3],E2能诱导其转录,促进成骨细胞的分化。E2能使MC3T3-E1、MG63及原代培养的成骨细胞中抗氧化酶Ccs的数量和活性增加,而且还可以大幅度提高脑红蛋白(Neuroglobin, Ngb)mRNA与谷氨酰半胱氨酸合成酶(γ-glutamyl cysteine synthetase,γ-GCS)mRNA的转录水平,从而促进成骨细胞的增殖[6]。骨质疏松大鼠血清中活性氧增加、抗氧化酶γ-GCS含量降低,而E2可以显著地拮抗这一现象[8]。
3.3 雌激素与骨细胞虽然雌激素在骨组织中的积极作用早已经被证明,但雌激素对骨细胞的作用尚未被阐明。
雌激素缺乏可促使TNF-α的表达增加,进而诱发骨细胞发生程序性坏死。细胞程序性坏死是一种有着和细胞坏死相似形态的、caspase非依赖性的可调节细胞死亡方式,其与受体相互作用蛋白1(receptor-interacting protein 1, RIP1)和受体相互作用蛋白3(receptor-interacting protein 3, RIP3)密切相关。崔红旺等[13]发现OVX大鼠胫骨近端骨细胞中RIP1、RIP3和TNF-α蛋白与正常大鼠相比显著增高,电镜下可见OVX大鼠胫骨近端骨细胞呈现坏死性特征,推测这种坏死可能是由作为下游信号分子的MLKL和Drp1介导的,但也有研究表明细胞程序性坏死的关键性因素并非是Drp1转位到线粒体使线粒体凋亡。雌激素通过影响膜型基质金属蛋白酶1(membrance type matrix metalloprotease, MT1-MMP)的水平进而影响骨细胞的代谢,MT1-MMP不仅可以将TNF-α降解为失活片段,从而在骨改建的调控中发挥着重要作用;还有助于骨细胞突起的形成,促进骨细胞的营养维持和自身代谢[21]。OVX大鼠的MT1-MMP表达和骨细胞数目降低,其机制可能是MT1-MMP的缺乏抑制了骨细胞突起的合成,导致其营养代谢障碍[21]。此外,雌激素通过调节雷帕霉素靶蛋白(mTOR)和胰岛素样生长因子1(insulin growth factor 1, IGF-1)可以抑制MLO-Y4细胞自噬的发生,而E2缺乏可使骨皮质中miR-199a-3p水平增加,诱导MLO-Y4细胞自噬的发生[22]。
3.4 雌激素对骨改建的其他影响雌激素除了作用于破骨细胞、成骨细胞以及骨细胞来调控骨改建之外,还可调节一氧化氮、钙的吸收与排泄等来影响骨改建的进程。已知一氧化氮在抗炎方面有积极的作用[23],雌激素可以激活Src家族酪氨酸激酶,丝氨酸/苏氨酸激酶和Akt,Akt可以使eNOS磷酸化,促进血管内皮产生NO,抵抗破骨细胞产生的炎性作用,进而抑制骨吸收[24]。雌激素缺乏还会影响血清钙的水平,成骨细胞合成骨基质的原料减少,骨基质生成量降低,骨改建失衡[25]。
4 小结与展望雌激素不仅可以通过ERK家族直接作用于破骨细胞与成骨细胞,还能通过IL-1、IL-6、IL-7等细胞因子间接的作用于破骨细胞和成骨细胞,产生促进凋亡和抑制凋亡的作用效果。雌激素还能调控骨细胞的程序性坏死和代谢来影响骨细胞的活性。虽然雌激素对骨改建具有重要作用,但仍有一些问题尚未完全明确,如ERβ在骨中的功能是否通过拮抗ERα实现的,ERα和ERβ的多态性以及其在不同组织中发挥的功能等都还需要深入探究。
| [1] |
Okazaki H, Hirao-Suzuki M, Takeda S, et al. Bisphenol AF as an activator of human estrogen receptor β1(ERβ1) in breast cancer cell lines[J]. J Toxicol Sci, 2018, 43(5): 321-327. DOI:10.2131/jts.43.321 |
| [2] |
Yan Y, Yu L, Castro L, et al. ERα36, a variant of estrogen receptor α, is predominantly localized in mitochondria of human uterine smooth muscle and leiomyoma cells[J]. PLoS One, 2017, 12(10): e0186078. DOI:10.1371/journal.pone.0186078 |
| [3] |
Khalid AB, Krum SA. Estrogen receptors alpha and beta in bone[J]. Bone, 2016, 87: 130-135. DOI:10.1016/j.bone.2016.03.016 |
| [4] |
Bado I, Gugala Z, SAW F, et al. Estrogen receptors in breast and bone:from virtue of remodeling to vileness of metastasis[J]. Oncogene, 2017, 36(32): 4527-4537. DOI:10.1038/onc.2017.94 |
| [5] |
Molina L, Bustamante FA, Bhoola KD, et al. Possible role of phytoestrogens in breast cancer via GPER-1/GPR30 signaling[J]. Clin Sci (Lond), 2018, 132(24): 2583-2598. DOI:10.1042/CS20180885 |
| [6] |
Vail G, Roepke TA. Membrane-initiated estrogen signaling via Gq-coupled GPCR in the central nervous system[J]. Steroids, 2019, 142: 77-83. DOI:10.1016/j.stero-ids.2018.01.010 |
| [7] |
周雪娟, 夏颖, 赵岩岩, 等. 雌二醇显著上调骨质疏松大鼠成骨细胞内抗氧化酶的表达[J]. 南方医科大学学报, 2018, 38(4): 402-408. DOI:10.3969/j.issn.1673-4254.2018.04.06 |
| [8] |
Han Y, Jin Y, Miao Y, et al. Improved RANKL expression and osteoclastogenesis induction of CD27+CD38-memory B cells:A link between B cells and alveolar bone damage in periodontitis[J]. J Periodontal Res, 2019, 54(1): 73-80. DOI:10.1111/jre.12606 |
| [9] |
Martin A, Xiong J, Koromila T, et al. Estrogens antagonize RUNX2-mediated osteoblast-driven osteoclastogenesis through regulating RANKL membrane association[J]. Bone, 2015, 75: 96-104. DOI:10.1016/j.bone.2015.02.007 |
| [10] |
Robinson LJ, Yaroslavskiy BB, Griswold RD, et al. Estrogen inhibits RANKL-stimulated osteoclastic differentiation of human monocytes through estrogen and RANKL-regulated interaction of estrogen receptor-alpha with BCAR1 and Traf6[J]. Exp Cell Res, 2009, 315(7): 1287-1301. DOI:10.1016/j.yexcr.2009.01.014 |
| [11] |
Chen JR, Plotkin LI, Aguirre JI, et al. Transient versus sustained phosphorylation and nuclear accumulation of ERKs underlie anti-versus pro-apoptotic effects of estrogens[J]. J Biol Chem, 2005, 280(6): 4632-4638. DOI:10.1074/jbc.M411530200 |
| [12] |
肖亚平, 戴慕巍, 田发明, 等. 雌激素对骨关节炎作用的研究进展[J]. 中国老年学杂志, 2017, 37(22): 5704-5707. DOI:10.3969/j.issn.1005-9202.2017.22.099 |
| [13] |
崔红旺, 孟志斌, 王挺锐, 等. 雌激素缺乏上调TNF-α促发卵巢切除大鼠骨细胞程序性坏死[J]. 中国骨质疏松杂志, 2017, 23(11): 1431-1437. DOI:10.3969/j.issn.1006-7108.2017.11.007 |
| [14] |
Kalkan R, Tulay P. The Interactions between Bone Remodelling, Estrogen Hormone and EPH Family Genes[J]. Crit Rev Eukaryot Gene Expr, 2018, 28(2): 135-138. DOI:10.1615/CritRevEukaryotGeneExpr.2018021275 |
| [15] |
王潇, 陈健, 张鑫, 等. TNF-α及TNF-α抗体对破骨细胞V-ATP酶的影响[J]. 中国骨质疏松杂志, 2018, 24(9): 1132-1135. DOI:10.3969/j.issn.1006-7108.2018.09.003 |
| [16] |
Lazzaro L, Tonkin BA, Poulton IJ, et al. IL-6 trans-signalling mediates trabecular, but not cortical, bone loss after ovariectomy[J]. Bone, 2018, 112: 120-127. DOI:10.1016/j.bone.2018.04.015 |
| [17] |
王信, 张怡, 陈萍, 等. IL-6对RAW264.7细胞成熟分化的体外实验研究[J]. 中国骨质疏松杂志, 2019, 25(1): 62-66. |
| [18] |
Jones DR. A potential osteoporosis target in the FAS ligand/FAS pathway of osteoblast to osteoclast signaling[J]. Ann Transl Med, 2015, 3(14): 189. DOI:10.3978/j.issn.2305-5839.2015.07.01 |
| [19] |
Sun X, Yang X, Zhao Y, et al. Effects of 17β-estradiol on mitophagy in the murine MC3T3-E1 osteoblast cell line is mediated via G protein-coupled estrogen receptor and the ERK1/2 signaling pathway[J]. Med Sci Monit, 2018, 24: 903-911. DOI:10.12659/msm.908705 |
| [20] |
谭小义.ERK5信号通路在雌激素抑制TNF-α诱导成骨细胞凋亡中的作用及机制的实验研究[D].兰州: 兰州大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10730-1016724177.htm
|
| [21] |
郭淑娟, 王耀生, 李晓菁, 等. 雌激素对去卵巢大鼠牙槽骨组织结构和MT1-MMP表达的影响[J]. 牙体牙髓牙周病学杂志, 2009, 19(3): 132-135. |
| [22] |
Fu J, Hao L, Tian Y, et al. miR-199a-3p is involved in estrogen-mediated autophagy through the IGF-1/mTOR pathway in osteocyte-like MLO-Y4 cells[J]. J Cell Physiol, 2018, 233(3): 2292-2303. DOI:10.1002/jcp.26101 |
| [23] |
Rashed L, Gharib DM, Hussein RE, et al. Combined effect of bone marrow derived mesenchymal stem cells and nitric oxide inducer on injured gastric mucosa in a rat model[J]. Tissue Cell, 2016, 48(6): 644-652. DOI:10.1016/j.tice.2016.09.006 |
| [24] |
Ueda K, Karas RH. Emerging evidence of the importance of rapid, non-nuclear estrogen receptor signaling in the cardiovascular system[J]. Steroids, 2013, 78(6): 589-596. DOI:10.1016/j.steroids.2012.12.006 |
| [25] |
Sonu Y, Avinash SS, Sreekantha, et al. Effect of oestrogen on altering the serum and urinary levels of calcium, phosphate and magnesium in hysterectomised women compared to natural menopausal south indian women:a case control study[J]. Indian J Clin Biochem, 2016, 31(3): 326-331. DOI:10.1007/s12291-015-0532-y |



