心肌纤维化是指在正常的心肌组织结构中胶原纤维过量积聚、胶原浓度显著升高或胶原成分发生改变的病理过程。该病理变化是临床多种心血管疾病发展到终末阶段的必经过程。其中,心肌成纤维细胞的增殖和细胞外基质(extracellular matrix, ECM)的沉积为心肌纤维化的主要特征[1]。心肌纤维化可引起心脏僵硬度增加,顺应性降低,影响心脏的舒张和收缩功能,导致心衰。目前, 预防和逆转心肌纤维化已成为心衰研究和防治的重要目标。血红素氧合酶-1(HO-1)及其产物对机体具有抗炎症、抗氧化、扩血管、调控细胞增殖与凋亡等作用,对心血管系统的疾病防治具有积极的临床意义,但国内尚无HO-1对心肌纤维化的影响研究。本文使用HO-1诱导剂和抑制剂分别作用于血管紧张素Ⅱ(AngⅡ)诱导的心肌成纤维细胞,检测心肌成纤维细胞增殖率,观察心肌纤维化程度,探讨HO-1对心肌纤维化的作用。
1 材料与方法 1.1 材料 1.1.1 实验动物新生1~2d的Wistar大鼠16只,雌雄不限,购自山东大学实验动物中心。动物实验符合动物伦理学要求。
1.1.2 主要试剂与仪器高糖DMEM培养基及胎牛血清(FBS)购自美国Hyclon公司;氯化血红素(hemin)、锌原卟啉-9(ZnppⅨ)、AngⅡ、鼠抗波形蛋白单克隆抗体、异硫氰酸荧光素(FITC)标记的山羊抗小鼠IgG抗体、DAPI均购自美国Sigma公司;HO-1山羊多克隆抗体和内参GAPDH抗体均购自美国Santa Cruz公司;胰酶和Ⅰ型胶原酶均购自美国Gibco公司;辣根过氧化酶标记兔抗羊IgG单克隆抗体购自北京中杉金桥生物技术有限公司;四甲基偶氮唑盐溶液购自河北凯力昂生物科技有限公司。CO2培养箱(德国HERA cell 240公司);倒置显微镜(德国leicadm4000B);荧光显微镜(日本OLYMPUS产品);PAlphaimager TM2200凝胶图像分析仪(美国Alpha innotech公司)。
1.2 方法 1.2.1 心肌成纤维细胞的原代及传代培养无菌条件下取出新生大鼠心脏组织,放入PBS液中,切取心室组织部分,反复冲洗去除心室内的血液,转移入EP管中,剪成1mm3的组织碎块,静置5min后,弃上清以去除红细胞。以0.05% Ⅰ型胶原酶和0.125%胰酶37.0℃反复消化6次,然后收集细胞悬液,以离心半径为15cm、800r/min离心10min,重悬后用200目滤网过滤,将所得细胞培养90min(差速贴壁法分离成纤维细胞),成纤维细胞贴壁后,弃去未贴壁的细胞,贴壁细胞继续在含15% FBS的DMEM培养液内培养,待细胞长满瓶底约80%~90%进行传代,实验取传代2~4代细胞。加药处理前24h换为无血清培养液培养。
1.2.2 心肌成纤维细胞鉴定波形蛋白正常情况下表达于成纤维细胞等间质细胞中,在心肌细胞中不表达,所以可根据波形蛋白阳性表达来鉴别心肌成纤维细胞。取第2代传代心肌成纤维细胞接种于6孔培养板内,2d后吸弃培养液,使用4%多聚甲醛固定,0.1% Triton X-100室温封闭30min,5%BSA室温摇床封闭30min,加1 :200鼠抗波形蛋白抗体(一抗)4 ℃过夜。次日加1 :200 FITC标记的IgG(二抗)室温避光孵育30min,PBS清洗,然后磷酸甘油封片,最后于荧光显微镜下观察,拍片。
1.2.3 实验分组和药物干预将心肌成纤维细胞随机分为4组:分别为正常对照组(常规培养),AngⅡ组(加入AngⅡ,终浓度为10-5mol/l),Hemin组(加入AngⅡ和HO-1诱导剂hemin,终浓度分别为10-5mol/l、2×10-5mol/l),ZnppⅨ组(加入AngⅡ和HO-1抑制剂ZnppⅨ,终浓度分别为10-5mol/L、5×10-6mol/L)[2-3]。
1.2.4 MTT测定细胞增殖率待培养皿细胞生长至80%~90%密度时予以消化,收集成纤维细胞铺于96孔板中,每孔铺1×104个细胞,每组设9个复孔,待培养孔中细胞生长至80%~90%时,不同组分别予以换液加药,加药后继续于细胞培养箱内培养48h,加入15μl MTT溶液,37 ℃避光孵育4h,弃去培养孔中液体,每孔加入150μl二甲基亚砜,于酶标仪中震荡混匀10min,测定450nm处吸光度值(OD值)。细胞增殖率(%)=实验组OD450/对照组OD450×100%。
1.2.5 心肌成纤维细胞HO-1蛋白表达检测提取心肌成纤维细胞总蛋白,BCA法测定总蛋白浓度,按每孔60μg上样,依次进行SDS-PAGE凝胶电泳、转膜、封闭,并加入HO-1山羊多克隆抗体(1 :200稀释)和内参抗体(GAPDH),于4℃孵育过夜,次日TBST洗膜,然后加入相应的二抗即辣根过氧化酶标记兔抗羊IgG单克隆抗体(1 :5000),化学发光法检测目的蛋白即HO-1的表达水平,采用Image J软件对显影的条带进行灰度分析,目的蛋白显色条带灰度与内参显色条带灰度比值代表目的蛋白相对表达量。
1.3 统计学方法采用SPSS21.0统计软件对数据进行分析,计量资料以x±s表示。多组间数据比较采用单因素方差分析,进一步两两比较采用LSD-t检验,以P<0.0167为差异有统计学意义。
2 结果 2.1 心肌成纤维细胞培养及鉴定大部分CFs培养90min后贴壁,显微镜下可见细胞成梭形或三角形,均匀散在分布(见图 1a)。CFs生长迅速,约2~3d即呈现融合状态,细胞增多,胞体增大,细胞排列密集,未见细胞搏动(见图 1b)。用波形蛋白行免疫荧光染色,鉴定心肌成纤维细胞纯度,结果示90%以上细胞染色阳性, 提示经差速贴壁后获得细胞绝大多数为心肌成纤维细胞(见图 1c)。
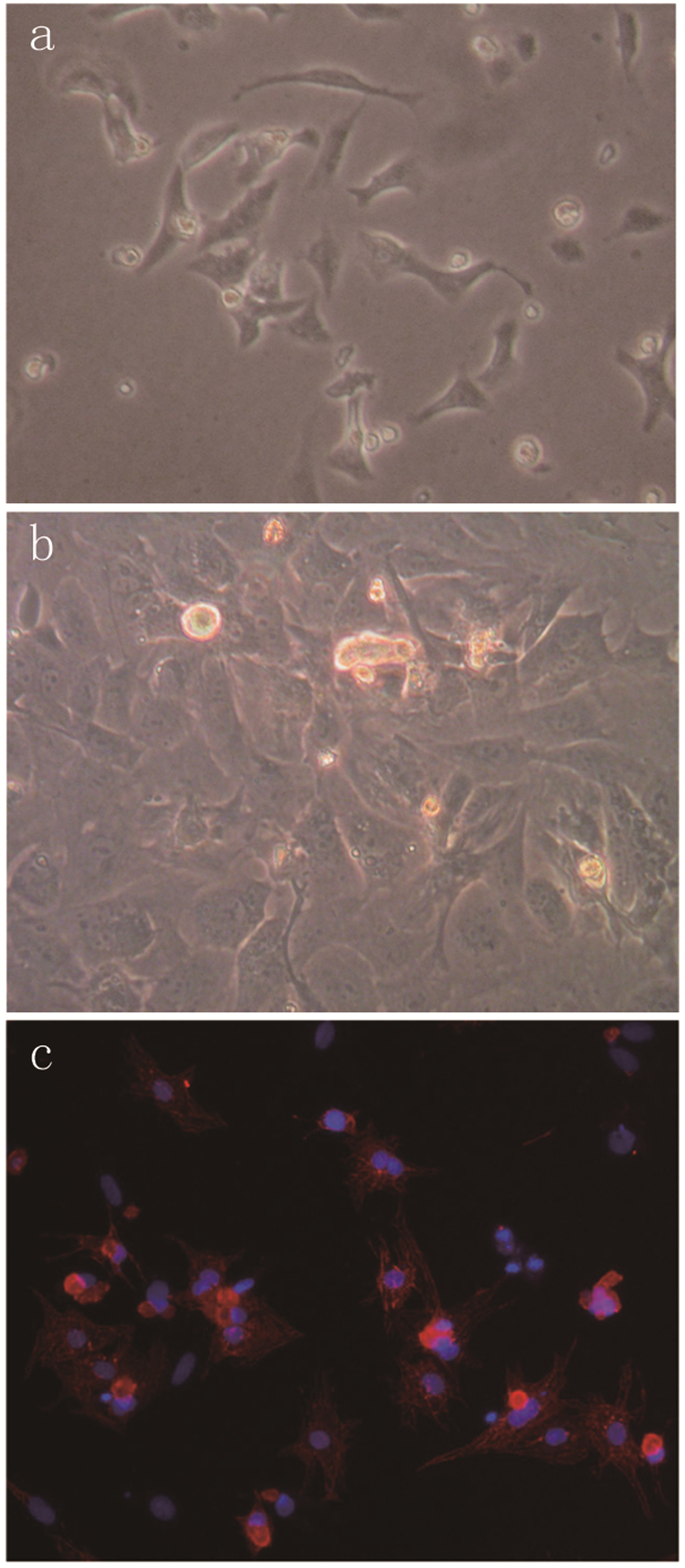
|
图 1
大鼠心肌成纤维细胞(×200)
注:a.原代培养24h心肌成纤维细胞 b.传代培养48h心肌成纤维细胞 c.乳鼠波形蛋白免疫荧光染色心肌成纤维细胞 |
4组间细胞增殖率的比较,差异有统计学意义(F=8.394,P<0.05)。AngⅡ组与正常对照组相比,OD值及细胞增殖率显著增加(P<0.01);Hemin组与AngⅡ组比较,OD值及细胞增殖率显著下降(P<0.01),而ZnppⅨ组与AngⅡ组比较,OD值及细胞增殖率无明显变化(P>0.05)。见表 1。
| 表 1 各组细胞间OD值及细胞增殖率的比较 |
AngⅡ组较正常对照组HO-1升高(P<0.01),Hemin组较AngⅡ组HO-1表达进一步升高(P<0.01);ZnppⅨ组较AngⅡ组HO-1表达水平降低(P<0.01)。

|
图 2
Western blot检测心肌成纤维细胞HO-1蛋白表达水平
注:与正常对照组比较,△P<0.01 与AngⅡ组比较,#P<0.01 与AngⅡ组比较,*P<0.01 |
随着医疗技术的日新月异,心血管疾病的诊治水平也不断提升,但心衰仍为心脏疾病中难以攻克的最后堡垒,及早阻止心衰进展成为心血管疾病治疗的目标之一, 而心肌纤维化是导致心肌重构促进心衰形成的关键环节[4], 因此, 心肌纤维化的相关研究也一直是心血管领域的研究热点。
HO-1是血红素氧合酶家族中的一员, 是体内血红素代谢的重要起始酶和限速酶,能够催化血红素分解为胆绿素、一氧化碳和铁离子。HO-1属诱导型,广泛分布于哺乳动物多种组织细胞中,生理状态下只有少量表达,缺血、缺氧、血红素、应激等因素可诱导其显著表达[5-6]。近年研究提示HO-1与心血管疾病有着密切的联系,对心血管的自我保护和机体稳态的维持起重要作用[7-9], 但对心肌纤维化的影响未见相关报道。本文采用离体大鼠成纤维细胞作为研究对象,AngⅡ刺激体外培养的心肌成纤维细胞,结果显示10-5mol/l的AngⅡ作用心肌成纤维细胞后,细胞增殖率比正常对照组明显增加,证实了AngⅡ可促使心肌成纤维细胞增殖,加重心肌纤维化。与文献报道的AngⅡ过度表达可能会促使心肌成纤维细胞过度增殖一致[10]。故本实验以AngⅡ刺激的增殖细胞为模型, 研究HO-1高表达及低表达后心肌成纤维细胞增殖情况。本文结果显示,Hemin组经过血管紧张素Ⅱ刺激及HO-1诱导剂氯化血红素作用后, 与单纯经过血管紧张素Ⅱ刺激的AngⅡ组比较, HO-1表达升高,心肌成纤维细胞增殖率下降;ZnppⅨ组经过血管紧张素Ⅱ刺激及HO-1抑制剂锌原卟啉-9作用后, 与单纯经过血管紧张素Ⅱ刺激的AngⅡ组比较, HO-1表达下降,细胞增殖率却无明显变化;证明了HO-1可抑制AngⅡ刺激引起的心肌成纤维细胞增殖,进而延缓心肌纤维化的进展,因此,本研究推断HO-1通过抑制心肌成纤维细胞的增殖,在一定程度上抑制了心肌纤维化,延缓心室重构,进而抑制了心衰的进展。
综上所述,对于AngⅡ诱导的心肌纤维化,HO-1可以起到抑制作用,但其具体作用机制尚不明确,可能与血红素产物一氧化碳、胆绿素、和亚铁离子等有关,还有待于进一步研究。因此,HO-1有可能成为治疗心肌纤维化的一个潜在靶点,为我们防治心衰提供新思路。
| [1] |
马金, 丁春华. 心脏成纤维细胞与心肌纤维化[J]. 中华心血管病杂志, 2014, 4(3): 269-272. DOI:10.3760/cma.j.issn.0253-3758.2014.03.021 |
| [2] |
Xue H, Guo H, Li YC, et al. Heme oxygenase-1 induction by hemin protects liver cells from ischemia/reperfusion injury in cirrhotic rats[J]. World J Gastroenterol, 2007, Oct28;13(40): 5384-90. DOI:10.3748/wjg.v13.i40.5384 |
| [3] |
赵榆华, 迟路湘, 陈一茂. 血管紧张素Ⅱ诱导乳鼠心肌细胞凋亡的研究[J]. 第三军医大学学报, 2004, 26(20): 1819-1822. DOI:10.3321/j.issn:1000-5404.2004.20.008 |
| [4] |
Braunwald E. The war against heart failure:the Lancet lecture[J]. Lancet, 2015, 385(9970): 812-824. DOI:10.1016/S0140-6736(14)61889-4 |
| [5] |
Sarady JK, Otterbein SL, Liu F, et al. Carbon monoxide modulates endotoxin-induced production of granulocyte macrophage colony-stimulating factor in macrophages[J]. Am J Respir Cell Mol Biol, 2002, 27(6): 739-745. DOI:10.1165/rcmb.4816 |
| [6] |
Sarady JK, Zuckerbraun BS, Bilban M, et al. Carbon monoxide protection against endotoxic shock involves reciprocal effects on iNOS in the lung and liver[J]. FASEB J, 2004, 18(7): 854-856. DOI:10.1096/fj.03-0643fje |
| [7] |
刘璐, 曹剑, 黄鑫, 等. 上调血红素氧合酶1对代谢综合征大鼠心功能的影响及可能机制[J]. 中华老年心脑血管病杂志, 2016, 18(1): 67-70. DOI:10.3969/j.issn.1009-0126.2016.01.018 |
| [8] |
Jazwa A, Stoszko M, Tomczyk M, et al. HIF-regulated HO-1 gene transfer improves the post-ischemic limb recovery and diminishes TLR-triggered immuneresponses-Effects modified by concomitant VEGF overexpression[J]. Vascul Pharmacol, 2015, 71: 127-138. DOI:10.1016/j.vph.2015.02.011 |
| [9] |
Foo RS, Siow RC, Brown MJ, et al. Heme oxygenase-1 gene transfer inhibits angiotensin Ⅱ-mediated rat cardiac myocyte apoptosis but not hypertrophy[J]. J Cell Physiol, 2006, 209(1): 1-7. DOI:10.1002/jcp.20723 |
| [10] |
Boza P, Ayala P, Vivar R, et al. Expression and function of toll-like receptor 4 and inflammasomes in cardiac fibroblasts and myofibroblasts:IL-1β synthesis, secretion, and degradation[J]. Mol Immunol, 2016, 74: 96-105. DOI:10.1016/j.molimm.2016.05.001 |



