2. 济宁医学院基础医学院, 济宁 272067;
3. 济宁医学院神经生物学研究所, 济宁 272067
2. College of Basic Medicine, Jining Medical University, Jining 272067, China;
3. Neurobiology Key Laboratory of Jining Medical University, Jining 272067, China
流行性乙型脑炎病毒(Japanese encephalitis virus,JEV)隶属于黄病毒科(Flaviviridae)黄病毒属(Flavivirus),为单股正链RNA病毒。JEV感染能够引起严重的中枢神经系统疾病,即流行性乙型脑炎(Japanese encephalitis,JE),简称乙脑。作为蚊媒病毒,JEV可被多种蚊虫携带和传播,鸟被认为是JEV的传播宿主,病毒可通过候鸟迁徙进行远距离播散[1]。据世界卫生组织报道,目前在亚洲和西太平洋地区的24个国家或地区存在乙脑的流行,全世界约30亿人生活在乙脑流行区,每年乙脑病例发生约50000例,其中死亡15000例[2]。随着全球变暖以及旅游和贸易的发展,全球每年出现大量乙脑非流行地区的输入性病例。因此,乙脑成为国际关注的严重公共卫生问题。
目前,对乙脑的控制主要依赖监测和疫苗接种,尚无特异性疗法。因此,阐明JEV感染发生过程中神经元损伤以及基因表达与调控机制尤为重要。miRNA作为一类具有调控功能的非编码RNA分子,可能是影响宿主免疫反应和病毒复制过程的关键因素,在病毒与宿主相互作用过程中发挥重要的调控作用。我们在前期研究中利用miRNA芯片检测了SH-SY5Y细胞感染JEV后miRNA表达谱。在此基础上,我们选择表达差异显著的miR let-7f作为研究对象,探索其对JEV在神经元细胞中复制的影响。
1 材料与方法 1.1 材料SH-SY5Y细胞为本实验室保存培养。细胞培养所需DMEM培养基和胎牛血清均购自美国Gibco公司,青霉素和链霉素购自Hyclone。miRNA表达谱检测采用Affymetrix miRNA表达谱芯片,由上海吉凯公司完成检测。细胞总RNA提取所需Trizol试剂和转染试剂Lipofectamine 2000均购自Invitrogen公司。miRNA检测所需All-in-one miRNA qRT-PCR Detection Kit购自美国Genecopoeia公司。特异性引物his-miRlet-7f primers、miR let-7f mimics、miR let-7f inhibitor和miRNAcontrol均购自GenePharma公司。反转录试剂盒Ready to GoTM You prime First Strand Beads购自GE Healthcare公司。实时荧光定量检测试剂SuperReal PreMix Plus(SYBR Green)购自天根公司。
1.2 方法 1.2.1 细胞培养和病毒感染SH-SY5Y细胞培养采用DMEM培养基,加入100 U/ml青霉素、100μg/ml链霉素和10%胎牛血清。细胞置于37℃,5% CO2培养箱进行培养。待SH-SY5Y细胞生长至约90%单层时,对照组加入病毒稀释液, JEV感染组将JEV以MOI=1感染细胞,分别于感染后不同时间分别收获细胞和上清用于后续检测。
1.2.2 miRNA芯片检测采用Affymetrix miRNA表达谱芯片进行miRNA表达谱检测。以Trizol法进行总RNA抽提,抽提所得总RNA经NanoDrop 2000和Agilent Bioanalyzer 2100质检合格后,按照标准操作规程进行芯片实验。miRNA表达有显著差异的筛选标准为表达量变化倍数在2倍以上(P<0.05)[3]。
1.2.3 miR let-7f表达检测采用Trizol试剂提取细胞的总RNA,采用All-in-one miRNA qRT-PCR Detection Kit和特异性引物his-miRlet-7f primers检测let-7f表达水平,以U6作为内参,采用2-△△Ct相对定量法进行miR let-7f表达相对定量。
1.2.4 miR let-7f的过表达和抑制表达为明确miR let-7f对病毒复制的影响,设置miR let-7f mimics组、miR let-7f inhibitor组和miRNA control组进行检测。使用转染试剂Lipofectamine 2000分别将miR let-7f mimics、miR let-7f inhibitor和miRNA阴性对照转入SH-SY5Y细胞,具体操作按照说明书进行。转染后24h,以MOI=1感染JEV,感染后12h分别收获细胞和上清用于后续检测。
1.2.5 JEV RNA检测利用反转录试剂盒Ready to GoTM You prime First Strand Beads将总RNA逆转录成cDNA,采用安捷伦Mx3000P荧光定量PCR仪和SuperReal PreMix Plus(SYBR Green)进行qRT-PCR对JEV进行核酸定量。所用引物和PCR条件参考文献[4]。实验重复3次,结果以3次实验结果的x±s表示。
1.2.6 病毒滴度测定采用空斑形成试验测定细胞培养上清中的病毒滴度。将BHK-21细胞传至6孔板,37℃ 5%CO2培养至细胞达90%融合。将待测细胞上清进行10倍系列稀释,感染6孔板内细胞,吸附60min后每孔加入3ml营养琼脂覆盖,待琼脂完全凝固后继续培养。当观察到细胞病变时,覆盖添加0.75%中性红的第二层营养琼脂。通过观察计数空斑数量计算病毒滴度。实验重复3次。
1.3 统计学方法使用SPSS19.0统计学软件进行统计分析。采用方差分析进行多组间总体比较,采用SNK-q检验作进一步地两两比较,P<0.025认为差异具有统计学意义。
2 结果 2.1 miRNA芯片结果与对照组相比,SH-SY5Y细胞感染JEV后有37个miRNA呈现显著表达差异,其中上调的miRNA有28个,下调的miRNA有9个,表达差异最大的10个miRNA见表 1。JEV感染引起了miRNA表达谱变化。其中miR let-7f的表达上升了3.67倍,提示miR let-7f参与了JEV感染过程。
| 表 1 miRNA芯片检测SH-SY5Y细胞感染JEV后miRNA表达变化 |
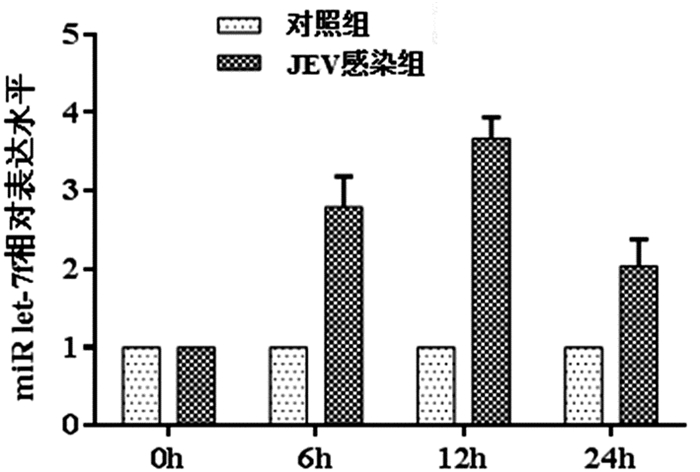
将JEV以MOI=1感染SH-SY5Y细胞,分别在感染0、6、12、24h收集细胞。以U6为内参对照,利用qRT-PCR检测细胞内miR let-7f相对表达量,发现SH-SY5Y细胞感染JEV 6h miR let-7f表达升高2.79倍,感染12h升至3.67倍,达最高水平。见图 1。
|
图 1 SH-SY5Y细胞感染JEV后miR let-7f表达变化 |
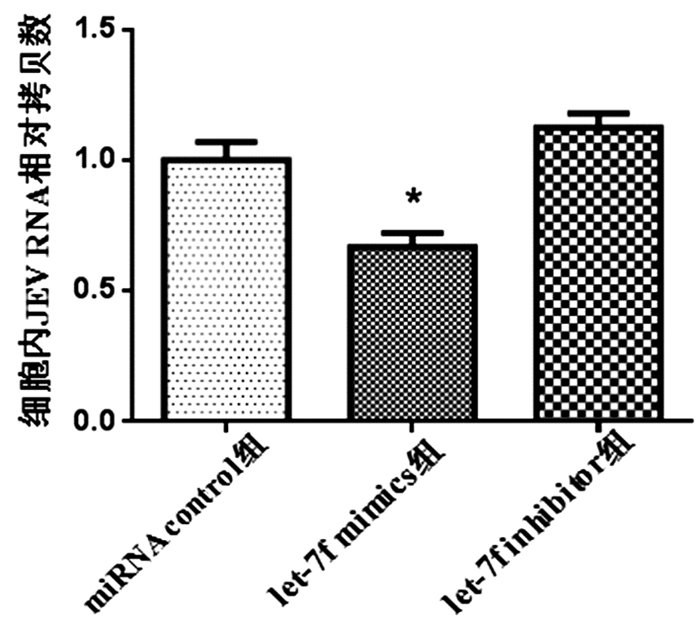
与miRNA control组和miR let-7f inhibitor组相比,miR let-7f mimics组细胞内JEV病毒RNA拷贝数明显降低,差异具有统计学意义(P<0.025)。见图 2。
|
图 2 miR let-7f对JEV感染SH-SY5Y细胞内病毒RNA的影响 注:3组间比较,F=45.95,P<0.05;与miRNA control组及miR let-7f inhibitor组比较,*P<0.025,n=6 |
与miRNA control组和miR let-7f inhibitor组相比,miR let-7f mimics组细胞上清中JEV滴度明显降低,差异具有统计学意义(P<0.025)。见图 3。

|
图 3 miR let-7f对JEV感染SH-SY5Y细胞培养上清中病毒滴度的影响 注:3组间比较,F=76.11,P<0.05;与miRNA control组及miR let-7f inhibitor组比较,*P<0.025,n=6 |
乙脑是世界最严重的病毒性脑炎,病死率高达35%~40%,20%~70%的患者会留下永久性神经系统后遗症,给国家和家庭带来严重疾病负担。目前,乙脑尚无特异性疗法,探索乙脑发生过程的分子机制成了重要的科学问题。在乙脑感染过程中,JEV突破血脑屏障后首先靶向神经元,引起神经元损伤和死亡,从而导致一系列神经系统临床症状。考虑到JEV的嗜神经性,以及神经元细胞损伤和死亡在乙脑发生中的重要作用,本研究选用人神经母细胞瘤SH-SY5Y细胞作为模型进行相关研究。
miRNA在JEV感染和乙脑的发生发展过程中发挥重要作用。JEV感染后miR-155可以抑制SHIP1表达,增强IFN-β和前炎性细胞因子的产生和释放,促进中枢神经系统损伤中的炎症反应和氧化应激[5];人小胶质细胞CHME3中过表达miR-155会显著抑制JEV的增殖[6];JEV感染神经胶质细胞后,通过上调miR-146a抑制NF-κB活性,破坏Jak-STAT信号传导通路,有利于病毒逃脱细胞免疫,促进病毒复制[7]。上述研究主要集中于miRNA在JEV感染神经胶质过程中的作用,关于JEV感染神经元细胞后miRNA的差异表达谱则鲜有报道。本研究利用miRNA芯片,将感染JEV的SH-SY5Y细胞和未感染的SH-SY5Y细胞进行miRNA表达比较,发现差异表达超过2倍的miRNA有37个,其中上调的有28个,下调的有9个。这表明在JEV感染神经元细胞过程中的确存在miRNA的参与。
本研究发现的37个差异表达miRNA中,miR let-7f表达显著上调,并采用qRT-PCR加以验证。let-7最早在肿瘤学领域被广泛研究,肺癌、卵巢癌、乳腺癌中均有不同程度的表达,通过与RAS[8]、HMGA2[9]、c-MYC[10]这些原癌基因的3'-UTR结合,抑制肿瘤的发生和发展。let-7家族在许多病毒感染过程也发挥重要的调控作用,如let-7b通过与丙肝病毒(hepatitis C virus, HCV)基因组相互作用抑制HCV的感染性[11];let-7a通过靶向MAP4K4信号通路抑制卡波西肉瘤相关疱疹病毒(Kaposi’s sarcoma-associated herpesvirus, KSHV)的复制[12];let-7g能够抑制乙肝病毒(inhibits hepatitis B virus, HBV)preS2蛋白表达和病毒增殖[13]。尤其值得关注的是,let-7a和let-7b(let-7a/b)在感染JEV的神经胶质细胞中表达上调,通过外泌体释放到细胞外的let-7a/b可以转入神经元细胞,通过活化caspases促进神经元损伤[14]。因此,let-7家族在乙脑的发生过程中可能发挥重要的调控作用,let-7f在JEV感染神经元细胞中的作用值得进一步探索。
在病毒感染过程中,宿主miRNA参与包括JEV在内的许多病毒的生命周期[4-6, 10-12]。本文将let-7f mimics转染SH-SY5Y细胞后感染JEV,细胞内JEV病毒RNA拷贝数明显减少,释放至细胞上清中的病毒颗粒数量也明显降低,表明let-7f对JEV复制具有抑制作用。miRNA对于病毒复制的调控主要有以下途径:通过直接与病毒基因组结合,影响病毒的复制;通过调控宿主自身基因的表达,尤其是固有免疫相关基因表达,从而间接影响病毒复制[15]。那么let-7f通过何种机制影响JEV复制仍是重要的科学问题。后续可以采用生物信息软件预测JEV与let-7f之间是否存在结合位点并加以验证,以明确let-7f是否通过与病毒基因组结合抑制病毒复制。此外,JEV需要依赖细胞内膜结构进行病毒的复制和组装,而神经元细胞感染JEV后产生内质网压力和活性氧可诱导细胞凋亡和炎症反应,这些与细胞自噬和病毒复制密切相关[16]。let-7家族参与中枢神经系统炎症的发生发展[17];let-7a/b在JEV感染过程中可以转入神经元细胞活化caspases促进神经元损伤[13]。在JEV感染神经元细胞过程中,let-7f是否参与神经元细胞的损伤凋亡以及细胞自噬需要进一步的工作进行阐释。
综上所述,miRNA作为一种重要的转录后调控机制,在JEV感染过程中具有重要地位,miR let-7f在感染JEV的神经元细胞中呈现差异表达,并对病毒复制具有显著的抑制作用,进一步阐释其具体作用机制将为开发分子治疗靶点提供基础数据。
| [1] |
高晓艳, 周海卫, 刘红, 等.乙脑病毒的空间播散及迁徙事件研究[J].病毒学报, 31(3): 264-268.DOI: 10.13242/j.cnki.bingduxuebao.002694.
|
| [2] |
Borthakur A, Das N, Bora B. Data from the World Health Organization(WHO)National Network laboratory for Japanese Encephalitis[J]. J Glob Infect Dis, 2013, 5(2): 76-79. DOI:10.4103/0974-777X.112294 |
| [3] |
Munagala R, Aqil F, Vadhanam MV, et al. MicroRNA 'signature' during estrogen-mediated mammary carcinogenesis and its reversal by ellagic acid intervention[J]. Cancer Lett, 2013, 339(2): 175-184. DOI:10.1016/j.canlet.2013.06.012 |
| [4] |
Shao N, Li F, Nie K, et al. TaqMan real-time RT-PCR assay for detecting and differentiating Japanese encephalitis virus[J]. Biomed Environ Sci, 2018, 31(3): 208-214. DOI:10.3967/bes2018.026 |
| [5] |
Thounaojam MC, Kundu K, Kaushik DK, et al. MicroRNA 155 regulates Japanese encephalitis virus-induced inflammatory response by targeting Src homology2-containing inositol phosphatase 1[J]. J Virol, 2014, 88(9): 4798-810. DOI:10.1128/JVI.02979-13 |
| [6] |
Pareek S, Roy S, Kumari B, et al. MiR-155 induction in microglial cells suppresses Japanese encephalitis virus replication and negatively modulates innate immune responses[J]. J Neuroinflammation, 2014(11): 97. DOI:10.1186/1742-2094-11-97 |
| [7] |
Sharma N, Verma R, Kumawat KL, et al. miR-146a suppresses cellular immune response during Japanese encephalitis virus JaOArS982 strain infection in human microglial cells[J]. J Neuroinflammation, 2015, 12(1): 30. DOI:10.1186/s12974-015-0249-0 |
| [8] |
Lee YS, Dutta A. The tumor suppressor microRNA let-7 represses the HMGA2 oncogene[J]. Genes Dev, 2007, 21(9): 1025-1030. DOI:10.1101/gad.1540407 |
| [9] |
Sampson VB, Rong NH, Han J, et al. MicroRNA let-7a down-regulates MYC and reverts MYC-induced growth in burkitt lymphoma cells[J]. Cancer Res, 2007, 67(20): 9762-9770. DOI:10.1158/0008-5472.can-07-2462 |
| [10] |
Johnson SM, Grosshans H, Shingara J, et al. RAS is regulated by the let-7 microRNA family[J]. Cell, 2005, 120(5): 635-647. DOI:10.1016/j.cell.2005.01.014 |
| [11] |
Cheng JC, Yeh YJ, Tseng CP, et al. Let-7b is a novel regulator of hepatitis C virus replication[J]. Cell Mol Life Sci, 2012, 69(15): 2621-2633. DOI:10.1007/s00018-012-0940-6 |
| [12] |
Tan X, Gao Y, Nan Y, et al. Cellular MicroRNA let-7a suppresses KSHV replication through targeting MAP4K4 signaling pathways[J]. PLoS One, 2015, 10(7): e0132148. DOI:10.1371/journal.pone.0132148 |
| [13] |
Takata A, Otsuka M, Ohno M, et al. Mutual antagonism between hepatitis B viral mRNA and host microRNA let-7[J]. Sci Rep, 2016, 6: 23237. DOI:10.1038/srep23237 |
| [14] |
Mukherjee S, Akbar I, Kumari B, et al. Japanese encephalitis virus-induced let-7a/b interacted with the NOTCH-TLR7 pathway in microglia and facilitated neuronal death via caspase activation[J]. J Neurochem, 2019, 149(4): 518-534. DOI:10.1111/jnc.14645 |
| [15] |
魏建春, 安静. 微小RNA在病毒与宿主相互作用中的功能[J]. 微生物与感染, 2017(1): 57-64. DOI:10.3969/j.issn.1673-6184.2017.01.011 |
| [16] |
刘娜, 李文娟. 自噬与中枢神经系统疾病及小胶质细胞活化相关研究进展[J]. 济宁医学院学报, 2018, 41(5): 635-647. DOI:10.3969/j.issn.1000-9760.2018.05.04 |
| [17] |
Dhahri, Wahiba, Dussault, et al. Reduced expression of let-7f activates TGF-β/ALK5 pathway and leads to impaired ischaemia-induced neovascularization after cigarette smoke exposure[J]. J Cell Mol Med, 2019, 21(9): 2211-2222. DOI:10.1111/jcmm.13144 |



