黑质多巴胺神经元的减少和路易小体的形成是帕金森病(Parkinson's Disease, PD)主要的病理特征[1]。临床上,PD的主要症状包括静止性震颤、姿势步态障碍及运动迟缓等[1]。此外,PD患者还伴随着一些非运动症状如睡眠障碍、疲劳、焦虑、抑郁及认知能力下降等[2]。研究发现,遗传因素、表观遗传改变、线粒体功能异常及蛋白酶体系统异常等都是促进PD发生的重要因素[1]。目前尚不完全清楚黑质多巴胺神经元退行性病变及路易小体形成的具体分子机制。随着的研究不断深入,发现PD患者脑中小胶质细胞呈现出显著的激活状态[3],提示神经炎症反应在PD病理过程中发挥重要作用。此外,越来越多的动物实验和体外实验也显示小胶质细胞介导的神经炎症反应参与PD的发生发展过程中[4]。
小胶质细胞在所有胶质细胞中占5%~12%,但其在每个脑区所占的具体比例因脑区不同而呈现出差异表达[5]。小胶质细胞具有免疫防御的功能,维持脑内的稳态,被认为是脑内主要的免疫性细胞[5-6]。正常生理条件下,小胶质细胞处于静息或不活跃状态,但其仍可通过主动收缩和扩展运动移动位置,从而参与到整个神经系统的调控过程中[7]。在外界刺激及损伤条件下,小胶质细胞会发生形态的显著改变,并且快速移动到损伤部位,进而参与组织损伤修复及疾病发生发展过程中[7-8]。小胶质细胞的激活会产生大量的炎症因子如白细胞介素-1β(interleukin-1β, IL-1β)、肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)、白细胞介素-6(interleukin-6, IL-6)及白细胞介素-12(interleukin-12, IL-12),进而导致局部组织产生炎症反应[9-10]。本文将综述小胶质细胞介导的神经炎症在PD中的作用,为PD的预防和治疗提供新的参考。
1 小胶质细胞 1.1 来源小胶质细胞广泛分布于中枢神经系统中,关于小胶质细胞的来源尚存在争议。有的研究者认为小胶质细胞来源于中胚层细胞,如卵黄囊的胎儿巨噬细胞或软脑膜中的胚胎间充质细胞等[5]。这种观念最早是由Del Rio-Hortega提出,基于胚胎脑中软脑膜细胞的碳酸银染色,Del Rio-Hortega提出脑内小胶质细胞来源于中胚层,随着胚胎的发育,这些中胚层细胞在后期侵入脑中形成小胶质细胞[5]。这种观念后来也被许多学者通过光学显微镜分析及免疫组化等方法证实[5, 11]。与此相对的,一些研究者认为小胶质细胞来源于神经外胚层,而不是中胚层。有研究者利用巨噬细胞特异性标记蛋白Ricinus communis agglutinin-1(RCA-1)及小胶质细胞特异性标记蛋白进行免疫染色,结果提示小胶质细胞不是来源于软脑膜间充质细胞而是来源于生发层基质[5, 12]。此外,另有一些研究者认为小胶质细胞来源于血液循环中的单核细胞[5]。因此,目前对于小胶质细胞的来源仍需要更多的实验证据阐明。
1.2 生物学活性作为脑内的免疫性细胞,小胶质细胞目前被认为有两种状态,分别为M1型和M2型[13],其中M1型细胞为促炎症状态,M2型为抗炎性状态,且M2型细胞包括M2a、M2b及M2c 3种类型[14]。在M1型状态下,小胶质细胞主要以分泌炎症因子为主,如IL-1β、IL-6、TNF-α、IL-12及诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)等炎症相关因子,以引起局部组织的炎症反应,导致组织损伤及细胞凋亡,进而引起神经退行性病变过程。因此,通常情况下,这些炎症相关因子作为M1型小胶质细胞的标志蛋白。研究发现,体外利用炎症相关因子如细菌脂多糖(Lipopolysaccharides, LPS)及γ-干扰素(Interferon-γ, IFN-γ)共同刺激原代培养的小胶质细胞能诱导小胶质细胞形成M1型状态[13-15]。而在M2型状态下,小胶质细胞主要以分泌生长因子及抗炎因子为主,如转化生长因子-β(transforming growth factor-β, TGF-β)、白细胞介素-10(interleukin-10, IL-10)、精氨酸酶-1(Arginase-1, Arg-1)、类抵抗素α(resistin-like alpha, RELMα/FIZZ1)、多糖酶(chitinase 3-like protein 3, CHI3L3/YM1)及CD206等因子,因此,这些相关因子通常作为M2型小胶质细胞的标志蛋白。这些M2相关因子具有抗炎症反应的功效,能够降低组织的炎症反应,从而促进组织的修复过程[15]。体外给予小胶质细胞白细胞介素-4(interleukin-4, IL-4)刺激能够诱导小胶质细胞的M2状态[15]。
炎症和非炎症状态下会引起小胶质细胞内miRNA表达水平的改变,这些miRNA调控细胞内炎症相关信号通路,进而产生促炎或抗炎效应。例如,在炎性刺激如LPS及IFN-γ共同刺激下可显著上调小胶质细胞的miR-155的表达水平,而IL-4刺激则不能引起小胶质细胞的miR-155的表达。研究发现,miR-155能够调控下游SOCS1、Creb及Bcl6等促炎症信号通路,上述研究提示miRNA也会特异性地参与到小胶质细胞的状态调控过程中[15-17]。在正常情况下,这两种状态的小胶质细胞处于动态平衡,但处于外界损伤刺激或疾病状态下,这种动态平衡就会遭到破坏,导致机体迅速做出反应进而调控这两种状态的小胶质细胞的动态平衡。然而目前并不清楚这两种状态下的小胶质细胞在生理条件下和病理条件下是以何种形式存在及其具体分子机制。
很多因素会影响小胶质细胞的两种状态,并且在特定的条件下,小胶质细胞的两种状态可以发生转变。Zhang等[18]利用蛋白印迹及实时定量PCR等方法发现乙酰胆碱(Acetylcholine, Ach)能够降低LPS导致的小胶质细胞系BV2细胞内的促炎症因子IL-1β及IL-6的表达水平,明显降低抑炎症因子IL-4及IL-10的表达水平,并且能显著降低炎症相关通路JAK2/STAT3及PI3K/Akt通路的活性。有趣的是,利用病毒转染的方法降低Ach受体烟碱乙酰胆碱受体α7亚型(the α7 subtype of the nicotinic acetylcholine receptor, α7nAChR)的表达水平则显著降低Ach引起的效应[18]。提示,Ach通过与其受体α7nAChR结合引起下游信号分子表达水平的改变,进而促进BV2细胞由M1向M2型转变。上述研究说明,激活α7nAChR能抑制小胶质细胞向M1型转变,而促进其向M2型转变(图 1)。此外,β-石竹烯(-Caryophyllene, -CP)通过Ⅱ型大麻素受体(Type 2 cannabinoid receptor, CB2)显著降低LPS引起的促炎症因子IL-1β及TNF-α等的表达水平,并且上调下游抗炎相关因子IL-10及Agr-1的表达水平,从而促进小胶质细胞由M1状态向M2状态转变[19](图 1)。上述研究说明,小胶质细胞的两种状态在特定条件下是可以转变的。此外,研究发现,神经系统疾病如老年痴呆(Alzheimer’s disease, AD)、多发性硬化(multiple sclerosis, MS)都伴随着炎症的发生发展[19],因此, 小胶质细胞两种不同功能状态的存在及转变为这些炎症相关的神经系统疾病提供了新的药物靶点。
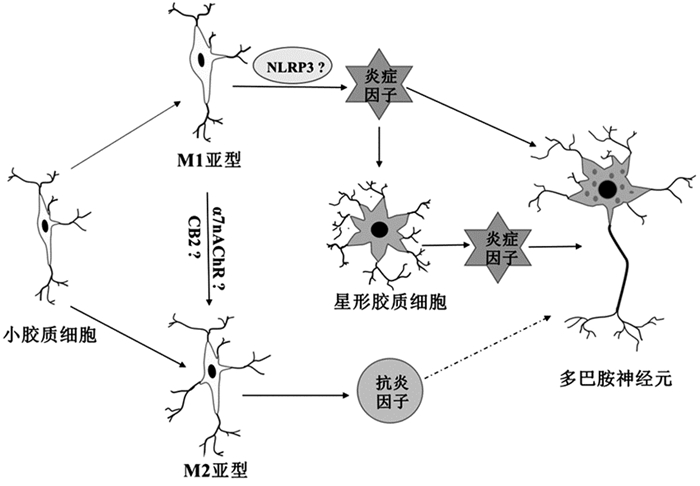
|
图 1 小胶质细胞介导的炎症反应在PD中的作用机制 |
在炎症状态下,小胶质细胞会呈现出明显的激活状态,主要表现在细胞形态及特异性蛋白表达。一方面其胞体会变大,突起缩短变粗;另一方面小胶质细胞的特异性标志蛋白钙结合蛋白IBA1的表达水平会显著升高[20]。PD的进程伴随着炎症反应的发生发展;Gerhard等[21]采用正电子发射断层扫描发现,PD患者脑中呈现出大量的小胶质细胞的激活;此外,PD患者脑中炎症因子如IL-1β、IL-6及TNF-α的表达水平显著升高[22];在神经毒素MPTP及6-OHDA诱导的PD动物模型中,小胶质细胞也会呈现出明显的激活状态[23-24]。上述研究说明,小胶质细胞作为脑内免疫性细胞,在PD病理过程中的炎症反应过程中发挥重要作用。
在外界刺激如α突触核蛋白聚集或LPS的作用下,一方面机体内小胶质细胞会快速做出应答并处于显著的激活状态,释放大量的炎症因子,使得损伤部位处于炎症状态下,这些炎症因子会进一步作用于脑中的另一种胶质细胞-星形胶质细胞。受到刺激的星形胶质细胞也会激活并释放炎症因子,由小胶质细胞和星形胶质细胞释放的炎症因子同时作用于多巴胺神经元,从而使多巴胺神经元发生退行性病变;另一方面,病变的神经元会释放大量的毒性因子持续激活小胶质细胞,使机体处于明显的炎症状态,这种循环往复的过程最终加剧了PD的发生发展[25-26]。因此,小胶质细胞介导的炎症反应与PD的发生发展密切相关。
2.2 作用机制Peng等[27]研究发现,LPS导致的小胶质细胞的激活能显著增强神经毒素MPP+导致的多巴胺神经元细胞系的退行性病变过程,增加SH-SY5Y细胞内的JNK及NF-kb的表达水平。此外,研究还发现激活的小胶质细胞能增强多巴胺神经元细胞系内的凋亡相关基因如bax的表达水平。上述结果提示,体外药物引起的小胶质细胞的激活可能通过调控多巴胺神经元内的特定的信号通路的活性,进而加剧多巴胺神经元的死亡[27]。慢性不可预见的轻度压力刺激能显著增强LPS引起的PD大鼠的多巴胺神经元的死亡。慢性不可预见的轻度压力一方面可显著增强大鼠脑内小胶质细胞的激活程度及炎症反应,另一方面也显著增加炎症小体NLRP3的激活及黑质多巴胺神经元的死亡,说明体内小胶质细胞的激活通过调控黑质区域的炎症小体的活性及炎症反应影响多巴胺神经元的存活[28]。因此,有效地降低小胶质细胞的激活程度能显著降低药物引起的PD模型中多巴胺神经元的退行性病变过程。
小胶质细胞有两种表现形式M1型和M2型,聚集形式、硝化形式或氧化形式的α突触核蛋白能引起小胶质细胞的氧化应激反应,促进小胶质细胞形成M1型激活形式[26, 29]。MPTP或LPS处理能诱导小胶质细胞产生大量的炎症因子,使小胶质细胞呈现M1型激活形式[25-26]。Pisaha等[30]研究发现给予小鼠长期注射MPTP及丙磺舒在早期会引起抗炎小胶质细胞数目明显多于促炎小胶质细胞,然而随着药物的逐渐注射,促炎小胶质细胞数目显著增多,而抑炎小胶质细胞数目显著降低,说明在PD的特定时期,M2型小胶质细胞占主导地位,随着疾病的逐渐加剧,大多数小胶质细胞释放炎症因子逐渐增多,从而使得多数小胶质细胞呈现出显著的M1型状态。长期MPTP及丙磺舒处理会引起小鼠黑质区域内的小胶质细胞内CD206的表达水平显著下降,说明小胶质细胞的两种激活型式在PD发生过程中的复杂性。目前已有大量的研究表明M1型的胶质细胞产生的炎症反应会导致多巴胺神经元退行性病变过程[4, 25-26],然而目前尚不完全清楚M2型胶质细胞在PD发生发展中的具体作用(图 1)。
Yu等[24]利用小胶质细胞系BV2细胞及多巴胺神经元细胞系MN9D细胞进行共培养,给予神经毒素6-OHDA及微管稳定剂EpoB处理,采用TUNEL凋亡染色检测MN9D细胞的活性,发现EpoB显著降低6-OHDA导致的细胞死亡。EpoB能显著降低小胶质细胞炎症因子如IL-1β、IL-6及TNF-α的表达水平,从而抑制小胶质细胞的M1状态。EpoB一方面能够显著降低6-OHDA导致的黑质区域小胶质细胞的激活,另一方面也能够显著降低6-OHDA导致的神经毒性并且显著增强小鼠的运动能力。上述研究提示,EpoB通过抑制小胶质向M1状态转变,从而降低6-OHDA对多巴胺神经元的神经毒性作用。因此,抑制小胶质细胞的M1状态能明显降低神经毒素导致的多巴胺退行性病变过程。降低PD发生发展过程中的M1状态的小胶质细胞或增强M2小胶质细胞有望成为治疗PD的有效途径。
炎症小体NLRP3在神经炎症发生发展中具有重要作用。体内代谢物如β淀粉样蛋白和25-羟基胆固醇异常聚集时会导致NLRP3的激活,进而引起凋亡相关酶-含半胱氨酸的天冬氨酸水解酶1(caspase-1)的活化及IL-1β的释放增多,从而启动炎症反应过程[23]。NLRP3缺失能显著降低神经毒素MPTP引起的小鼠黑质区域的小胶质细胞的激活及多巴胺神经元的死亡。在给予MPTP处理后,敲除NLRP3的小鼠的运动能力显著增强[23]。PD小鼠中NLRP3蛋白表达水平显著上调。NLRP3炎症小体的激活程度与PD的发生发展密切相关。山奈酚(kaempferol)能够通过抑制炎症小体NLRP3的激活降低PD小鼠中多巴胺神经元的退行性病变。山奈酚主要是通过引起NLRP3蛋白的降解调控该过程的。降低NLRP3炎症小体的激活程度能显著降低神经毒素引起的多巴胺神经元退行性病变过程[31]。因此,NLRP3在PD的退行性病变过程中发挥重要作用。MPTP及ATP处理能引起小胶质细胞下游caspase-1活性的增加,可引起IL-1β表达水平的升高,而NLRP3敲除能够显著降低MPTP及ATP引起的caspase-1活性的增加及IL-1β表达的升高。MPTP及ATP刺激能显著增加PI阳性的SH-SY5Y细胞,而在SH-SY5Y细胞分别与NLRP3-/-的小胶质细胞共培养体系中,MPTP及ATP刺激则没有引起明显的SH-SY5Y细胞死亡。因此,小胶质细胞内NLRP3炎症小体的激活在多巴胺神经元细胞的退行性病变中发挥重要作用(图 1)。
3 小结与展望小胶质细胞介导的神经炎症反应在PD的发生发展过程中发挥重要作用,然而目前并不完全清楚小胶质细胞的两种状态在PD中的具体作用机制。小胶质细胞在不同的条件刺激下呈现出不同的激活状态,分别表现出促炎和抑炎状态的M1型和M2型。小胶质细胞的两种状态在特定条件下可以发生转变,研究发现两种状态下的小胶质细胞呈现促炎和抗炎两种完全不同的功能,因此更好地探究小胶质细胞的两种状态在PD发生发展中的作用机制及两种状态的关系一方面有助于更深刻地理解PD的发病机理,另一方面也为PD的预防和治疗提供更多的可能和更准确的药物靶点。
此外,小胶质细胞内炎症小体的激活也参与到小胶质细胞介导的神经炎症过程中。而炎症小体种类较多,各个炎症小体在小胶质细胞介导的炎症反应过程中的作用尚不完全清楚。因此,目前需要更多的临床和动物实验去阐释炎症小体在小胶质细胞炎症反应过程中的具体作用,为更深入地了解小胶质细胞介导的神经炎症在PD中的功能提供更多的理论基础。
| [1] |
Wang QQ, Zhou QB, Zhang SZ, et al. Elevated hapln2 expression contributes to protein aggregation and neurodegeneration in an animal model of parkinson's disease[J]. Front Aging Neurosci, 2016, 8: 197. DOI:10.3389/fnagi.2016.00197 |
| [2] |
Valldeoriola F, Salvador A, Gómez-Arguelles JM, et al. The effects of transdermal rotigotine on non-motor symptoms of Parkinson's disease:a multicentre, observational, retrospective, post-marketing study[J]. Int J Neurosci, 2018, 128(4): 369-375. DOI:10.1080/00207454.2017.1387111 |
| [3] |
Santos CC, Araújo FM, Ferreira RS, et al. Aminochrome induces microglia and astrocyte activation[J]. Toxicol In Vitro, 2017, 42: 54-60. DOI:10.1016/j.tiv.2017.04.004 |
| [4] |
Pain S, Vergote J, Gulhan Z, et al. Inflammatory process in Parkinson disease:neuroprotection by neuropeptide Y[J]. Fundam Clin Pharmacol, 2019. DOI:10.1111/fcp.12464 |
| [5] |
Kaur C, Rathnasamy G, Ling EA. Biology of microglia in the developing brain[J]. J Neuropathol Exp Neurol, 2017, 76(9): 736-753. DOI:10.1093/jnen/nlx056 |
| [6] |
闫簌簌, 刘传新. 小胶质细胞与抑郁症发病机制研究进展[J]. 济宁医学院学报, 2019, 42(2): 144-148. DOI:10.3969/j.issn.1000-9760.2019.02.016 |
| [7] |
Hanamsagar R, Bilbo SD. Sex differences in neurodevelopmental and neurodegenerative disorders:Focus on microglial function and neuroinflammation during development[J]. J Steroid Biochem Mol Biol, 2016, 160: 127-133. DOI:10.1016/j.jsbmb.2015.09.039 |
| [8] |
Maeda T, Inagaki M, Fujita Y, et al. ATP increases the migration of microglia across the brain endothelial cell monolayer[J]. Biosci Rep, 2016, 36(2): e00318. DOI:10.1042/BSR20160054 |
| [9] |
Li XL, Wang YL, Zheng J, et al. Inhibiting expression of HSP60 and TLR4 attenuates paraquat-induced microglial inflammation[J]. Chem Biol Interact, 2019, 299: 179-185. DOI:10.1016/j.cbi.2018.12.013 |
| [10] |
刘娜, 李文娟. 自噬与中枢神经系统疾病及小胶质细胞活化研究进展[J]. 济宁医学院学报, 2018, 41(5): 358-362. DOI:10.3969/j.issn.1000-9760.2018.05.016 |
| [11] |
Cammermeyer J. The life history of the microglial cell:a light microscopic study[J]. Neurosci Res, 1970, 3: 43-129. |
| [12] |
Cuadros MA, Moujahid A, Quesada A, et al. Development of microglia in the quail optic tectum[J]. J Comp Neurol, 1994, 348(2): 207-224. DOI:10.1002/cne.903480204 |
| [13] |
Han DX, Yu ZW, Liu WL, et al. Plasma Hemopexin ameliorates murine spinal cord injury by switching microglia from the M1 state to the M2 state[J]. Cell Death Dis, 2018, 9(2): 181. DOI:10.1038/s41419-017-0236-8 |
| [14] |
Carniglia L, Ramírez D, Durand D, et al. [nle4, D-phe7] -α-MSH inhibits toll-like receptor (TLR)2-and TLR4-induced microglial activation and promotes a M2-like phenotype[J]. PLoS One, 2016, 11(6): e0158564. DOI:10.1371/journal.pone.0158564 |
| [15] |
Amici SA, Dong J, Guerau-de-Arellano M. Molecular mechanisms modulating the phenotype of macrophages and microglia[J]. Front Immunol, 2017, 8: 1520. DOI:10.3389/fimmu.2017.01520 |
| [16] |
Jablonski KA, Gaudet AD, Amici SA, et al. Control of the inflammatory macrophage transcriptional signature by mir-155[J]. PLoS One, 2016, 11(7): e0159724. DOI:10.1371/journal.pone.0159724 |
| [17] |
Cardoso AL, Guedes JR, Pereira de Almeida L, et al. MiR-155 modulates microglia-mediated immune response by down-regulating SOCs-1 and promoting cytokine and nitric oxide production[J]. Immunology, 2012, 135(1): 73-88. DOI:10.1111/j.1365-2567.2011.03514.x |
| [18] |
Zhang QC, Lu Y, Bian HM, et al. Activation of the α7 nicotinic receptor promotes lipopolysaccharide-induced conversion of M1 microglia to M2[J]. Am J Transl Res, 2017, 9(3): 971-985. |
| [19] |
Askari VR, Shafiee-Nick R. The protective effects of β-caryophyllene on LPS-induced primary microglia M1/M2 imbalance:A mechanistic evaluation[J]. Life Sci, 2019, 219: 40-73. DOI:10.1016/j.lfs.2018.12.059 |
| [20] |
Wang J, Li J, Wang Q, et al. dcf1 deficiency attenuates the role of activated microglia during neuroinflammation[J]. Front Mol Neurosci, 2018, 11: 256. DOI:10.3389/fnmol.2018.00256 |
| [21] |
Gerhard A, Pavese N, Hotton G, et al. In vivo imaging of microglial activation with[11C](R)-PK11195 PET in idiopathic Parkinson's disease[J]. Neurobiol Dis, 2006, 21(2): 404-412. DOI:10.1016/j.nbd.2005.08.002 |
| [22] |
Ferreira SA, Romero-Ramos M. Microglia response during parkinson's disease:alpha-synuclein intervention[J]. Front Cell Neurosci, 2018, 12: 247. DOI:10.3389/fncel.2018.00247 |
| [23] |
Lee E, Hwang I, Park S, et al. MPTP-driven NLRP3 inflammasome activation in microglia plays a central role in dopaminergic neurodegeneration[J]. Cell Death Differ, 2019, 26(2): 213-228. DOI:10.1038/s41418-018-0124-5 |
| [24] |
Yu ZY, Yang L, Yang Y, et al. Epothilone B benefits nigral dopaminergic neurons by attenuating microglia activation in the 6-hydroxydopamine lesion mouse model of parkinson's disease[J]. Front Cell Neurosci, 2018, 12: 324. DOI:10.3389/fncel.2018.00324 |
| [25] |
Saijo K, Winner B, Carson CT, et al. A Nurr1/CoREST pathway in microglia and astrocytes protects dopaminergic neurons from inflammation-induced death[J]. Cell, 2009, 137(1): 47-59. DOI:10.1016/j.cell.2009.01.038 |
| [26] |
Glass CK, Saijo K, Winner B, et al. Mechanisms underlying inflammation in neurodegeneration[J]. Cell, 2010, 140(6): 918-934. DOI:10.1016/j.cell.2010.02.016 |
| [27] |
Peng ZL, Luchtman DW, Wang XF, et al. Activation of microglia synergistically enhances neurodegeneration caused by MPP+ in human SH-SY5Y cells[J]. Eur J Pharmacol, 2019, 850: 64-74. DOI:10.1016/j.ejphar.2019.01.024 |
| [28] |
Kong H, Yang L, He C, et al. Chronic unpredictable mild stress accelerates lipopolysaccharide-induced microglia activation and damage of dopaminergic neurons in rats[J]. Pharmacol Biochem Behav, 2019, 179: 142-149. DOI:10.1016/j.pbb.2019.01.004 |
| [29] |
Tang Y, Le WD. Differential roles of M1 and M2 microglia in neurodegenerative diseases[J]. Mol Neurobiol, 2016, 53(2): 1181-1194. DOI:10.1007/s12035-014-9070-5 |
| [30] |
Pisanu A, Lecca D, Mulas G, et al. Dynamic changes in pro-and anti-inflammatory cytokines in microglia after PPAR-γ agonist neuroprotective treatment in the MPTPp mouse model of progressive Parkinson's disease[J]. Neurobiol Dis, 2014, 71: 280-291. DOI:10.1016/j.nbd.2014.08.011 |
| [31] |
Han XJ, Sun SF, Sun YM, et al. Small molecule-driven NLRP3 inflammation inhibition via interplay between ubiquitination and autophagy:implications for Parkinson disease[J]. Autophagy, 2019, 1-22. DOI:10.1080/15548627.2019.1596481 |



