海洋生物由于其特殊的生存环境,在长期进化过程中,产生了独特的次级代谢产物。这些代谢产物具有与陆地天然产物不同的结构和良好的生物活性,是开发新型药物或先导化合物的重要资源。海绵属于最原始的无脊椎动物门,在地球上已生存数百万年。由于海绵不能移动,缺乏物理防御,更容易受到海洋食肉动物如鱼,乌龟和脊椎动物的影响。为维护其自身不受威胁,海绵自身产生一系列具有防御性化学活性物质来抵御捕食者或对抗竞争者,而这些活性化合物正被用于研究抗病毒、抗炎以及抗肿瘤等重大疾病的新型药物。其中,一些具有抗炎、抗肿瘤的活性化合物正处于临床和临床前试验阶段[1]。研究发现,海绵的次级代谢产物具有显著的化学多样性,主要包括生物碱类、萜类、大环内酯类等[2]。本文主要从近几年海绵中抗肿瘤活性成分进行综述,为进一步新型天然药物的开发与利用提供理论基础。
1 生物碱类生物碱类化合物是海绵次级代谢产物中一类重要的化学成分,该类化合物数量众多、结构独特,其中多数化合物具有抗肿瘤、抗氧化、抗病毒、酶抑制、抗菌等生物活性[3]。见图 1。

|
图 1 吡咯烷类生物碱化合物 |
吡咯烷类生物碱是一类具有五元氮杂环结构的化合物。近年来,研究发现的吡咯烷类生物碱主要来自海绵,其在抗肿瘤药用价值方面拥有良好的生物活性,因此,吡咯烷类生物碱逐渐成为药物化学家的研究热点。见图 1、表 1。
| 表 1 海绵中生物碱类化合物对不同细胞系的毒活性 |
Hertiani等[4]从印度尼西亚海绵Agelas linnaei中分离得到16个溴吡咯生物碱,其中11个为新的天然产物且具有独特的生物活性,如化合物Agelanesins A-D(1-4)对小鼠L5178Y淋巴瘤细胞细胞毒活性的IC50值为9.25~16.76μmol·L-1。宋淑梅等[5]从澳大利亚厚皮海绵Craniella australiensis分离得到生物碱Aldisin(5)和2-Bromoaldisin(6)。抗肿瘤活性研究发现,化合物Aldisin和2-Bromoaldisin对U251胶质瘤细胞、Caco-2 HCT116结肠癌细胞、A498肾癌细胞、7721肝癌细胞抑制作用具有较好的剂量依赖性,均随着其浓度的升高而显著增强,且化合物Aldisin处理7721细胞的IC50为达到67.56μg·ml-1。此外,Plisson等[6]从海绵Callyspongia sp分离出4种新的溴吡咯烷类生物碱Callyspongisines A-D[7-10],体外生物活性研究表明,该类化合物能有效抑制细胞周期蛋白依赖性激酶5、糖原合成酶激酶3和酪蛋白激酶1(CK1)的活性。
Hamed等[7]从红海海域海绵Stylissa carteri中分离得到15种吡咯烷生物碱,其中,化合物(+) dibromophakelline (11)和Z-3-bromohymenialdisine (12)对小鼠L5178Y淋巴瘤细胞具有较强的细胞毒作用,其增殖抑制率分别为57%和60.5%(10μg·ml-1),化合物(-) clathramide C (13), Z-spongiacidin D (14), Z-hymenialdisine (15)和3, 4-dibromo-1H-pyrrole-2-carbamide (16)的细胞毒性相对较弱,而其他化合物对此肿瘤细胞没有抑制作用。
1.2 Aaptamine类生物碱Aaptamine类生物碱是一类以苯并二氮杂萘为母核结构的海洋来源特征生物碱,是海绵Aaptos属中最常见的次级代谢产物。Aaptamine类化合物多数具有清除自由基、抗肿瘤、抗菌、抗病毒、抗炎、酶抑制剂、抗寄生虫等生物活性,其中,抗肿瘤效果最为显著[8]。见图 2、表 1。

|
图 2 Aaptamine类生物碱化合物 |
Liu等[9]从采自中国南海西沙群岛的海绵Aaptos Suberites中分离得到4个以C-3-C-3’、C-3-C-6’键链接两个aaptamine单体结构单元的新颖骨架聚合型的aaptamine生物碱suberitineA-D (18-21),活性研究表明,C-9位带有羰基的化合物19、21对P388肿瘤细胞细胞毒活性较强,IC50分别为1.8μmol·L-1,3.5μmol·L-1。另外,Pham等[10]从采自印度尼西亚安汶海域的海绵Aaptos suberitoides中分离得到4个已知aaptamine类生物碱(aaptamine (17)、9-demethyl-aaptamine (22)、8, 9, 9-trimethoxy-9H-benzo[de][1,6]-naphthyridine (23)和8-methoxybenzimidazo[6, 7, 1-def][1,6]-naphthyridine (24))和4个新的aaptamine类生物碱(11-methoxy-3H-naphthyridino-[6, 5, 4-def]-quinoxalin-3-one (25), 2, 11-dimethoxy-3H-[1,6]-naphthyridino-[6, 5, 4-def]-quinoxalin-3-one (26)和5-benzoyldemethyl-aaptamine (27)、3-aminodemethyl(oxy)aaptamine (28)),抗肿瘤活性研究发现,化合物17、22和27对鼠淋巴瘤细胞增殖具有较强的抑制作用,IC50值分别为8.3μmol·L-1、0.9μmol·L-1和5.5μmol·L-1。Gan等[11]从中国南海西沙海绵Aaptos aaptos分离得到9个Aaptamine类化合物,其中3个为新化合物。体外活性研究表明,化合物29、30及31对宫颈癌细胞(HeLa)和人白血病细胞(K562)具有较强的细胞毒活性,IC50值为0.9~12.32μmol·L-1;而化合物31、32对MCF-7乳腺癌细胞和U937淋巴瘤细胞抑制活性较强,IC50值为1.62~4.62μmol·L-1。Aaptamine类生物碱因其优良的抗肿瘤活性,该类化合物被认为是最有前景的抗肿瘤活性先导分子之一。然而,Aaptamine及其衍生物产生抗肿瘤活性的分子机制尚不明确。近年来,研究显示Aaptamine可以通过相对较弱的亲和力插入到DNA中,从而发挥抗肿瘤活性作用。Jin等[12]研究发现aaptamine在GI50为10μmol·L-1的情况下通过诱导P21的表达,阻断G2/M期,从而对人慢性髓原白血病细胞K562产生抗肿瘤活性。此外,Dyshlovoy课题组研究了aaptamine及其衍生物对人生殖细胞癌细胞系NT2和NT2-R具有相同的抗癌作用,同时可引起这些细胞蛋白质组的变化。为了进一步探讨aaptamine及其衍生物的作用机制,Dyshlovoy等[13]研究了aaptamine(17),demethyl(oxy)aaptamine(30)和isoaaptamine(33)对人生殖癌细胞系中的抗癌活性。研究发现,三种化合物在较低浓度(IC50为50μmol·L-1)时能够阻滞细胞周期G2/M期,而在高浓度条件下,能诱导细胞凋亡。化合物30主要作用于TNF,而化合物33作用于myc、P53和TNF等,从而对NT2-R人胚胎癌细胞系表现出高效的诱导细胞凋亡能力。Wu等[14]研究发现化合物33能够通过p62依赖氧化应激,从而引起乳腺癌细胞T-47D细胞的凋亡和自噬。
1.3 二萜生物碱二萜生物碱是海绵次级代谢产物中主要的萜类生物碱,具有复杂的多环含氮结构,该类化合物在抗肿瘤以及抗炎抗菌等方面具有多种药理作用。
Hertiani等[4]从海绵Agelas nakamurai中分离得到新二萜生物碱(-)-agelasine D(34)和(-)-ageloxime D(35),其中化合物34对小鼠淋巴瘤细胞L5178Y表现一定的抑制作用,其IC50为4.03μmol·L-1,而化合物35对L5178Y的抑制作用则较弱,IC50为12.5μmol·L-1。通过对其构效关系进一步的研究发现,化合物35结构上的嘌呤碱基团-NH2被氧化成=N-OH,因而降低了对L5178Y的抑制作用。此外,Pettit等[15]从海绵Agelas中分离出3种新型二萜生物碱Axistatins(36-38),并对其进行体外抗肿瘤筛选,发现该3种生物碱对小鼠的乳腺癌、胰腺癌、结肠癌、淋巴白血病、神经癌等细胞的增殖等均呈现一定的抑制作用。见图 3、表 1。

|
图 3 二萜类生物碱化合物 |
海绵产生的次级代谢产物中,萜类化合物是迄今为止发现最多的化合物之一,萜类化合物的骨架结构为五碳异戊二烯,这些异戊二烯结构单元可衍生大量不同种类的衍生物,因而也具有了多样的化学结构和生物学活性(见图 4、表 2)。Diaz-Marrero等[16]首次从采自巴布亚新几内亚海绵属Dysidea sp.中分离得到萜类化合物3’-aminoavarone(39),且发现其对MDA-MB-231人乳腺癌细胞和人结肠癌细胞(LS174T)具有较强的抑制活性,其IC50值分别为2mg·L-1和20mg·L-1。Adriana A.等[17]从海绵Agelas clathrodes的次级代谢产物中分离出萜类化合物Agelasine B(40),研究发现,Agelasine B对2种MCF-3、SFBr3人乳腺癌细胞和PC-3前列腺细胞表现出较强的细胞毒活性,其IC50值分别2.99μmol·L-1、3.22μmol·L-1、6.86μmol·L-1。进一步通过共聚焦显微镜研究表明,Agelasine B诱导了MCF-3,SKBr3和PC-3细胞内Ca2+浓度的大幅增加,且对内质网Ca2+ATPase(SERCA)能够产生有效的抑制作用,从而减少抗凋亡蛋白Bcl-2的表达,并且在能够激活caspase-8的同时而不影响caspase-7的活性。该研究表明该化合物可诱导MCF-3、SFBr3和PC-3的凋亡,并在阻断SERCA活性后促使细胞内Ca2+的释放增加。

|
图 4 萜类化合物 |
| 表 2 海绵中萜类化合物对不同细胞系的毒活性 |
李媛等[18]在细薄星芒海绵中分离到5个萜类化合物,其中22, 23-dihydrostelletin D(41),jaspolide B(42)和jaspolide A(43)为新型的天然化合物。体外活性研究发现,3种化合物对U937细胞增殖具有明显的抑制作用,浓度为0.01μg·mL-1时,抑制率可达39%~75%;而在相同浓度下,对恶性胶质瘤(U87MG)的抑制率仅在15%~28%。此外,Jiao等[19]从海绵D.avara的次级代谢产物中分离得到4种新型萜类化合物dysidav-arones A-D,研究了该系列化合物对MDA-MB-231、A549、QGY7703人肝癌细胞以及HeLa等细胞系的抑制作用,结果表明,dysidav-arones A(44)仅对HeLa细胞具有一定的抑制作用,其IC50值为39.9μmol·L-1;而dysidav-arones D(45)对4种癌细胞株均具有一定强度的抑制作用,其IC50值分别为28.8μmol·L-1、21.4μmol·L-1、11.6μmol·L-1和28.1 μmol·L-1。2014年,Tang等[20]从海绵Jaspis stellifera中分离出萜类化合物Stellettin B(46),研究了其对39种人癌细胞系的体外抗肿瘤活性,结果发现Stellettin B对SF295人胶质母细胞瘤细胞系的生长具有高效的抑制作用,GI50为0.01μmol·L-1。而对人HMEC微血管内皮细胞,人RPTEC肾近端小管上皮细胞,人NHBE肺细胞和人PrEC前列腺上皮细胞等正常细胞系表现出较弱的抑制活性。因此,与人正常细胞系相比,化合物46对癌细胞的细胞毒性具有相对选择性。Tang等进一步研究了Stellettin B对SF295细胞的体外抗肿瘤作用的分子机制。结果表明,Stellettin B以浓度依赖性方式诱导SF295细胞凋亡,同时,Stellettin B可增加ROS的产生以及PARP的裂解。对抑制细胞增殖和诱导细胞凋亡的机制的研究表明,Stellettin B有效地抑制Akt的磷酸化,对p-ERK和p-p38没有活性,通过抑制PI3K / Akt途径,从而抑制肿瘤细胞增殖和诱导肿瘤细胞凋亡。然而,Stellettin B并不抑制PI3K活性,这表明化合物Stellettin B的直接靶标可能是PI3K以外的Akt途径上游的信号蛋白。
3 大环内酯类早期从海绵次级代谢产物分离出的大环内酯类化合物主要用来研究其抗菌、抗炎等生物活性。近年来,研究者发现大环内酯类化合物对多种肿瘤细胞也具有一定的抑制作用[21]。见图 5、表 3。
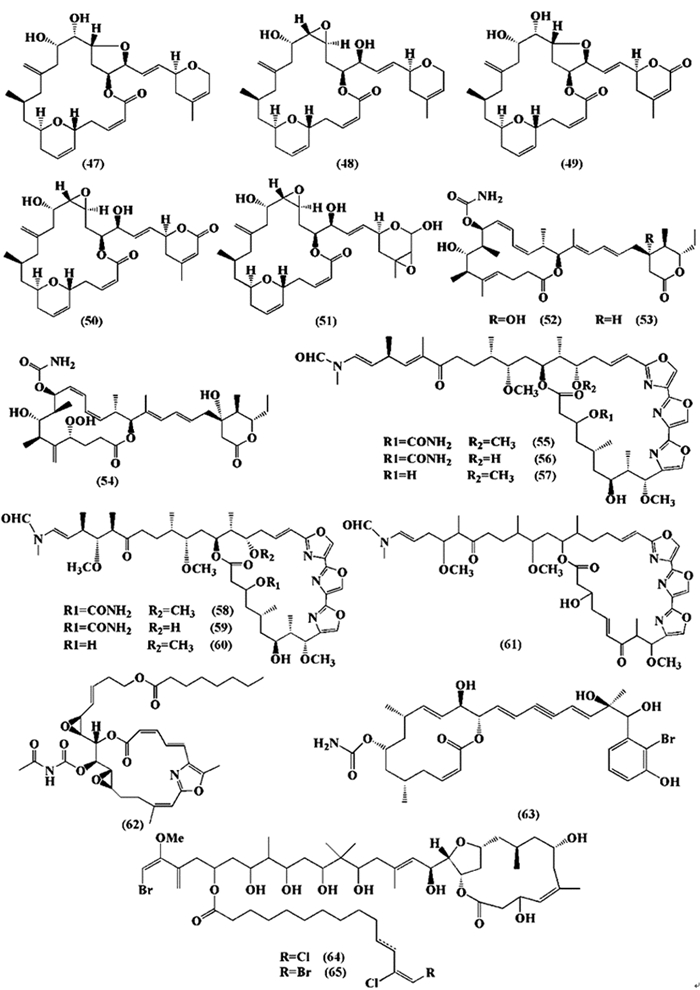
|
图 5 大环内酯类化合物 |
| 表 3 海绵中大环内酯类化合物对不同细胞系的毒活性 |
Johnson等[22]从海绵Cacospongia属中分离得到8种大环内酯类化合物,包括fijianolides A(47)、fijianolides B(48)及6种新型的化合物fijianolides D-I,其中,化合物47和48与紫杉醇的作用机制类似,且化合物47表现出对HCT-116和人乳腺癌细胞系(MDA-MB-435)非常强的细胞增殖抑制活性,IC50分别为3 nmol·L-1和7 nmol·L-1;其它6种化合物fijianolides D-I在结构上与fijianolides A或fijianolides B区别在于其大环内酯的C-20侧链取代基不同,但仅有化合物fijianolides D(49)、fijianolides E(50)和fijianolides G(51)对两种细胞系的抑制活性相对较强。化合物fijianolides E和fijianolides G作用方式与fijianolides B相似,通过干扰肿瘤细胞的有丝分裂,从而抑制肿瘤细胞增殖,但作用效果弱于fijianolides B;荷瘤SCID小鼠体内研究发现,fijianolides B对HCT-116人结肠癌的抑制作用长达28d。Paterson等[23]从海绵属Leiodermatium sp.中分离出大环内酯类天然产物Leiodermatolide (52),研究发现其能够较强的抗有丝分裂作用并且对A459、PANC-1、DLD-1和P388等肿瘤细胞具有强的细胞增殖抑制作用,IC50值为3.3~8.3 nmol·L-1,对NCI/ADR-Res细胞抑制作用相对较弱,IC50为233 nmol·L-1。2017年,Wright等[21]从采自佛罗里达州的海绵Genus leiodermatolide中分离出2种化合物52的同系物Leiodermatolides B(53)和C(54),体外活性测试发现Leiodermatolides B可抑制人胰腺癌细胞系AsPC-1的增殖,其IC50值为43 nmol·L-1,而Leiodermatolide C对AsPC-1的抑制作用比Leiodermatolide B低85倍以上,其IC50值仅为3.7μmol·L-1。
Thanchanok等[24]从海绵Pachastrissa nux中分离得到6个Kabiramides类化合物(55-60),发现此类化合物均对MCF-7人乳腺癌细胞具有较强的细胞毒活性,IC50值分别为0.02~0.47μmol·L-1。Shin等[25]研究了从海绵Chondrosia corticata中分离得到大环内酯类化合物Halichondramide (HCA, 61)的抗肿瘤活性,结果表明,HCA对人前列腺癌PC3细胞系具有较强的细胞增殖抑制作用(IC50为0.81μmol·L-1)。进一步研究发现HCA能够抑制PC3细胞潜在的转移性分子标记的表达和肝再生磷酸酶-3(PR L-1),除此之外,HCA也能够有效的抑制PC3细胞的迁移和侵染。Nathalie等[26]从马达加斯加岛附近海绵Fascaplysinopsis sp.中分离得到一系列Salarin化合物,其中,Salarin C(62)对K562白血病细胞具有良好的细胞增殖抑制作用和肿瘤细胞凋亡的诱导作用。在慢性粒细胞白血病(CML)模型中研究发现salarin C能够诱导细胞周期阻滞,细胞凋亡和DNA损伤,在低氧条件下,Salarin C浓度依赖性地抑制干细胞的潜在功能。
Callyspongiolide (63)是一种从海绵Callyspongia sp.分离到的大环内酯类化合物,对小鼠L5178Y淋巴瘤细胞和人J16 T白血病细胞和B淋巴细胞Ramos均有较强的抑制作用,IC50值分别为320 nmol·L-1、70nmol·L-1和60nmol·L-1[27]。Adriana等[28]从海绵Petrosiidae分离得到3种聚酮大环内酯类化合物Phormidolides A-C,细胞毒活性研究发现,Phormidolides B(64)和C(65)对A549、HT-29和MDA-MB-231 3种癌细胞具有良好的细胞增殖抑制作用。
4 其他类海绵的次级代谢产物的结构新颖多样,还包括甾类、聚酮类、核苷类、多肽类以及酰胺类等。见图 6。

|
图 6 其他类化合物 |
Roberta等[29]深入研究加勒比海海绵属Smenospongia的次生代谢产物,分离出含有杂化肽/聚酮类化合物smenamide A(66)和B(67),体外活性研究结果表明,化合物66和67可诱导肺癌细胞系(Calu-1)凋亡,表现出较强的细胞毒性,其IC50值分别为48 nmol·L-1和49 nmol·L-1。2017年,An等[30]对黄色海绵属Leucetta chagosensis产生的次级代谢产物进行化学成分分析,分离出3种新的咪唑类生物碱铜配合物chagosendine A-C。研究发现配合物chagosendine A(68)和chagosendine B(69)对K562,人肝癌细胞(HepG2)和Hela具有显著的生物活性。同年,Liu等[31]从海绵Niphates recondite中分离得到3种新型的类胡萝卜素类似物Chartarolides A-C(70-72)。体外活性研究发现,该类化合物可抑制小鼠杂交瘤细胞、肝癌细胞、髓系肿瘤细胞和酪氨酸激酶受体B细胞(TrKB)等相关蛋白激酶的活性,从而表现出显著的细胞毒活性。另外,2018年,Takuya等[32]从采集越南海绵属Spongia sp.中提取出3种新型的倍半萜醌类化合物langcoquinonesD-F (73-75),并对其体外活性研究测试,结果表明化合物73对3种人癌细胞系A549,MCF7,HeLa和正常细胞系(WI-38成纤维细胞)均具有显著的细胞毒活性,其IC50值与阳性对照5-氟尿嘧啶的水平相当(IC50值为5.6~8.9μmol·L-1),而化合物74和75对上述细胞均无细胞毒活性。
5 结语海绵次级代谢产物具有化学结构和生物活性多样性,日益成为科研工作者研究热点。同属海绵因其生长地域的不同,产生的次生代谢产物也具有较大差异,这些次生代谢产物多数具有良好的生物活性,特别是抗肿瘤活性,因此,从海绵次生代谢产物分离的天然产物是寻找高效低毒药物或先导化合物的重要来源。虽然海绵的次生代谢产物含量丰富,但是野外采集海绵属的技术问题以及海绵次级代谢产物含量低、不稳定等因素,成为目前研究的难点之一。对海绵天然产物进行化学合成、生物合成及靶向分子化学修饰[33],寻找更好生物活性的先导化合物,从而对临床患者实施个性化治疗,将是未来对海绵次生代谢产物研究的重点之一。
| [1] |
Martins A, Vieira H, Gaspar H, et al. Marketed marine natural products in the pharmaceutical and cosmeceutical industries:tips for success[J]. Mar Drugs, 2014, 12(2): 1066-1101. DOI:10.3390/md12021066 |
| [2] |
李聪, 许焕丽, 刘明, 等. 诱导细胞凋亡的海洋抗肿瘤药物研究进展[J]. 药学学报, 2016, 51(9): 1394-1400. DOI:10.16438/j.0513-4870.2016-0035 |
| [3] |
Anjum K, Abbas SQ, Shah SA, et al. Marine sponges as a drug treasure[J]. Biomol Ther (Seoul), 2016, 24(4): 347-362. DOI:10.4062/biomolther.2016.067 |
| [4] |
Hertiani T, Edrada-Ebel R, Ortlepp S, et al. From anti-fouling to biofilm inhibition:new cytotoxic secondary metabolites from two Indonesian Agelas sponges[J]. Bioorg Med Chem, 2010, 18(3): 1297-1311. DOI:10.1016/j.bmc.2009.12.028 |
| [5] |
宋淑梅, 郑亚旭, 佟长青, 等. 澳大利亚厚皮海绵化学成分分离鉴定及其抗肿瘤活性研究[J]. 大连海洋大学学报, 2016, 31(4): 426-430. DOI:10.16535/j.cnki.dlhyxb.2016.04.013 |
| [6] |
Plisson F, Prasad P, Xiao X, et al. Callyspongisines A-D:bromopyrrole alkaloids from an Australian marine sponge, Callyspongia sp[J]. Org Biomol Chem, 2014, 12(10): 1579-1584. DOI:10.1039/c4ob00091a |
| [7] |
Hamed ANE, Schmitz R, Bergermann A, et al. Bioactive pyrrole alkaloids isolated from the Red Sea:marine sponge Stylissa carteri[J]. Z Naturforsch C, 2018, 73(5/6): 199-210. DOI:10.1515/znc-2017-0161 |
| [8] |
Calcabrini C, Catanzaro E, Bishayee A, et al. Marine sponge natural products with anticancer potential:an updated review[J]. Mar Drugs, 2017, 15(10): E310. DOI:10.3390/md15100310 |
| [9] |
Liu CX, Tang XL, Li PL, et al. Suberitine A-D, four new cytotoxic dimeric aaptamine alkaloids from the marine sponge Aaptos suberitoides[J]. Org Lett, 2012, 14(8): 1994-1997. DOI:10.1021/ol3004589 |
| [10] |
Pham CD, Hartmann R, Müller WE, et al. Aaptamine derivatives from the Indonesian sponge Aaptos suberitoides[J]. J Nat Prod, 2013, 76(1): 103-106. DOI:10.1021/np300794b |
| [11] |
Gan JH, Hu WZ, Yu HB, et al. Three new aaptamine derivatives from the South China Sea sponge Aaptos aaptos[J]. J Asian Nat Prod Res, 2015, 17(12): 1231-1238. DOI:10.1080/10286020.2015.1118465 |
| [12] |
Jin MH, Zhao WN, Zhang YW, et al. Antiproliferative effect of aaptamine on human chronic myeloid leukemia K562 cells[J]. Int J Mol Sci, 2011, 12(11): 7352-7359. DOI:10.3390/ijms12117352 |
| [13] |
Dyshlovoy SA, Venz S, Shubina LK, et al. Activity of aaptamine and two derivatives, demethyloxyaaptamine and isoaaptamine, in cisplatin-resistant germ cell cancer[J]. J Proteomics, 2014, 96: 223-239. DOI:10.1016/j.jprot.2013.11.009 |
| [14] |
Wu CF, Lee MG, El-Shazly M, et al. Isoaaptamine induces T-47D cells apoptosis and autophagy via oxidative stress[J]. Mar Drugs, 2018, 16(1): E18. DOI:10.3390/md16010018 |
| [15] |
Pettit GR, Tang YP, Zhang QW, et al. Isolation and structures of axistatins 1-3 from the Republic of Palau marine sponge Agelas axifera Hentschel[J]. J Nat Prod, 2013, 76(3): 420-424. DOI:10.1021/np300828y |
| [16] |
Diaz-Marrero AR, Austin P, Van Soest R, et al. Avinosol, a meroterpenoid-nucleoside conjugate with antiinvasion activity isolated from the marine sponge Dysidea sp[J]. Org Lett, 2006, 8(17): 3749-3752. DOI:10.1021/ol061333p |
| [17] |
Pimentel AA, Felibertt P, Sojo F, et al. The marine sponge toxin agelasine B increases the intracellular Ca(2+) concentration and induces apoptosis in human breast cancer cells (MCF-7)[J]. Cancer Chemother Pharmacol, 2012, 69(1): 71-83. DOI:10.1007/s00280-011-1677-x |
| [18] |
李媛, 林厚文, 田向荣, 等. 细薄星芒海绵的三萜成分研究[J]. 中南药学, 2013, 11(4): 261-264. DOI:10.3969/j.issn.1672.2981.2013.04.007 |
| [19] |
Jiao WH, Huang XJ, Yang JS, et al. Dysidavarones A-D, new sesquiterpene quinones from the marine sponge Dysidea avara[J]. Org Lett, 2012, 14(1): 202-205. DOI:10.1021/ol202994c |
| [20] |
Tang SG, Zhou QX, Guo WZ, et al. In vitro antitumor activity of stellettin B, a triterpene from marine sponge Jaspis stellifera, on human glioblastoma cancer SF295 cells[J]. Mar Drugs, 2014, 12(7): 4200-4213. DOI:10.3390/md12074200 |
| [21] |
Wright AE, Roberts JC, Guzmán EA, et al. Analogues of the potent antitumor compound leiodermatolide from a deep-water sponge of the genus leiodermatium[J]. J Nat Prod, 2017, 80(3): 735-739. DOI:10.1021/acs.jnatprod.6b01140 |
| [22] |
Johnson TA, Tenney K, Cichewicz RH, et al. Sponge-derived fijianolide polyketide class:further evaluation of their structural and cytotoxicity properties[J]. J Med Chem, 2007, 50(16): 3795-3803. DOI:10.1021/jm070410z |
| [23] |
Paterson I, Dalby SM, Roberts JC, et al. Leiodermatolide, a potent antimitotic macrolide from the marine sponge Leiodermatium sp[J]. Angew Chem Int Ed Engl, 2011, 50(14): 3219-3223. DOI:10.1002/anie.201007719 |
| [24] |
Sirirak T, Kittiwisut S, Janma C, et al. Kabiramides J and K, trisoxazole macrolides from the sponge Pachastrissa nux[J]. J Nat Prod, 2011, 74(5): 1288-1292. DOI:10.1021/np100886y |
| [25] |
Shin Y, Kim GD, Jeon JE, et al. Antimetastatic effect of halichondramide, a trisoxazole macrolide from the marine sponge Chondrosia corticata, on human prostate cancer cells via modulation of epithelial-to-mesenchymal transition[J]. Mar Drugs, 2013, 11(7): 2472-2485. DOI:10.3390/md11072472 |
| [26] |
Ben-Califa N, Bishara A, Kashman Y, et al. Salarin C, a member of the salarin superfamily of marine compounds, is a potent inducer of apoptosis[J]. Invest New Drugs, 2012, 30(1): 98-104. DOI:10.1007/s10637-010-9521-4 |
| [27] |
Pham CD, Hartmann R, Böhler P, et al. Callyspongiolide, a cytotoxic macrolide from the marine sponge Callyspongia sp[J]. Org Lett, 2014, 16(1): 266-269. DOI:10.1021/ol403241v |
| [28] |
Lorente A, Gil A, Fernández R, et al. Phormidolides B and C, cytotoxic agents from the sea:enantioselective synthesis of the macrocyclic core[J]. Chemistry, 2015, 21(1): 150-156. DOI:10.1002/chem.201404341 |
| [29] |
Teta R, Irollo E, Della Sala G, et al. Smenamides A and B, chlorinated peptide/polyketide hybrids containing a dolapyrrolidinone unit from the Caribbean sponge Smenospongia aurea.Evaluation of their role as leads in antitumor drug research[J]. Mar Drugs, 2013, 11(11): 4451-4463. DOI:10.3390/md11114451 |
| [30] |
An B, Yin FL, de Voogd NJ, et al. Chagosendines A-C, new metal complexes of imidazole alkaloids from the calcareous sponge leucetta chagosensis[J]. Chem Biodivers, 2018, 15(2). DOI:10.1002/cbdv.201700481 |
| [31] |
Liu D, Li Y, Li XD, et al. Chartarolides A-C, novel meroterpenoids with antitumor activities[J]. Tetrahedron Letters, 2017, 58(19): 1826-1829. DOI:10.1016/j.tetlet.2017.03.079 |
| [32] |
to T, Nguyen HM, Win NN, et al. Three new sesquiterpene aminoquinones from a Vietnamese Spongia sp.and their biological activities[J]. J Nat Med, 20218, 72(1): 298-303. DOI:10.1007/s11418-017-1130-5 |
| [33] |
刘娟娟, 李丹阳, 孙正阳, 等. 抗肿瘤多肽研究进展[J]. 济宁医学院学报, 2017, 40(4): 240-244. DOI:10.3969/j.issn.1000-9760.2017.04.003 |



