2. 济宁医学院附属医院, 济宁 272029;
3. 济宁医学院基础医学院, 济宁 272067;
4. 济宁医学院生物纳米技术与医学工程研究所, 济宁 272067
2. Affiliated Hospital of Jining Medical University, Jining 272067, China;
3. College of Basic Medicine, Jining Medical University, Jining 272067, China;
4. Bio-Nano & Medical Engineering Institute, Jining Medical University, Jining 272067, China
纳米银因具有特殊的物理化学性质,在微电子、光电子、超导材料、生物医药、催化、防电磁辐射及柔性显示屏等领域得到了广泛应用[1-2],特别在医药领域具有重要的地位[3-9]。牛血清白蛋白(bovine serum albumin, BSA)是在牛肝细胞中合成的蛋白,具有很好的生物相容性。它是生物大分子研究中应用最广泛的蛋白质之一,常用作研究蛋白质与药物、配体、金属离子等物质相互作用的最理想模型[10-11]。
纳米银与生物大分子相互作用的深入研究将对纳米材料在医学领域的应用产生重大影响。本文利用光谱分析法研究了银纳米线与牛血清白蛋白的结合,为纳米银在医学领域中广泛应用提供了理论性参考依据。
1 材料与方法 1.1 材料银纳米线(济宁利特纳米技术有限责任公司);三羟甲基氨基甲烷(纯度为99%,阿法埃莎化工有限公司);NaCl(国药集团化学试剂有限公司);EDTA(北京拜尔迪生物技术有限公司);HCl(莱阳经济技术开发区精细化工厂);牛血清白蛋白(纯度98%, Mw=66.4kg·mol-1,百灵威);Tris-HCl缓冲溶液(pH=7.40,由三羟甲基氨基甲烷、NaCl、EDTA、HCl配制而成),BSA溶液于4℃冰箱保存;试验中所用水均为三次去离子水。
1.2 方法 1.2.1 紫外光谱测定利用紫外-可见分光光度计对不同浓度的银纳米线与BSA相互作用的结果进行光谱测量,200 ~900nm以1200nm/min的速度测定溶液的吸光度。固定比色皿中牛血清白蛋白的浓度为0.8μM,银纳米线的浓度依次为:0、0.15、0.46、0.77、1.1、1.4、1.7和2.0mM。
1.2.2 荧光光谱测定用荧光分光光度计测定银纳米线与BSA相互作用的荧光强度。激发波长设定在285nm,扫描频段300~520nm,发射和激发狭缝均为5nm。比色皿中BSA的浓度固定为0.8μM,银纳米线的浓度同1.2.1。
1.2.3 同步荧光光谱测定利用荧光分光光度计测量银纳米线与BSA相互作用的同步荧光强度,首先测量Δλ=60nm(Δλ=λem-λex)时的荧光强度,此时,激发波长设定为240nm,发射波长的范围是300~400nm。改变Δλ=15nm,激发波长为265nm,发射波长的范围为280~340nm,激发和发射狭缝宽度均设置为5nm。比色皿中固定BSA的浓度为0.8μM,银纳米线的浓度同1.2.1。
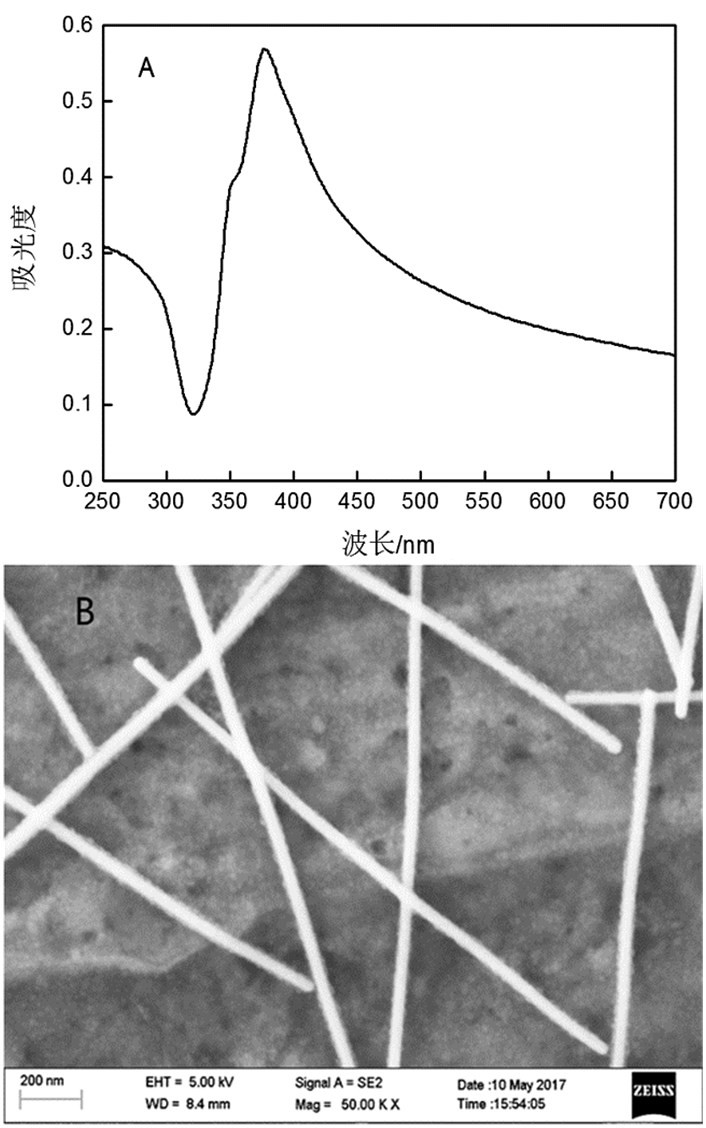
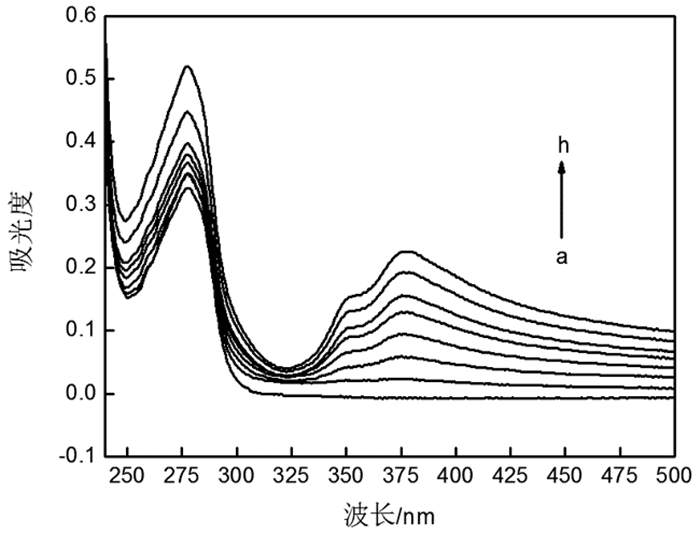
2 结果 2.1 银纳米线与BSA相互作用的紫外分析紫外光谱法是研究结构与物质相互作用的最有效的方法,主要依据是被测材料的吸收光谱。其中,银纳米线在370nm处有最大吸收峰(图 1A),由图 1B中可以看出,银纳米线具有均匀地线状结构。图 2为一系列浓度的30 nm粒径的纳米银与BSA在缓冲溶液中的紫外吸收光谱图。由图 2可以看出,在276nm处,未加入银纳米线时的最大吸收强度为0.327,而随着银纳米线加入量的增大,最大吸收强度也逐渐增大。当银纳米线的浓度增加到2.0mmol/L,最大吸收强度增加0.515。比较未加入银纳米线的BSA溶液和加入不同量的银纳米线的BSA溶液的最大吸光度可知,随着银纳米线浓度的增加,溶液中的BSA发生了增色效应。因此,可以确定银纳米线与溶液中的BSA发生了相互作用,生成了缔合物。
|
图 1 对银纳米线的表征 注:A.银纳米线紫外吸收光谱图;B.银纳米线SEM图 |
|
图 2 不同浓度银纳米线与BSA相互作用的紫外吸收光谱图 注:从(a)到(h)银纳米线的浓度依次为0mM, 0.15mM, 0.46mM, 0.77mM, 1.1mM, 1.4mM, 1.7mM, 2.0mM |
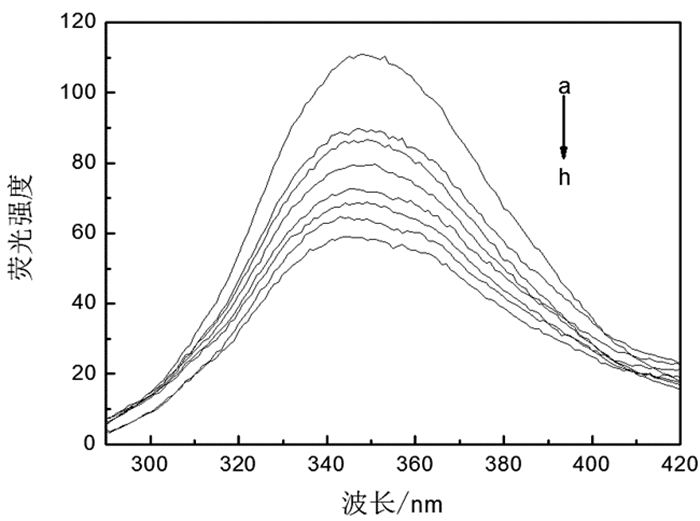
在BSA分子中,存在有3个固有的荧光残基:色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)。与其他氨基酸和酪氨酸相比,苯丙氨酸的量子产率相对较低,这是因为荧光内滤效应和酪氨酸残基对色氨酸残基的有效能量转移效应,所以酪氨酸残基在试验中观察到的荧光强度变化不明显,BSA荧光发射贡献最大的是色氨酸残基。在温度298K,pH7.31的Tris-HCl缓冲溶剂的条件下,随着溶液中银纳米线浓度的增大,BSA的荧光强度明显降低,表明银纳米线可以改变BSA的结构。这种现象可能是由于它们之间的相互作用引起的。见图 3。
|
图 3 不同浓度银纳米线与BSA相互作用荧光光谱图 注:从(a)到(h)银纳米线的浓度依次为0mM, 0.15mM, 0.46mM, 0.77mM, 1.1mM, 1.4mM, 1.7mM, 2.0mM |
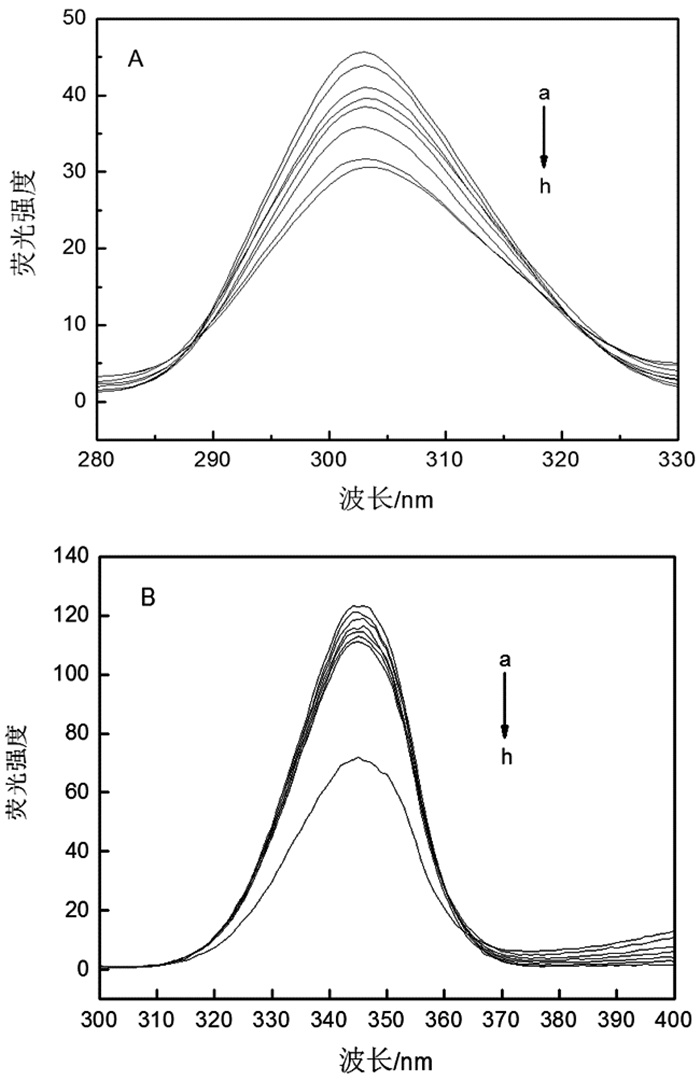
同步荧光法是研究BSA最常用的方法,可以研究BSA在环境变化时构象的变化。当Δλ为60nm时,观察到的是色氨酸的特征荧光,而当Δλ为15nm时,显示的是酪氨酸残基的特征荧光。图 4是在温度298K,pH7.31的Tris-HCl缓冲溶液中测得的酪氨酸和色氨酸的同步荧光光谱图。图 4示酪氨酸残基和色氨酸残基均随银纳米线浓度的增加,荧光强度下降,所以可以得出结论:BSA与银纳米线发生相互作用,导致荧光强度变化。
|
图 4 不同Ag浓度下BSA同步荧光光谱图 注:从(a)到(h)银纳米线的浓度依次为0mM, 0.15mM, 0.46mM, 0.77mM, 1.1mM, 1.4mM, 1.7mM, 2.0mM;A. Δλ=15nm,B. Δλ=60nm |
图 3示银纳米线的加入使得BSA发生了荧光猝灭效应,为了进一步探讨BSA发生的是何种荧光猝灭过程,接下来对两种粒径的银纳米线与BSA的混合溶液做了变温荧光。实验中为了消除杂质的影响,对荧光强度进行了校正,校正公式如下:
| $ {F_{{\rm{cor}}}} = {F_{{\rm{obs}}}} \times {{\rm{e}}^{({A_{{\rm{ex}}}} + {A_{{\rm{em}}}})/2}} $ |
Fcor和Fobs分别是校正后的和观察到的荧光强度。Aex和Aem分别是银纳米线和BSA在激发波长和发射波长下的吸收强度。
一般将荧光猝灭过程分为静态猝灭和动态猝灭,通常用Stern-Volmer方程[12]来判断是何种猝灭方式:
| $ \frac{{{F_0}}}{F} = 1 + {K_{{\rm{SV}}}}\left[ {\rm{Q}} \right] = 1 + {K_{\rm{q}}}{\tau _0}\left[ {\rm{Q}} \right] $ |
其中, F0是未加入银纳米线时的BSA荧光强度, F是加入银纳米线且校正后的BSA荧光强度,KSV是Stern-Volmer猝灭常数,Kq为猝灭速率常数,τ0是BSA的平均寿命,其数值通常为10-9s。利用Stern-Volmer方程,通过F0/F对[Q]作图,可以确定KSV的数值,由表 1中计算出的Kq与BSA的最大扩散碰撞的动态猝灭常数2.0×1010(L·mol-1·s-1)的比较可以断定,银纳米线对BSA的猝灭过程为静态猝灭过程。
| 表 1 银纳米线与BSA混合溶液在的Stern-Volmer猝灭常数 |
对于静态猝灭来说,可以用方程Double-logarithm来描述。而静态猝灭过程中的结合常数Ka和结合位点n都可以用此方程中的log[F0-F/F]和log[Q]的斜率及截距求出,Double-logarithm方程如下所示:
| $ \log\frac{{{F_0} - F}}{F} = \log {K_{\rm{a}}} + n\log \left[ {\rm{Q}} \right] $ |
图 5所列出的是不同温度下在银纳米线对BSA的猝灭系统中,由Double-logarithm方程得出的log[F0-F/F]和log[Q]的关系图,该猝灭系统的结合常数和结合位点的数目同时也可以得到(表 2)。通过比较表中相同粒径的银纳米线在不同温度时的数据可知,随着温度的升高,结合常数和结合位点数均减小,也就是说随着温度的升高,BSA与银纳米线的结合能力降低。
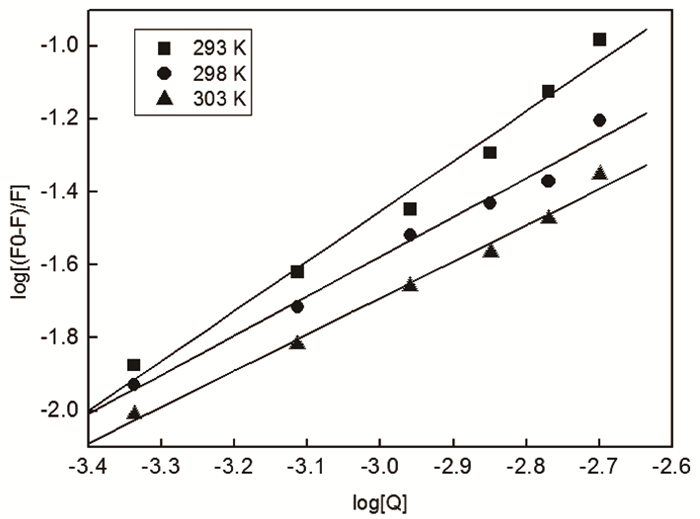
|
图 5 不同温度下银纳米线对BSA猝灭的Double-logarithm图 |
| 表 2 在不同温度下银纳米线与BSA的结合常数和结合位点 |
在配合物形成的过程中,存在以下公式:
| $ \Delta G = \Delta H - T\Delta S = - R{\rm{Tln}}K $ |
| $ \ln \frac{{{K_2}}}{{{K_1}}} = \frac{{\Delta H}}{R}\left( {\frac{1}{{{T_1}}} - \frac{1}{{{T_2}}}} \right) $ |
ΔG为吉布斯自由能变,ΔH为焓变,ΔS为熵变,K为平衡常数。根据反应前后热力学焓变和熵变的相对大小,可以确定银纳米线与BSA之间的相互作用类型。Ross等[13]总结了小分子与生物大分子反应的热力学数据与作用力类型的关系,即当ΔH>0,ΔS>0时为疏水作用;ΔH<0,ΔS<0时为范德华力和氢键。ΔH<0,ΔS>0时为静电作用力。由银纳米线与BSA相互作用的热力学数据,如表 3所示,ΔG<0,所以两者之间的相互作用是自发进行的,且ΔH<0,ΔS<0,则银纳米线与BSA之间作用力的类型主要范德华力和氢键。
| 表 3 银纳米线与BSA相互作用的热力学数据 |
银纳米线可以使BSA的空间结构发生改变。通过对紫外-可见吸收光谱的分析表明,随着溶液中银纳米线浓度的增加,在285nm处BSA的最大紫外吸收强度也随之增加,说明银纳米线可以同BSA发生了相互作用,使得BSA的空间结构发生了相应变化。
银纳米线可以使BSA的荧光强度发生猝灭。通过对30nm粒径的银纳米线与BSA相互作用的荧光光谱的分析可知,银纳米线作为猝灭剂,可以使BSA的荧光强度发生猝灭,且由猝灭常数可知,猝灭机制为静态猝灭。
银纳米线可以改变BSA中色氨酸残基周围亲水环境的极性。随着银纳米线浓度的增加,色氨酸残基的位置发生了红移,说明色氨酸残基周围的亲水性环境的极性增加,而酪氨酸残基的位置没有改变,表明酪氨酸残基周围的亲水性环境的极性没有改变。通过对30nm粒径的银纳米线与BSA相互作用的变温荧光光谱的分析可知,结合常数Ka和结合位点数n均随着温度的升高而降低。
综上所述,本研究获得了纳米银与BSA相互作用的结合常数、结合位点以及吉布斯自由能等热力学常数,为纳米银在医学领域中广泛应用提供了理论性依据。
| [1] |
徐香玉, 武卫华, 杜中玉, 等. 球形纳米银的合成及其与牛血清白蛋白的相互作用[J]. 济宁医学院学报, 2017, 40(1): 5-15. DOI:10.3969/j.issn.1000-9760.2017.01.002 |
| [2] |
Park SJ, Taton TA, Mirkin CA. Array-based electrical detection of DNA with nanoparticle probes[J]. Science, 2002, 295(5559): 1503-1506. DOI:10.1126/science.1067003 |
| [3] |
Cui Y, Wei Q, Park H, et al. Nanowire nanosensors for highly sensitive and selective detection of biological and chemical species[J]. Science, 2001, 293(5533): 1289-1292. DOI:10.1126/science.1062711 |
| [4] |
Zhu CQ, Li DH, Zhu QZ, et al. Determination of proteins at nanogram levels by their quenching effect on large particle scattering of colloidal silver chloride[J]. Fresenius J Anal Chem, 2000, 366(8): 863-868. DOI:10.1007/s002160051586 |
| [5] |
于朝清, 尹霜, 龚文明, 等. 银纳米线制备工艺的研究现状[J]. 贵金属, 2016, 37(1): 50-53. |
| [6] |
施雨露, 张小楠, 刘照轩, 等. 纳米银/PLGA共聚物复合纤维对大肠埃希菌抑菌作用研究[J]. 中国实验诊断学, 2013, 17(7): 1188-1190. DOI:10.3969/j.issn.1007-4287.2013.07.005 |
| [7] |
钟震, 路航, 任天斌, 等. 纳米银形状控制合成与聚合物纳米银复合材料[J]. 化学进展, 2014, 26(12): 1930-1941. DOI:10.7536/PC140646 |
| [8] |
莫博, 阚彩侠, 柯善林, 等. 银纳米片的研究进展[J]. 物理化学学报, 2012, 28(11): 2511-2524. DOI:10.3866/PKU.WHXB201208132 |
| [9] |
刘雨双, 钟睿博, 张萍, 等. 牛血清蛋白与纳米金颗粒相互作用的研究[J]. 基因组学与应用生物学, 2015, 34(4): 741-744. |
| [10] |
黄芸, 崔力剑, 陈晨, 等. 黄芩素及黄芩苷与牛血清白蛋白结合作用比较研究及葡萄糖的影响[J]. 中国药理学通报, 2010, 26(6): 754-758. |
| [11] |
Yang J, Jing ZH, Jie JJ, et al. Fluorescence spectroscopy study on the interaction between Gossypol and bovine serum albumin[J]. Journal of Molecular Structure, 2009, 920(1/2/3): 227-230. DOI:10.1016/j.molstruc.2008.10.053 |
| [12] |
Bhuvaneswari J, Fathima AK, Rajagopal S. Rhenium(Ⅰ)-based fluorescence resonance energy transfer probe for conformational changes of bovine serum albumin[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2012, 227(1): 38-44. DOI:10.1016/j.jphotochem.2011.10.022 |
| [13] |
Ross PD, Subramanian S. Thermodynamics of protein association reactions:forces contributing to stability[J]. Biochemistry, 1981, 20(11): 3096-3102. DOI:10.1021/bi00514a017 |



