2. 济宁医学院附属济宁市第一人民医院, 济宁 272011;
3. 济宁医学院临床医学院, 济宁 272013
2. Jining No.1 People's Hospital & the Affiliated Hospital of Jining Medical University, Jining 272011, China;
3. College of Clinical Medicine, Jining Medical University, Jining 272013, China
糖尿病周围神经病变(diabetic peripheral neuropath,DPN)是糖尿病的常见并发症,严重降低糖尿病患者的生活质量。DPN主要累及双下肢的进展性痛觉过敏[1]。背根神经节(dorsal root ganglion,DRG)作为初级感觉传入神经元聚集的部位,是疼痛信号传递的关键途径[2]。越来越多的证据表明,DRG初级感觉神经元的兴奋性增强引起DPN中疼痛信号的产生[3]。脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)通常在一些小型和中型DRG神经元中表达和合成,并且可以从DRG释放以支持神经元发育或参与疼痛感知[4]。BDNF主要与存在于大型和中型DRG神经元的高亲和力受体即酪氨酸激酶受体B(TrkB)结合[5]。研究显示在糖尿病大鼠的DRG中BDNF表达升高[6],并且抗BDNF抗体可以使糖尿病大鼠DRG神经元中电压门控钾电流密度下降的状态趋向正常[7]。目前,尚无报道BDNF是否以及如何调节在DPN进展过程中DRG神经元的兴奋性。本研究采用链脲佐菌素(streptozotocin,STZ)建立DPN大鼠模型,探讨外源性BDNF对DPN大鼠痛觉过敏作用及其机制。
1 材料与方法 1.1 材料 1.1.1 试剂与仪器STZ、BDNF、TrkBFc、多聚赖氨酸均购自美国Sigma公司;TRIZOL、胶原酶、胎牛血清购自美国Invitrogen公司;BCA蛋白测定试剂盒购自上海碧云天生物技术公司;兔抗BDNF单克隆IgG、兔抗TrkB单克隆IgG购自美国Abcam公司;山羊抗兔IgG-HRP、山羊抗小鼠IgG-HRP购自美国Sahta Craz Biutechholgg公司;荧光化学成像仪购自瑞士Bucher Biotec公司;Epc-9放大器和Patch-master软件购自德国HEKA公司。
1.1.2 实验动物和导管植入雄性Wistar大鼠(10周龄,实验开始时体重200~250g)购自山东省实验动物中心。腹腹腔注射3%戊巴比妥钠(1ml/kg体重)麻醉大鼠。无菌条件下于大鼠腰部L6和骶骨S1椎骨之间的间隙做一切口,将无菌聚乙烯导管(PE-10, 长15.0cm,购自美国Instech Laboratories Incorporation公司)通过切口插入蛛网膜下腔,导管的尖端固定在L4腰椎水平,导管末端由皮下穿行至大鼠颈部固定。通过鞘内注射10μl 12%利多卡因来确认导管放置位置。只有在利多卡因注射后30s内出现后爪可逆性麻痹的大鼠视为成功插入导管。
1.2 方法 1.2.1 DNP大鼠模型的建立禁食12h后,成功插入导管的大鼠一次性腹腔注射STZ(55mg/kg新鲜溶解于0.1mol/L柠檬酸缓冲液,pH4.5)。3d后每周检测1次尾静脉血糖浓度。只有在整个实验过程中血糖浓度≥20mmol/L的大鼠作为DNP模型大鼠。
1.2.2 动物分组和鞘内给药将BDNF和TrkB Fc以最终浓度的1000倍溶于二甲基亚砜(DMSO)中,并分装冻存。在使用前将储存液在无菌0.9%氯化钠溶液中稀释。STZ注射后3d,将48只糖尿病大鼠随机分成3组(n=16),并且给予不同药物6周:TrkB组(在BDNF 5μg/20μl/d鞘内给药前30min给予TrkB Fc 5μg/20μl/d),BDNF组(BDNF 5μg/20μl/d鞘内给药)和DPN组(DMSO 0.022μg/20μl/d鞘内给药)在最后一次鞘内给药后第6天测试机械痛觉阈值和热痛觉阈值。
1.2.3 机械痛觉和热痛觉阈值测定采用单育法行为测试。使用Von Frey纤维和热痛仪分别测量左右后爪对机械和热刺激的阈值。采用一系列标准von Frey纤维刺激大鼠后爪的足底中间区域,压力足以使细丝弯曲5s,被测试后爪的快速撤回视为阳性反应。根据文献方法[8]计算50%爪回缩阈值。采用对热刺激的缩足阈值来评价热痛觉过敏。将大鼠置于恒温30℃的薄玻璃平台上。用由高强度灯泡(10W)产生加热速率0.95℃/s的加热灯来加热目标后爪。记录从热刺激开始直到后爪回缩的时间。设定30s的自动终止时间以防止后爪受到损伤。
1.2.4 DRG组织收集完成行为测试后,通过腹腔注射3%戊巴比妥钠(1ml/kg)麻醉并处死动物。从每只动物中取出双侧L4-6 DRG。将来自每组8只大鼠一侧的DRG用于实时定量PCR,另一侧的DRG用于蛋白印迹测定。分离每组8只大鼠两侧的DRG,用于膜片钳记录。
1.2.5 BDNF和TrkB mRNA表达检测用TRIzol提取来自DRG组织的总RNA。使用cDNA合成试剂盒进行逆转录。由上海生工生物工程有限公司设计并合成引物(表 1)。使用Maxima SYBR Green qPCR Master Mix试剂盒在iQ5实时定量PCR检测系统上进行实时定量PCR。计算循环阈值(Ct)值,并使用2-ΔΔCt方法相对于内参GAPDH的水平计算BDNF和TrkB基因的标准化表达水平。
| 表 1 引物序列 |
将DRG组织匀浆后提取蛋白,并使用BCA蛋白测定试剂盒测定蛋白浓度。将含有50μg蛋白质的样品加载到10%SDS凝胶上,通过电泳分离并转移到硝酸纤维素(NC)膜上。用兔抗BDNF单克隆IgG(1 :1000),兔抗TrkB单克隆IgG(1 :2000)和小鼠抗β-actin单克隆IgG(1 :1000)分别在水平摇床上4℃孵育膜12h。洗膜后分别用相应的二抗即山羊抗兔IgG-HRP(1 :2000)或山羊抗小鼠IgG-HRP(1 :3000)孵育膜2h。使用化学发光检测试剂盒在荧光化学成像仪中显现免疫反应性条带。BDNF和TrkB的蛋白表达水平用与β-actin的光密度比率表示。
1.2.7 细胞培养和膜片钳记录在无菌条件下取出大鼠的DRG组织,用0.5%胰蛋白酶和1%胶原酶消化DRG 1h,分解成单细胞。将细胞重悬于由10%胎牛血清组成的DMEM / F-12培养液中并置于含有多聚赖氨酸(0.1mg/ml)预包被的玻璃盖玻片上,保存在37℃ 5%CO2培养箱中,在接种24h内进行记录。使用EPC-9放大器和Patch-master软件进行全细胞电压钳记录。用电阻4MΩ至6MΩ的玻璃微电极与细胞建立高阻(1GΩ~10GΩ)封接。本研究均选取小直径(膜电容≤20pF)的DRG神经元进行兴奋性测定。电极内液成分(mmol/L)为:140 KCl,4 NaCl,10 HEPES,10 EGTA,0.5 CaCl2,1 MgCl2,用KOH调节pH 7.4。细胞外液成分(mmol/L)为:140 NaCl,5 KCl,1.8 CaCl2,1 MgCl2,10 HEPES,10 Glucose,用NaOH调节pH 7.4。将细胞保持在0pA,记录静息电位(resting membrane potential,RMP)。通过施加一系列持续5ms的去极化电流(从0pA开始以每次增加10pA的幅度逐渐升高)来触发第1个动作电位(action potential, AP)以测量阈电流强度。通过施加一持续较长时间的去极化电流(阈电流强度的2倍,持续1s)以触发细胞产生连续AP,计数AP的频率。
1.3 统计学方法计量资料数据以x±s表示,采用SPSS19.0软件统计分析,数据均符合正态分布且方差齐,用单因素方差分析组间差异,然后用Student-Newman-Keuls进行各组间的两两比较。P<0.05为差异具有显著性。
2 结果 2.1 一般情况观察3组大鼠体重改变值和血糖改变值比较分析,注射BDNF和TrkB Fc对体重血糖的影响不大。见表 2。
| 表 2 3组间体重改变值及血糖改变值比较(x±s) |
3组大鼠机械痛觉阈值(F值=57.0,P<0.05)及热痛觉阈值(F值=22.1,P<0.05)存在统计学差异。相较于鞘内注射DMSO溶剂的DPN大鼠,鞘内注射BDNF可以升高机械痛觉阈值和热痛觉阈值,表现出一定的镇痛作用。预先给予TrkB Fc可以阻断BDNF对机械痛觉阈值(P<0.05)和热痛觉阈值(P<0.05)的效应。见图 1。

|
图 1 各组大鼠机械痛觉和热痛觉阈值比较 注:A为机械痛觉阈值(n=16);B为热痛觉阈值(n=16);与DPN组相比,*P<0.05;与BDNF组相比,#P<0.05 |
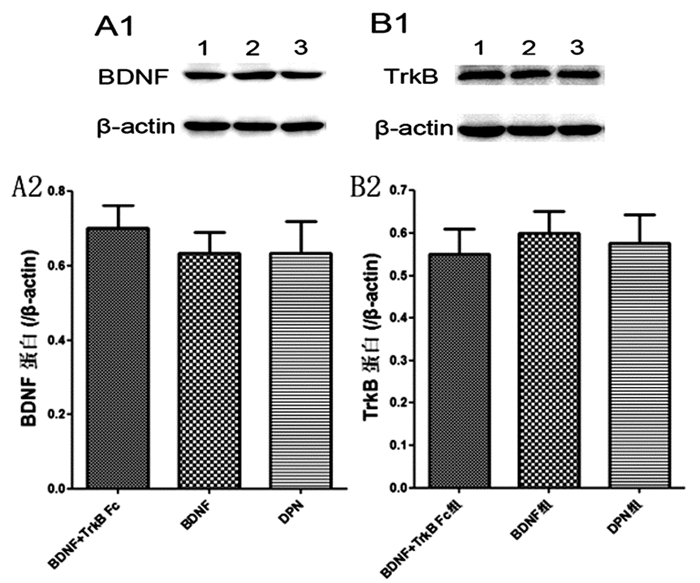
实时定量PCR结果显示,鞘内注射BDNF和TrkB Fc对DPN大鼠的BDNF mRNA(F值=2.5,P>0.05)和TrkB mRNA(F值=0.58,P>0.05)表达无显著影响。见图 2。与BDNF和TrkB mRNA表达结果类似,鞘内注射BDNF和TrkB Fc对DPN大鼠的BDNF蛋白(F值=0.31,P>0.05)和TrkB蛋白(F值=0.23,P>0.05)表达无显著影响。见图 3。

|
图 2
各组大鼠DRG组织BDNF和TrkB mRNA表达
注:A为BDNF mRNA表达统计图(n=8); B为TrkB mRNA表达统计图(n=8) |
|
图 3
各组大鼠DRG组织BDNF和TrkB蛋白表达
注:A1为BDNF及β-actin蛋白条带 A2为BDNF蛋白表达统计图(n=8) B1为TrkB及β-actin蛋白条带 B2为TrkB蛋白表达统计图(n=8) |
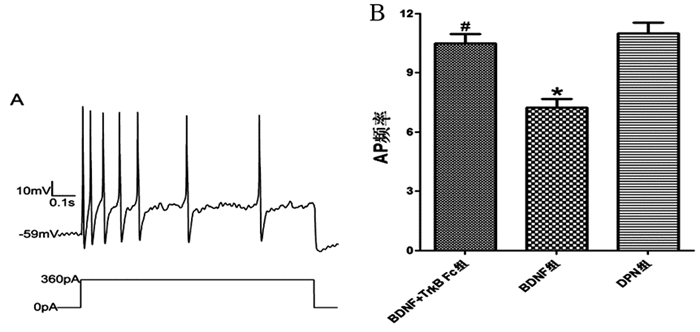
3组大鼠DRG神经元的RMP(F值=9.5,P<0.05)、阈电流水平(F值=16.4,P<0.05)及AP频率(F值=18.2,P<0.05)存在统计学差异。鞘内注射BDNF可以降低DPN大鼠的DRG神经元兴奋性,表现为RMP向超极化方向偏移(P<0.05),阈电流水平升高(P<0.05),以及AP频率降低(P<0.05)。预先应用TrkB Fc可阻断BDNF对RMP(P<0.05)、阈电流水平及AP频率(P<0.05)的效应。见图 4、图 5。

|
图 4 各组大鼠DRG神经元静息电位、阈电流 注:A为一个小直径DRG神经元(膜电容16.8pF)记录到的单个动作电位及刺激电流。B为DRG神经元静息电位统计图(n=24分别来自各组的8只动物)。C为DRG神经元阈电流统计图(n=24分别来自各组的8只动物)。与DPN组相比,*P<0.05;与BDNF组相比,#P<0.05 |
|
图 5 各组大鼠DRG神经元动作电位频率 注:A为一个小直径DRG神经元(膜电容18.5pF)记录到的单个动作电位及刺激电流。B为DRG神经元动作电位频率统计图(n=24分别来自各组的8只动物)与DPN组相比,*P<0.05;与BDNF组相比,#P<0.05 |
DPN以周围神经系统结构和功能改变为主要特点,随着病程进展,损害逐渐加重,症状由初期的痛觉过敏进展为感觉缺失,是导致糖尿病患者截肢的重要原因。由于发病机制不明,除严格控制血糖外,缺乏有效治疗药物。糖尿病神经病变早期,初级感觉神经元的兴奋性增强,引起机械痛觉和热痛觉阈值的下降[9-10],即通常状态不产生伤害性信号的刺激出现过度反应,动物实验表现出痛觉行为。BDNF通过TrkB在DRG的初级感觉神经元中发挥神经调节作用以控制疼痛信号传导,本实验采用向DPN大鼠鞘内注射BDNF的方式,证实BDNF减轻了糖尿病神经病变的痛觉过敏症状。
一般认为感受伤害性刺激的神经元(主要为小直径的DRG神经元)的静息电位通常维持在超极化状态,需要较强的去极化电流才可以产生动作电位,因此只有较强的(具有潜在损害的)机械、热或化学刺激才能使感受伤害性刺激的神经元兴奋。在本实验中,DPN大鼠的DRG神经元兴奋性较强,表现为RMP向去极化方向偏移,诱发出第1个动作电位的阈电流强度较低,动作电位频率较高。同时DPN大鼠对机械刺激和热刺激的缩足阈值较低。电生理实验结果与行为实验结果均与以往的研究[9-10]相符。
BDNF参与生理状态下的疼痛调节[11-12],并且在不同的疼痛模型中发挥作用,如炎症引起的痛觉过敏[13],完全弗氏佐剂引起的热痛觉过敏[14],L5前根切断模型的机械性痛觉过敏[15]和脊髓神经结扎模型的痛觉过敏[16]。以往的研究显示,外源性BDNF可以降低正常大鼠的DRG神经元中电压门控钾电流密度,抗BDNF抗体可以使糖尿病大鼠DRG神经元中电压门控钾电流密度下降的现象趋向正常[7]。本文结果显示连续鞘内注射BDNF 6周显著升高DNP大鼠的机械痛觉和热痛觉阈值,并且降低了DNP大鼠DRG神经元的兴奋性,表现为RMP向去极化方向偏移,诱发出第1个动作电位的阈电流强度下降,动作电位频率升高。提示BDNF通过降低DNP大鼠DRG神经元的兴奋性起到减轻机械痛觉和热痛觉过敏的作用。BDNF的以上效应均可以被预先给予TrkB Fc所阻断,考虑BDNF主要通过与TrkB受体结合从而发挥镇痛作用。以往研究大多针对内源性BDNF在疼痛发生发展过程中的作用,本实验通过鞘内注射外源性的BDNF,不仅验证了BDNF参与疼痛信号的调节,而且提出了BDNF作为镇痛药物的可能性。
有研究显示在糖尿病大鼠的DRG中BDNF mRNA水平增加[6],糖尿病状态下内源性BDNF表达增多,可能在疼痛信号调节过程中发挥相应作用。另外BDNF的生物学功能也可能由于TrkB受体表达及功能改变而受到影响。外源性BDNF可能对DRG组织BDNF及TrkB受体的表达产生调节作用,但本实验结果显示鞘内给予BDNF和TrkB Fc对DPN大鼠BDNF和TrkB的表达无影响,可能与药物剂量较小或给药时程过短有关。
综上所述,外源性BDNF通过降低DRG神经元的过度兴奋缓解DPN大鼠的疼痛症状,BDNF可能是潜在的治疗糖尿病性神经病理性疼痛的新型药物,为治疗糖尿病神经病变提供了新思路。
| [1] |
Yang XY, Sun L, Xu P, et al. Effects of salvianolic scid A on plantar microcirculation and peripheral nerve function in diabetic rats[J]. Eur J Pharmacol, 2011, 665(1/2/3): 40-46. DOI:10.1016/j.ejphar.2011.03.054 |
| [2] |
Ferhatovic L, Banozic A, Kostic S, et al. Expression of calcium/calmodulin-dependent protein kinase Ⅱ and pain-related behavior in rat models of type 1 and type 2 diabetes[J]. Anesth Analg, 2013, 116(3): 712-721. DOI:10.1213/ANE.0b013e318279b540 |
| [3] |
Serra J, Bostock H, Solà R, et al. Microneurographic identification of spontaneous activity in C-nociceptors in neuropathic pain states in humans and rats[J]. Pain, 2012, 153(1): 42-55. DOI:10.1016/j.pain.2011.08.015 |
| [4] |
Ernsberger U. Role of neurotrophin signalling in the differentiation of neurons from dorsal root ganglia and sympathetic ganglia[J]. Cell Tissue Res, 2009, 336(3): 349-384. DOI:10.1007/s00441-009-0784-z |
| [5] |
Chao MV. Neurotrophins and their receptors:a convergence point for many signalling pathways[J]. Nat Rev Neurosci, 2003, 4(4): 299-309. DOI:10.1038/nrn1078 |
| [6] |
Fernyhough P, Diemel LT, Brewster WJ, et al. Altered neurotrophin mRNA levels in peripheral nerve and skeletal muscle of experimentally diabetic rats[J]. J Neurochem, 1995, 64(3): 1231-1237. |
| [7] |
Cao XH, Byun HS, Chen SR, et al. Reduction in voltage-gated K+ channel activity in primary sensory neurons in painful diabetic neuropathy:role of brain-derived neurotrophic factor[J]. J Neurochem, 2010, 114(5): 1460-1475. DOI:10.1111/j.1471-4159.2010.06863.x |
| [8] |
Xu X, Liu Z, Liu H, et al. The effects of galanin on neuropathic pain in streptozotocin-induced diabetic rats[J]. Eur J Pharmacol, 2012, 680(1-3): 28-33. DOI:10.1016/j.ejphar.2012.01.011 |
| [9] |
Sun W, Miao B, Wang XC, et al. Gastrodin inhibits allodynia and hyperalgesia in painful diabetic neuropathy rats by decreasing excitability of nociceptive primary sensory neurons[J]. PLoS One, 2012, 7(6): e39647. DOI:10.1371/journal.pone.0039647 |
| [10] |
Todorovic SM, Jevtovic-Todorovic V. Targeting of CaV3.2 T-type calcium channels in peripheral sensory neurons for the treatment of painful diabetic neuropathy[J]. Pflugers Arch, 2014, 466(4): 701-706. DOI:10.1007/s00424-014-1452-z |
| [11] |
Yajima Y, Narita M, Usui A, et al. Direct evidence for the involvement of brain-derived neurotrophic factor in the development of a neuropathic pain-like state in mice[J]. J Neurochem, 2005, 93(3): 584-594. DOI:10.1111/j.1471-4159.2005.03045.x |
| [12] |
Todorovic SM, Jevtovic-Todorovic V. Targeting of CaV3.2 T-type calcium channels in peripheral sensory neurons for the treatment of painful diabetic neuropathy[J]. Pflugers Arch, 2014, 466(4): 701-706. DOI:10.1007/s00424-014-1452-z |
| [13] |
Groth R, Aanonsen L. Spinal brain-derived neurotrophic factor (BDNF) produces hyperalgesia in normal mice while antisense directed against either BDNF or trkB, prevent inflammation-induced hyperalgesia[J]. Pain, 2002, 100(1/2): 171-181. |
| [14] |
Zhang HH, Zhang XQ, Xue QS, et al. The BDNF/TrkB signaling pathway is involved in heat hyperalgesia mediated by Cdk5 in rats[J]. PLoS One, 2014, 9(1): e85536. DOI:10.1371/journal.pone.0085536 |
| [15] |
Chen HS, Zhou ZH, Li M, et al. Contribution of brain-derived neurotrophic factor to mechanical hyperalgesia induced by ventral root transection in rats[J]. Neuroreport, 2013, 24(4): 167-170. DOI:10.1097/WNR.0b013e32835d4b97 |
| [16] |
Zhang X, Xu Y, Wang J, et al. The effect of intrathecal administration of glial activationinhibitors on dorsal horn BDNF overexpression and hind paw mechanical allodynia in spinalnerve ligated rats[J]. J Neural Transm, 2012, 119(3): 329-336. DOI:10.1007/s00702-011-0713-7 |



