Joubert综合征(Joubert syndrome,JS)是一种非常罕见的常染色体隐性遗传或X连锁遗传的疾病,由Joubert等[1]在1969年首次报道。该病主要临床表现有肌张力减低、异常呼吸运动(发作性呼吸急促、呼吸暂停)、眼球运动异常(眼球震颤、斜视等)、共济失调和发育迟缓等,可伴有视网膜、肾脏、肝脏和骨骼等多脏器损害。主要病理特征是小脑蚓部发育不全或缺如,在影像学上形成特征性的表现:磨牙征及蝙蝠翼征、中线裂征、三角征[2-3]。国外报道的发病率为1 :100000~1 :80000,因本病为罕见病,国内目前仅有个案报道,尚无发病率统计。本文对1例Joubert综合征患儿的临床资料进行分析,并对患儿及其父母进行相关基因测序分析,以提高临床医生对该疾病的临床及基因诊断认识。
1 病例资料患儿,男,汉族,1月12天,因“咳嗽1天余,发热10h”于2017年11月10日入院。
个人史及既往史:患儿系第1胎第1产,母孕期未定期产检,胎龄41周,经阴娩出,出生体重3.70kg,Apgar评分不详,生后因“生后呻吟、气促伴不哭、反应差、口吐泡沫17min”在当地医院住院治疗。
家族史:患儿父母均27岁,农民,非近亲婚配,身体健康,否认家族性遗传病史。
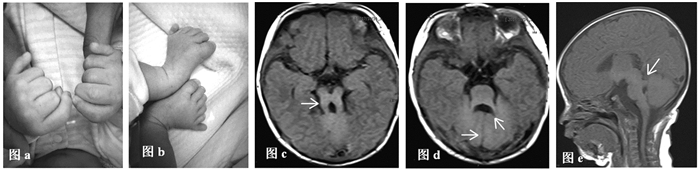
体格检查:T 37.2℃,P 150次/min,R 66次/min,体重4.75kg,身高59.5cm,头围39.8cm。反应可,呼吸急促。面色、口周无发绀。前囟平坦,大小2cm×2cm。眼球活动欠灵活,双侧瞳孔等大等圆,对光反射灵敏。三凹征弱阳性。双肺呼吸音粗,吸气末闻及少许水泡音。心脏听诊及腹部查体无异常。双手、双足均为六指(趾)畸形(图 1a、1b)。四肢肌张力减低。
2 辅助检查MRI表现:双侧大脑半球结构对称,脑灰白质对比正常,未见异常信号,胼胝体变小。小脑上脚增厚、延长,垂直于脑干,脑脚池增大,轴位呈现“磨牙征”(图 1c、图 1e),小脑蚓部发育不良,双侧小脑半球间呈“中线裂征”(图 1d),第四脑室形态不规则,呈“蝙蝠翼”状(图 1d)。双侧颞部脑外间隙增宽,中线结构居中。诊断意见:先天性脑发育异常,符合Joubert综合征MRI表现。
|
图 1 患儿多指趾畸形及MRI表现 注:图a、b示双手、双足均为六指/趾畸形;图c示MRI轴位示“磨牙征”(箭头);图d示MRI轴位示双侧小脑半球间呈“中线裂征”(水平箭头),第四脑室变形呈“蝙蝠翼征”(斜箭头);图e示MRI矢状位示小脑上脚增粗,垂直于脑干,骑跨于第四脑室上部(箭头)。 |
胸片:双肺纹理增强,见散在点片状模糊影,支气管肺炎表现。
心脏彩超:先天性心脏病,主动脉缩窄,卵圆孔未闭。腹部B超:肝胆胰脾双肾未见异常。
肝肾功、心肌酶、血电解质、优生优育五项、甲状腺功能三项检查均无异常。血串联质谱检测:所测氨基酸及酰基肉碱无显著异常。尿串联质谱检测:所测有机酸未见异常。
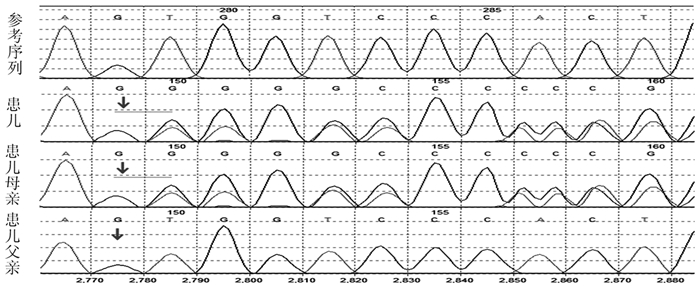
分子遗传学检测结果显示,在患儿TCTN1基因,发现一个杂合病理性变异:TCTN1(12q24|NM_001082538.2),外显子号:Exon9,cDNA水平:c.1063dupG,蛋白水平:p.(Val355fs),该变异为移码变异,预计会使所编码蛋白质自第355位氨基酸Val开始发生移码,并使得蛋白质翻译提前终止,所编码的蛋白质发生截短从而丧失其正常功能。该突变位点为首次报道,ESP6500siv-ALL、dbSNP147和千人基因组(1000g2015aug-ALL)数据库均未见收录。对患儿父母TCTN1(12q24|NM_001082538.2)基因的c.1063位点进行检测,患儿母亲检测到该位点的基因变异,患儿父亲未检测到(见图 2)。
|
图 2 患儿及其父母基因测序结果 注:箭头示患儿及其母亲在TCTN1基因检测到移码突变c.1063dupG(p.Val355fs);患儿父亲未检测到该位点基因变异。 |
入院后给予抗感染、雾化、呼吸道管理等对症支持治疗,患儿于2017年11月18日好转出院,出院时患儿无咳喘,体温稳定,肺部听诊无干湿性啰音,但仍有阵发性呼吸急促,无皮肤发绀表现,肌张力减低。嘱患儿家长出院后长期儿童康复科随诊患儿生长发育等情况。
4 随访情况患儿5月龄时于我院心外科行主动脉缩窄矫正术;7月龄时仍竖颈不稳、不会翻身、不能扶坐,肌张力明显减低且逐渐加重,期间曾因“支气管肺炎”住院治疗3次,后因失去联系方式未再随访。
5 讨论Joubert综合征主要病理特征是小脑蚓部发育不全或缺如,小脑和脑干核团发育异常,小脑上脚白质束、中央脑桥束、皮质延髓束交叉缺如。由于小脑蚓部发育不全或缺如、第四脑室变形、小脑上脚增宽,在MRI形成特征性的表现:中线裂征、蝙蝠翼征、三角征及磨牙征。绝大多数学者认为影像学上的“磨牙征”是诊断该病必须具备的[4-5],此外,临床表现有:1)婴儿期肌张力减低及后发展的共济失调;2)程度不等的发育迟缓或智力障碍;3)呼吸异常或眼部运动异常,“Joubert综合征”即可临床诊断,但呼吸异常往往随着年龄的增长而改善,并有可能完全恢复[4]。除上述表现外,Joubert综合征常合并其他脏器损害,这类疾病被称为“Joubert相关疾病(JSRD)”,根据受累脏器不同,Brancati等[4]将Joubert综合征分为6个临床亚型:单纯型JS、单纯型JS伴眼缺陷、单纯型JS伴肾脏缺陷、单纯型JS伴视网膜缺陷、单纯型JS伴肝脏缺陷、单纯型JS伴口面指畸形,此外,少数JS患者还合并有先天性心脏病、癫痫、巨结肠、内脏转位、脊柱侧弯、颅骨缺陷等。单纯型JS只发生在少数患者身上,多数患者往往合并其他脏器的异常[6],或部分患者在婴儿或幼儿期诊断为单纯型JS,但随着时间推移而逐渐出现其他脏器病变。因此,一旦对JS作出诊断,应进行全面的检查以评估是否有其他脏器的参与。本研究系1月余小婴儿,有肌张力减低、眼球运动障碍、阵发性呼吸急促及逐渐表现出的发育迟缓等临床表现,MRI呈典型的“磨牙征”表现,符合Joubert综合征的临床诊断标准,考虑为单纯型JS伴口面指畸形这一亚型。患儿还伴有先天性心脏病,JS患者中关于心脏异常的报道很少见。
Joubert综合征的生化及分子学基础尚不完全清楚,一般认为与原始纤毛的结构、功能缺陷有关,因此,被归类于“纤毛病”,目前有30余个致病基因被发现[7],本研究中检测到的TCTN1基因是已证实的JS致病基因。此病基因型与临床表型间的联系尚不完全清楚,每一个亚型对应不同的基因型,而一个基因突变可导致不同的亚型。据报道,AHI1基因突变常导致有视网膜缺损的JSRD,约占该亚型的20%左右[8-9];在合并肾脏缺陷这一表型中最常见的致病基因是NPHP1和RPGRIP1L[10-13];TMEM67基因常与肝脏受累有关[14-15];CC2D2A多与单纯型JS相关[16]。关于基因TCTN1,目前没有发现与其对应的临床表型,但也有研究显示,TCTN1突变所致的JS患者中,均没有发现视网膜及肾脏病变[17]。本研究中患儿除有典型JS表现外,同时合并有多指畸形、心脏发育畸形,这种临床表型在TCTN1基因所致的JS患者中鲜有报道。
Joubert综合征的临床症状从轻到重不等,如精神障碍从轻度到重度不等,视力可从正常到失明,有的可存活至老,有的在新生儿期即死亡,预后不一,但大部分患儿在新生儿期即因呼吸系统并发症而死亡。目前尚无特异性的治疗方法,但也有研究显示康复训练、中医针灸治疗有助于改善患儿临床症状[18]。遗传咨询是该病管理的重要组成部分,一旦对新生儿做出诊断,应尽可能地明确其致病基因,再次妊娠时,早期即可行胎儿DNA检测进行产前诊断,对于未能明确致病基因者,可进行胎儿超声及MRI检测[19],尽可能早的在胎儿期做出诊断,减少JS患儿的出生。
| [1] |
Joubert M, Eisenring JJ, Robb JP, et al. Familial agenesis of the cerebellar vermis:A syndrome of episodic hyperpnea, abnormal eye movements, ataxia, and retardation[J]. Neurology, 1969, 19(9): 813-825. DOI:10.1212/WNL.19.9.813 |
| [2] |
Karakas E, Cullu N, Karakas O, et al. Joubert syndrome:the clinical and radiological findings[J]. J Pak Med Assoc, 2014, 64(1): 91-94. |
| [3] |
徐志勇, 范程, 张飘尘, 等. Joubert综合征的MRI表现[J]. 临床放射学杂志, 2015, 34(5): 837-840. DOI:10.13437/j.cnki.2015.05.046 |
| [4] |
Brancati F, Dallapiccola B, Valente EM. Joubert Syndrome and related disorders[J]. Orphanet J Rare Dis, 2010, 5: 20. DOI:10.1186/1750-1172-5-20 |
| [5] |
Parisi MA. Clinical and molecular features of Joubert syndrome and related disorders[J]. Am J Med Genet C Semin Med Genet, 2009, 151C(4): 326-340. DOI:10.1002/ajmg.c.30229 |
| [6] |
Bachmann-Gagescu R, Dempsey JC, Phelps IG, et al. Joubert syndrome:a model for untangling recessive disorders with extreme genetic heterogeneity[J]. J Med Genet, 2015, 52(8): 514-522. DOI:10.1136/jmedgenet-2015-103087 |
| [7] |
Vilboux T, Doherty DA, Glass IA, et al. Molecular genetic findings and clinical correlations in 100 patients with Joubert syndrome and related disorders prospectively evaluated at a single center[J]. Genet Med, 2017, 19(8): 875-882. DOI:10.1038/gim.2016.204 |
| [8] |
Valente EM, Brancati F, Silhavy JL, et al. AHI1 gene mutations cause specific forms of Joubert syndrome-related disorders[J]. Ann Neurol, 2006, 59(3): 527-534. DOI:10.1002/ana.20749 |
| [9] |
Parisi MA, Doherty D, Eckert ML, et al. AHI1 mutations cause both retinal dystrophy and renal cystic disease in Joubert syndrome[J]. J Med Genet, 2006, 43(4): 334-339. DOI:10.1136/jmg.2005.036608 |
| [10] |
Delous M, Baala L, Salomon R, et al. The ciliary gene RPGRIP1L is mutated in cerebello-oculo-renal syndrome (Joubert syndrome type B) and Meckel syndrome[J]. Nat Genet, 2007, 39(7): 875-881. DOI:10.1038/ng2039 |
| [11] |
Arts HH, Doherty D, van Beersum SE, et al. Mutations in the gene encoding the basal body protein RPGRIP1L, a nephrocystin-4 interactor, cause Joubert syndrome[J]. Nat Genet, 2007, 39(7): 882-888. DOI:10.1038/ng2069 |
| [12] |
Brancati F, Travaglini L, Zablocka D, et al. RPGRIP1L mutations are mainly associated with the cerebello-renal phenotype of Joubert syndrome-related disorders[J]. Clin Genet, 2008, 74(2): 164-170. DOI:10.1111/j.1399-0004.2008.01047.x |
| [13] |
Wolf MT, Saunier S, O'Toole JF, et al. Mutational analysis of the RPGRIP1L gene in patients with Joubert syndrome and nephronophthisis[J]. Kidney Int, 2007, 72(12): 1520-1526. DOI:10.1038/sj.ki.5002630 |
| [14] |
Iannicelli M, Brancati F, Mougou-Zerelli S, et al. Novel TMEM67 mutations and genotype-phenotype correlates in meckelin-related ciliopathies[J]. Hum Mutat, 2010, 31(5): E1319-1331. DOI:10.1002/humu.21239 |
| [15] |
Doherty D, Parisi MA, Finn LS, et al. Mutations in 3 genes (MKS3, CC2D2A and RPGRIP1L) cause COACH syndrome (Joubert syndrome with congenital hepatic fibrosis)[J]. J Med Genet, 2010, 47(1): 8-21. DOI:10.1136/jmg.2009.067249 |
| [16] |
苏艳华, 谢建生, 尉姗姗, 等. CC2D2A基因变异所致Joubert综合征一家系的临床及分子遗传学分析[J]. 中华儿科杂志, 2015, 53(6): 431-435. DOI:10.3760/cma.j.issn.0578-1310.2015.06.007 |
| [17] |
Garcia-Gonzalo FR, Corbit KC, Sirerol-Piquer MS, et al. A transition zone complex regulates mammalian ciliogenesis and ciliary membrane composition[J]. Nat Genet, 2011, 43(8): 776-784. DOI:10.1038/ng.891 |
| [18] |
施炳培, 李惠, 卜怀娣, 等. 穴位注射治疗小儿脑性瘫痪精细运动功能障碍57例疗效观察[J]. 中国康复理论与实践, 2006, 13(2): 105-106. DOI:10.3969/j.issn.1006-9771.2012.07.030 |
| [19] |
Saleem SN, Zaki MS. Role of MR imaging in prenatal diagnosis of pregnancies at risk for Joubert syndrome and related cerebellar disorders[J]. AJNR Am J Neuroradiol, 2010, 31(3): 424-429. DOI:10.3174/ajnr.A1867 |



