2. 济宁医学院附属医院, 济宁 272029
2. Affiliated Hospital of Jining Medical University, Jining 272029, China
继发性骨质疏松症是指由于药物或疾病原因导致的骨量减少、骨微结构破坏、骨脆性增加和易于骨折的代谢性疾病[1]。在继发性骨质疏松中,以糖皮质激素性骨质疏松最为常见。当糖皮质激素直接或间接导致成骨细胞凋亡、功能下降时,或者影响破骨细胞功能时,会导致骨量丢失,促进骨质疏松的发生[2]。长链非编码RNA(long non-coding RNA, lncRNA)在调控生长发育、细胞定向分化、增殖和凋亡方面具有重要作用[3]。研究表明,lncRNA在成骨细胞的分化中发挥着作用,过表达ANCR可以有效地抑制成骨细胞的分化[4]。TUG1是一种长度为7.1kb的lncRNA,可影响细胞周期调控基因的表达[5]。有研究发现,TUG1基因的敲除可以抑制小鼠视网膜的发育,TUG1的表达下调会抑制骨肉瘤细胞的增殖并促进骨肉瘤细胞的凋亡[6-7]。由于成骨细胞为骨肉瘤的前体细胞[8],我们推测,TUG1在成骨细胞凋亡过程中通过信号通路发挥着一定作用。本实验中我们以地塞米松诱导小鼠成骨细胞MC3T3-E1凋亡,将TUG1过表达质粒转染小鼠成骨细胞MC3T3-E1,观察TUG1对小鼠成骨细胞凋亡的影响。
1 材料与方法 1.1 材料MC3T3-E1细胞(美国ATCC公司);DMEM培养基、胎牛血清(Fatal Bovine Serum, FBS)、山羊血清(美国Gibco公司);0.25%胰蛋白酶、地塞米松(Dexamethasone)、氨苄青霉素(Ampicillin)(美国sigma公司);青霉素、链霉素、细胞培养板、细胞培养瓶(美国Labserve公司);质粒小提试剂盒、RNA提取试剂盒(北京天根生化科技有限公司);cDNA第一链合成试剂盒、qPCR预混体系(广州复能基因有限公司);AnnexinV-FITC、细胞裂解液(江苏碧云天生物技术研究所);ELISA细胞凋亡检测试剂盒、DAPI(德国Roche公司);Bcl-2一抗、HRP标记的山羊抗兔二抗(英国Abcom公司);Lipofectamine 2000 Reagent(美国Invitrogen公司);曲拉通X-100(上海阿拉丁生化科技有限公司);抗荧光淬灭封片剂(北京索莱宝科技有限公司);TUG1过表达质粒由上海吉凯基因化学技术有限公司编码测序。
1.2 方法 1.2.1 细胞培养细胞复苏后接种于25cm2培养瓶中,用含有10%胎牛血清、1%双抗(青霉素、链霉素)的DMEM培养,将细胞置于37℃,5% CO2细胞培养箱内,隔天换液,待细胞汇片后以0.25%胰蛋白酶(含EDTA)消化进行传代培养[9]。
1.2.2 MC3T3-E1细胞凋亡模型的建立将细胞接种于6孔板上,待细胞汇片,实验分为3组,即对照组(DMEM完全培养基)、无血清饥饿组(不含血清的DMEM培养基培养)、地塞米松组(DMEM完全培养基+10μM地塞米松),每组设3个平行实验,干预24h后行qPCR检测TUG1的表达。
1.2.3 TUG1基因测序lncRNA TUG1基因序列为GATCCCAGGGACTTGCAACCTGGTTATCTCGAG ATAACCAGGTTGCAAGTCCCTTTTTTGGA,该序列的设计合成以及测序均由上海吉凯基因化学技术有限公司完成。质粒扩增使用TOP10感受态细胞,使用质粒小提试剂盒完成质粒抽提。
1.2.4 PCR引物设计PCR引物的设计合成是由上海生物工程有限公司完成,引物序列如下:
| 表 1 PCR引物序列 |
将小鼠MC3T3-E1细胞以5×108/孔接种到6孔板中,每孔加入2ml的DMEM(含10%胎牛血清、1%双抗)培养基中培养,细胞接种24h后,实验分4组:对照组、地塞米松组、地塞米松+阴性质粒组、地塞米松+TUG1过表达质粒组。以质粒1.5μg/Lipo 2000 5μl为转染条件, 转染过程中使用不含胎牛血清的DMEM培养基培养细胞,转染4h后换液(DMEM培养基含10%胎牛血清、1%双抗),按分组加入10μl的地塞米松溶液。48h后显微镜下观察荧光与细胞状态,以观察转染效率,使用荧光定量PCR检测TUG1表达,使用流式细胞术检测细胞凋亡。
1.2.6 TUG1mRNA检测取干预结果的细胞,弃去培养基,用PBS冲洗3次,提取细胞总RNA,合成cDNA。根据qPCR试剂盒说明书进行PCR扩增,反应体系为:PCR Mix 10μl,上下游引物(2μmol/L)各2μl,模板2μl,加双蒸水至20μl。扩增程序为:95℃ 10min后,95℃ 10s,60℃ 20s,72℃ 30s,40个循环。
1.2.7 细胞凋亡检测吸出细胞培养基,使用PBS洗涤细胞1次,加入适量不含EDTA的蛋白胰酶消化液;室温孵育至贴壁细胞可轻轻吹打下来,吸除胰蛋白酶消化液,加入细胞培养液轻轻吹打细胞,1000g离心5min,弃上清,使用PBS重悬细胞并计数;根据上述的细胞计数,取5万的重悬细胞,1000g离心5min,弃上清,加入195μl AnnexinV-FITC结合液轻轻重悬细胞;加入5μl AnnexinV-FITC混匀;加入10μl碘化丙啶染色液,混匀;室温(20℃~25℃)避光孵育20min,随后置于冰浴中;1~2h完成上机。
1.2.8 Bcl-2表达检测细胞培养24h后转染,转染48h后采取免疫荧光法检测Bcl-2,步骤如下:使用0.3%的曲拉通X-100破膜10min,PBS洗涤3次;10%的山羊血清室温(25℃)封闭1h;使用避光湿盒一抗孵育过夜(20h),PBS洗涤3次;使用避光湿盒二抗孵育1h,PBS洗涤3次;DAPI染色10min,PBS洗涤3次,使用抗荧光淬灭封片剂封片,避光保存。
1.3 统计学方法采用SPSS 20.0统计软件进行统计处理,实验数据以x±s表示,多个样本间的均数比较采用单因素方差分析,组间比较采用LSD法。以P<0.05为差异具有统计学意义。
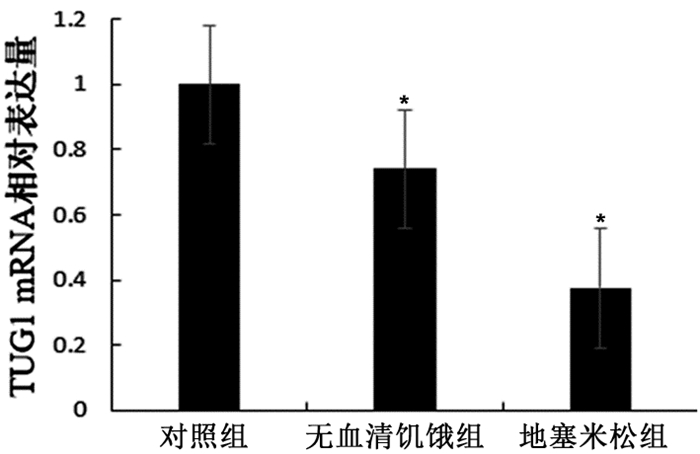
2 结果 2.1 TUG1在小鼠MC3T3-E1的表达情况与对照组相比,在地塞米松、无血清饥饿诱导的MC3T3-E1细胞中,TUG1的表达显著降低,其中TUG1的表达下调在地塞米松诱导的MC3T3-E1细胞凋亡最明显, 差异具有统计学意义(P<0.05)。见图 1。
|
图 1 无血清饥饿和地塞米松诱导的小鼠成骨细胞MC3T3-E1凋亡对TUG1表达的影响 注:与对照组相比较,*P<0.05,n=3 |
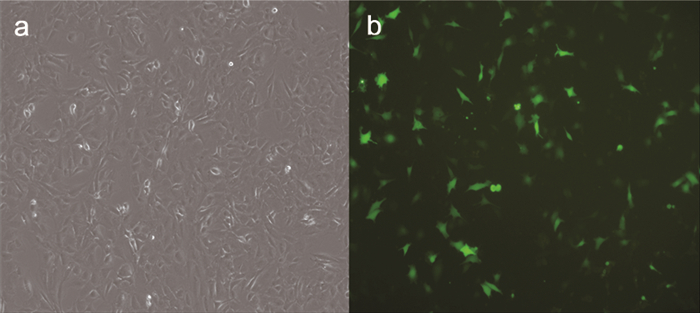
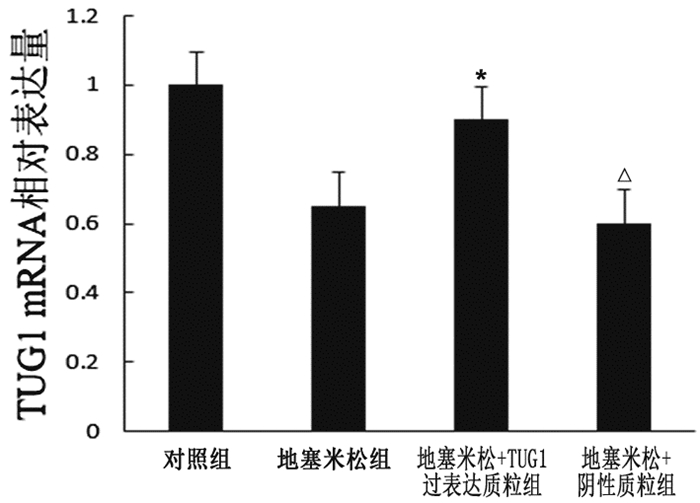
如图 2所示,TUG1过表达质粒转染MC3T3-E1细胞后48h显微镜下细胞可见较多量绿色荧光。行荧光定量PCR检测TUG1的表达,结果显示TUG1 mRNA在地塞米松+TUG1过表达质粒组的表达较地塞米松组显著增多(图 3),差异具有统计学意义(P<0.05)。
|
图 2 TUG1过表达质粒转染小鼠MC3T3-E1细胞后明、暗视野图片(×100) 注:a.明视野;b.暗视野 |
|
图 3
转染质粒后MC3T3-E1细胞中TUG1 mRNA的表达情况
注:与地塞米松组比较,*P<0.05; 与地塞米松组比较,△P>0.05,n=3。 |
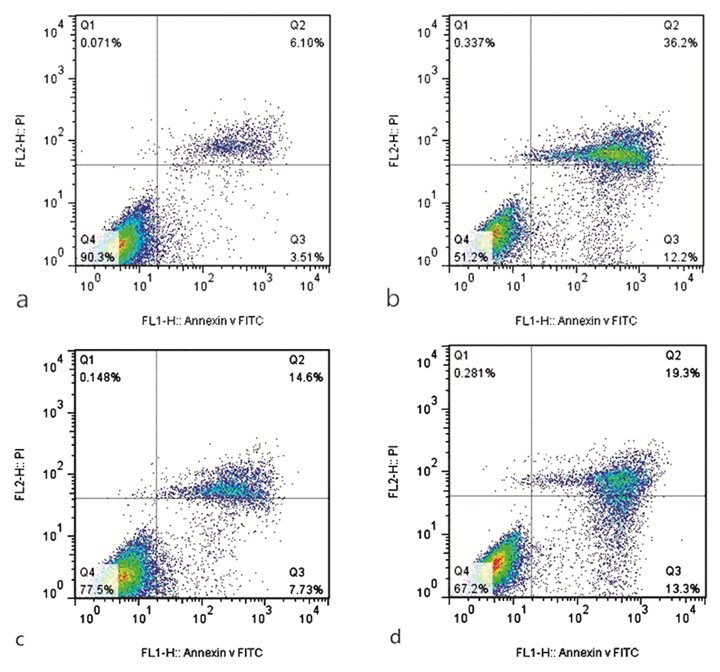
质粒转染细胞后,地塞米松+TUG1过表达质粒组细胞凋亡比地塞米松组明显减少,而地塞米松+阴性质粒组没有明显变化。见图 4。
|
图 4 流式细胞术检测TUG1对地塞米松诱导的MC3T3-E1细胞凋亡的影响 注:a.对照组;b.地塞米松组;c.地塞米松+TUG1过表达质粒组;d.地塞米松+阴性质粒组 |
结合Image J软件荧光定量分析,TUG1过表达质粒组Bcl-2的表达较地塞米松组显著增加(图 5),差异具有统计学意义(P<0.05),阴性对照组没有明显变化。
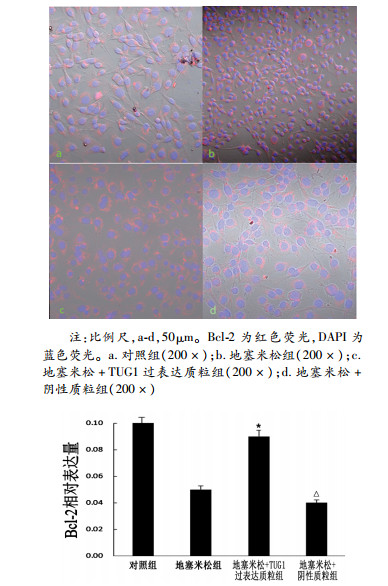
|
图 5
TUG1过表达质粒对Bcl-2表达的影响
注:与地塞米松组比较,*P<0.05; 与地塞米松组比较,△P>0.05,n=3 |
在继发性骨质疏松症中以糖皮质激素诱导的骨质疏松(Glucocorticoid-induced osteoporosis, GIOP)最为多见,糖皮质激素通过减少成骨细胞的寿命和抑制新的成骨细胞的形成来抑制骨质形成,因此糖皮质激素打破了成骨细胞和破骨细胞之间的动态平衡,导致骨量减少,甚至发生骨质疏松[10]。长链非编码RNA(long non-coding RNA, lncRNA)在细胞生长、凋亡过程中发挥着作用。Ozgur等[11]研究发现,遗传毒性应激所导致的HeLa和MCF-7细胞凋亡可以调控某些特定的lnc-RNA分化。在主动脉钙化中,TUG1的敲除在体内和体外均可抑制成骨细胞的分化,TUG1通过抑制miR-204-5p实现向调节Runx2的表达,以此促进主动脉钙化性疾病中成骨细胞的分化[12]。TUG1在各种癌症类型中发挥重要作用,其中包括骨肉瘤。TUG1的敲除可以抑制骨肉瘤细胞的增殖促进其凋亡,可以通过调节miR-212-3p/FOXA1轴来实现[13-14]。成骨细胞是骨肉瘤的前体细胞,我们可推测在成骨细胞凋亡过程中,TUG1可能发挥着一定的作用,然而目前关于二者相互作用的机制研究尚不明确。
在本实验中,我们使用地塞米松、无血清饥饿诱导MC3T3-E1细胞凋亡,用qPCR检测TUG1的表达。通过实验我们发现,TUG1在地塞米松诱导的小鼠MC3T3-E1凋亡中表达显著降低,提示TUG1与地塞米松诱导的成骨细胞凋亡密切相关,这为我们后续的实验奠定了基础。随后,我们构建TUG1过表达质粒,使用该质粒转染MC3T3-E1细胞,qPCR检测TUG1的表达,结果显示地塞米松+TUG1过表达质粒组中TUG1表达上调较地塞米松组明显(P<0.05),地塞米松+阴性质粒组则没有明显变化,提示质粒转染成功。用流式细胞术检测细胞凋亡,与对照组相比较,TUG1过表达质粒组细胞凋亡显著减少,提示TUG1可以抑制地塞米松诱导的MC3T3-E1细胞凋亡,这说明在地塞米松诱导的MC3T3-E1细胞中,TUG1是一种保护性因素。细胞凋亡为程序性凋亡,线粒体在细胞凋亡过程中发挥重要作用[15]。线粒体外膜的完整性由Bcl-2家族调控,Bcl-2属于细胞溶质蛋白家族,由抗凋亡蛋白(如Bcl-2,Bcl-XL)和促凋亡蛋白(如Bax,Bak)组成[16]。当促进细胞凋亡的信号超过抗凋亡信号时,抗凋亡因子Bcl-2蛋白的表达就会受到影响。为了进一步明确TUG1调控地塞米松诱导的MC3T3-E1细胞凋亡的具体机制,我们使用免疫荧光检测在地塞米松诱导的MC3T3-E1细胞中Bcl-2的表达,结合荧光定量分析,结果显示,TUG1过表达可显著上调Bcl-2的表达,提示TUG1可能通过上调Bcl-2的表达抑制地塞米松诱导的小鼠成骨细胞MC3T3-E1细胞凋亡。
综上所述,地塞米松可以诱导小鼠成骨细胞MC3T3-E1细胞凋亡,TUG1是地塞米松诱导的成骨细胞凋亡的关键保护性因子。明确TUG1与成骨细胞凋亡的机制,可能会给我们在临床上治疗骨质疏松提供新的研究方向。鉴于作用机制的复杂性,在接下来的实验中,我们将进行体内实验,进一步探讨其可能的作用机制。
| [1] |
Liu K, Jing Y, Zhang W, et al. Silencing miR-106b accelerates osteogenesis of mesenchymal stem cells and rescues against glucocorticoid-induced osteoporosis by targeting BMP2[J]. Bone, 2017, 97: 130-138. DOI:10.1016/j.bone.2017.01.014 |
| [2] |
Huang ZF, Cheng C, Wang J, et al. Icariin regulates the osteoblast differentiation and cell proliferation of MC3T3-E1 cells through microRNA-153 by targeting Runt-related transcription factor 2[J]. Exp Ther Med, 2018, 15(6): 5159-5166. DOI:10.3892/etm.2018.6127 |
| [3] |
Batista PJ, Chang HY. Long noncoding RNAs:cellular address codes in development and disease[J]. Cell, 2013, 152(6): 1298-1307. DOI:10.1016/j.cell.2013.02.012 |
| [4] |
Zhu L, Xu PC. Downregulated LncRNA-ANCR promotes osteoblast differentiation by targeting EZH2 and regulating Runx2 expression[J]. Biochem Biophys Res Commun, 2013, 432(4): 612-617. DOI:10.1016/j.bbrc.2013.02.036 |
| [5] |
Han YH, Liu YC, Gui YT, et al. Long intergenic non-coding RNA TUG1 is overexpressed in urothelial carcinoma of the bladder[J]. J Surg Oncol, 2013, 107(5): 555-559. DOI:10.1002/jso.23264 |
| [6] |
Zhang Q, Geng PL, Yin P, et al. Down-regulation of long non-coding RNA TUG1 Inhibits osteosarcoma cell proliferation and Promotes apoptosis[J]. Asian Pac J Cancer Prev, 2013, 14(4): 2311-5. DOI:10.7314/APJCP.2013.14.4.2311 |
| [7] |
Xie CH, Chen BW, Wu BY, et al. LncRNA TUG1 promotes cell proliferation and suppresses apoptosis in osteosarcoma by regulating miR-212-3p/FOXA1 axis[J]. Biomed Pharmacother, 2018, 97: 1645-1653. DOI:10.1016/j.biopha.2017.12.004 |
| [8] |
Sottnik JL, Campbell B, Mehra R, et al. Osteocytes serve as a progenitor cell of osteosarcoma[J]. J Cell Biochem, 2014, 115(8): 1420-1429. DOI:10.1002/jcb.24793 |
| [9] |
Liu WL, Zhao ZQ, Na YY, et al. Dexamethasone-induced production of reactive oxygen species promotes apoptosis via endoplasmic reticulum stress and autophagy in MC3T3-E1 cells[J]. Int J Mol Med, 2018, 41(4): 2028-2036. DOI:10.3892/ijmm.2018.3412 |
| [10] |
Huyut Z, Bakan NR, Yildirm S, et al. Effects of the phosphodiesterase-5(PDE-5) inhibitors, avanafil and zaprinast, on bone remodeling and oxidative damage in a rat model of glucocorticoid-induced osteoporosis[J]. Med Sci Monit Basic Res, 2018, 24: 47-58. DOI:10.12659/MSMBR.908504 |
| [11] |
Ozgür E, Mert U, Isin M, et al. Differential expression of long non-coding RNAs during genotoxic stress-induced apoptosis in HeLa and MCF-7 cells[J]. Clin Exp Med, 2013, 13(2): 119-126. DOI:10.1007/s10238-012-0181-x |
| [12] |
Yu C, Li LF, Xie F, et al. LncRNA TUG1 sponges miR-204-5p to promote osteoblast differentiation through upregulating Runx2 in aortic valve calcification[J]. Cardiovasc Res, 2018, 114(1): 168-179. DOI:10.1093/cvr/cvx180 |
| [13] |
Jiang NX, Xia JW, Jiang B, et al. TUG1 alleviates hypoxia injury by targeting miR-124 in H9c2 cells[J]. Biomed Pharmacother, 2018, 103: 1669-1677. DOI:10.1016/j.biopha.2018.04.191 |
| [14] |
Li G, Liu KY, Du XH. Long non-coding RNA TUG1 promotes proliferation and inhibits apoptosis of osteosarcoma cells by sponging miR-132-3p and upregulating SOX4 expression[J]. Original Article, 2018, 59(2): 226-235. DOI:10.3349/ymj.2018.59.2.226 |
| [15] |
Wei M, Duan DM, Liu YJ, et al. Autophagy may protect MC3T3-E1 cells from fluoride-induced apoptosis[J]. Mol Med Rep, 2014, 9(6): 2309-2315. DOI:10.3892/mmr.2014.2079 |
| [16] |
Liang QH, Liu Y, Wu SS, et al. Ghrelin inhibits the apoptosis of MC3T3-E1 cells through ERK and AKT signaling pathway[J]. Toxicol Appl Pharmacol, 2013, 272(3): 591-597. DOI:10.1016/j.taap.2013.07.018 |



