黄原胶(Xanthan gum)是经发酵生产的一种微生物胞外杂多糖,其结构由重复的五糖单元组成,主链为D-葡萄糖以β-1, 4-糖苷键连接而成,侧链由α-甘露糖、β-葡糖醛酸和β-甘露糖组成的三糖单位构成(图 1)。黄原胶是大分子多糖,具有很高的相对分子质量(relative molecular weight, Mr),其Mr分布范围为2×106~20×106,该分布范围取决于几个单链之间的相互作用、单链之间聚合体的形成以及发酵条件的变化[1]。黄原胶是目前生产规模最大的微生物多糖,在石油、日化、食品和制药等领域获得了广泛的应用[2]。

|
图 1 黄原胶的结构 |
在医药领域中,黄原胶主要用作药用辅料。近年来,随着黄原胶注射用原料药制备工艺及其质量标准的建立,黄原胶在生物医药领域的应用展现出较大潜力,具备进一步开发利用的价值。
黄原胶作为一种天然多糖化合物,具有较好的生物相容性和可生物降解性。近年来,黄原胶用作组织工程支架材料引起了人们的极大兴趣,其在组织工程领域展现出较大的应用价值[1]。研究表明,以黄原胶为基础制备的水凝胶能够促进成纤维细胞、异体脂肪干细胞的增殖和胚胎干细胞的分化,为细胞提供了一个适宜生长、增殖的三维微环境,有利于新生组织的形成[3-4]。以黄原胶(1%)作为异体脂肪干细胞移植的载体,通过关节腔注射给药,用于治疗实验性大鼠骨关节炎的研究表明,黄原胶—异体脂肪干细胞联用组能够有效减缓骨关节炎的病理进程,其治疗效果明显优于单独注射黄原胶或异体脂肪干细胞的治疗组[5]。此外,为了提高支架材料的硬度和机械稳定性,研究者们通过将黄原胶与其他生物大分子相互作用[6],或者对黄原胶分子上的羟基、羧基进行化学功能化改性、修饰[7],来改变或优化其理化性能和生物学特性,以便满足不同使用环境的需要。
近年来,黄原胶在实验性骨关节炎的治疗方面所取得的成绩也受到了人们的广泛关注。研究表明,黄原胶(Mr:3×106~5×106)在体内能够抑制木瓜蛋白酶诱导的兔骨关节炎模型关节软骨的降解,降低软骨细胞的凋亡率,同时还可以下调关节滑液中肿瘤坏死因子α(tumour necrosis factor α, TNF-α)、一氧化氮(NO)和前列腺素E2(prostaglandin E2, PGE2)的表达,下调关节软骨中基质金属蛋白酶1、3的表达,上调关节软骨中组织型基质金属蛋白酶抑制剂-1的表达[8]。黄原胶在体外还可抑制硝普钠诱导的兔软骨细胞凋亡,维持软骨细胞表型并稳定线粒体膜电位[9]。近期研究发现,低Mr黄原胶(Mr:1×106~1.5×106)对骨关节炎关节软骨亦具有保护作用,其作用机制可能是通过下调半胱氨酸天冬氨酸蛋白酶3(caspase-3)和bax蛋白的表达,上调bcl-2蛋白表达引起的[10-11]。这些结果表明,关节腔内注射黄原胶能够保护软骨,抑制实验性骨关节炎的病理进程,缓解炎症,减轻疼痛,促进软骨自我修复并调节软骨和软骨细胞相关蛋白的表达。黄原胶有望成为一种治疗骨关节炎的优秀候选药物。
2 黄原胶的免疫调节作用多糖类化合物具有广泛的生物活性,可作为广谱的免疫促进剂,激活巨噬细胞、B淋巴细胞、T淋巴细胞、自然杀伤细胞等免疫细胞,促进细胞因子生成、活化补体,提高机体的免疫功能,从而在抗肿瘤、抗病毒及抗衰老等方面具有独特的功效[12-13]。有些多糖已被应用于机体的免疫调节及癌症化疗的辅助治疗,如香菇多糖、黄芪多糖等[14]。
早期研究发现,黄原胶能显著促进体外培养的小鼠脾B细胞和胸腺细胞DNA的合成,诱导B细胞的成熟和增殖,促进成熟的B细胞分泌多克隆抗体IgM和IgG,其作用效果与脂多糖(lipopolysaccharide, LPS)类似[15]。
研究发现,黄原胶具有免疫佐剂的功能。Schuch等[16]研究了皮下注射卵白蛋白(ovalbumin, OVA)和黄原胶诱导小鼠产生的免疫反应,结果表明,与OVA单独免疫,OVA联合铝佐剂免疫相比,用OVA联合黄原胶免疫时,小鼠体内IgG1抗体的水平及脾细胞产生的干扰素γ(interferon-γ, IFN-γ)的水平均显著增加。Bacelo等[17]以重组钩端螺旋体免疫球蛋白样(leptospiral immunoglobulin-like)蛋白为抗原,以黄原胶为佐剂制备了钩端螺旋体亚单位疫苗,发现黄原胶能够显著增强该疫苗的免疫原性,其免疫佐剂作用优于铝佐剂。佐剂长期以来被用于疫苗的制备,但目前只有铝佐剂可用于人疫苗佐剂。以纯化的重组蛋白质、合成肽等物质为基础的疫苗其免疫原性通常较弱,佐剂对于增强该类疫苗的免疫原性至关重要。多糖类化合物因其良好的体内生物相容性和耐受性,被认为是最有希望获准用于人用疫苗佐剂的一类物质,已成为疫苗佐剂研究的一个热点[18-19]。
此外,黄原胶还具有抗肿瘤作用[20]。经黄原胶灌胃处理的荷黑色素瘤小鼠体内肿瘤生长受到显著抑制。体内实验表明,黄原胶对Toll样受体4(Toll-like receptor 4, TLR4)缺陷型小鼠(C3H/HeJ)体内肿瘤的生长没有抑制作用,黄原胶的抗肿瘤作用依赖TLR4。体外实验表明,黄原胶作用于TLR4,通过髓样分化因子88(myeloid differentiation factor 88, MyD88)依赖性信号途径介导下游的信号转导,诱导巨噬细胞产生高水平的TNF-α和白介素(interleukin, IL)12等细胞因子。这说明黄原胶主要通过提高机体的免疫功能发挥其抗肿瘤活性。
近期研究表明,对于未经LPS活化的小鼠RAW264.7巨噬细胞,黄原胶(Mr:3×106)不影响细胞的增殖及活化,不会导致NO的生成,但能够剂量依赖性增强巨噬细胞对异硫氰酸荧光素-葡聚糖(FITC-dextran)的吞噬功能,具有免疫刺激作用。而对于LPS活化的RAW264.7细胞,黄原胶(1~100 μg/ml)能够剂量依赖性下调LPS活化的巨噬细胞炎症因子NO、IL-6和TNF-α的表达;抑制IL-6、IL-1β、TNF-α、诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)和环氧合酶-2(cyclooxygenase-2, COX-2)mRNA的表达及iNOS和COX-2蛋白的表达。说明黄原胶能够降低LPS诱导的RAW264.7细胞活化,表现出较强的抗炎活性[21]。
3 黄原胶免疫调节作用的分子机制为了明确黄原胶的作用靶点及其胞内信号传导机制,刘福艳等[21-22]采用表面等离子体共振技术(surface plasmon resonance, SPR)分析了黄原胶与常见的多糖胞外受体TLR2、TLR4以及C型凝集素受体家族成员Dectin-1的亲和力。发现TLR4与黄原胶的亲和力较强,远高于TLR4与LPS的亲和力,而Dectin-1和TLR2与黄原胶的亲和力极弱,进一步确证了TLR4是介导黄原胶免疫作用的受体。
TLR4是一个重要的多糖受体,在多糖诱导的巨噬细胞、淋巴细胞等的免疫应答中发挥重要作用,可作为一个潜在的药物靶点,用于癌症、风湿性关节炎、败血症、过敏性哮喘等的治疗[23-25]。TLR4通常以TLR4/髓样分化蛋白-2(myeloid differentiation protein, MD-2)复合物形式存在,是细胞表面与CD14相关的受体。TLR4信号通路分为MyD88依赖性和非依赖性通路两种。MyD88依赖性通路需要接头分子MyD88适配器样蛋白(MAL),帮助MyD88和IL-1受体相关激酶(IRAK)相互作用,进而募集肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6, TRAF6)。TRAF6作用于下游的效应分子,最终导致核因子κB(nuclear factor, NF-κB),或丝裂原激活的蛋白激酶(mitogen-activated protein kinase, MAPK)家族如p38、c-Jun氨基端激酶(JNK)等的活化,诱导TNF及其他促炎症因子的产生。在MyD88非依赖性通路中,诱导β干扰素的含Toll/IL-1受体同源区结构域的衔接蛋白(TRIF)在TRIF相关接头分子(TRAM)的协助下介导下游的信号转导,诱导IFN的表达[26-27]。见图 2。
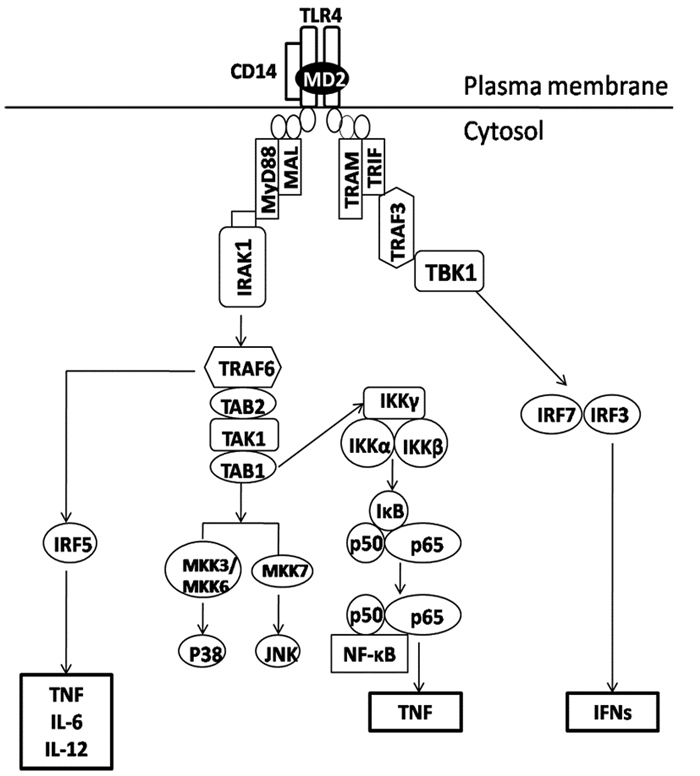
|
图 2 TLR4信号通路 注:TAK1,β转化生长因子激活的蛋白激酶1;TAB,TAK1结合蛋白;IKKs,NF-κB抑制蛋白激酶;IκB,NF-κB抑制剂;MKK,MAPK激酶;TBK1,TRAF family member-associated NF-κB activator-binding kinase 1;IRF,干扰素调节因子 |
TLR4是LPS的识别受体,LPS通过与CD14相互作用,共同锚定于TLR4/MD-2构成的受体复合物,激活TLR4信号通路,导致下游MAPK的磷酸化和NF-κB的活化。研究结果表明,尽管都是通过TLR4产生生物活性,但黄原胶与LPS不同,能直接识别并结合TLR4而不需要相关蛋白的辅助。黄原胶能够下调LPS活化的巨噬细胞炎症因子的生成量,抑制TLR4通路下游MAPK的磷酸化和NF-κB的活化,其作用可能是通过与LPS竞争性结合细胞膜上的TLR4,阻断LPS-TLR4信号通路,从而发挥其抗炎的作用[22]。
现有研究表明黄原胶表现出一定的免疫原性,可用作免疫佐剂,能上调淋巴细胞、巨噬细胞等免疫细胞相应抗体和细胞因子的表达;另一方面,黄原胶能够下调LPS活化的巨噬细胞炎症因子的表达,同时可以抑制TLR4通路中的相关蛋白,具有抗炎活性。这提示我们黄原胶可能具有双向免疫调控作用,为其在免疫调节类药物中的应用提供了理论支持。
4 黄原胶的结构与免疫调节作用的关系目前已发现超过30种活性多糖是通过直接或间接地与TLR4相互作用从而发挥免疫作用。多糖的结构,包括单糖组成、糖苷键的类型、分支度、聚合度以及整体的分子构象,都会影响多糖活性,尽管影响因素较多,但也有一些共同的规律。研究发现,与TLR4相关的同多糖主要包括葡聚糖、乳聚糖、甘露聚糖、果聚糖和聚唾液酸。其中,葡聚糖尤其是β-葡聚糖表现出显著的生物活性,受到广泛关注。单糖组分分析表明,葡萄糖、半乳糖和甘露糖在所有TLR4相关的多糖中出现频率最高。与TLR4相关的杂多糖分子中,葡萄糖(包括葡糖醛酸)、半乳糖(包括半乳糖醛酸)、果糖和甘露糖至少出现一次,并且大多数是成对出现,意味着以上这些单糖分子是TLR4相关活性多糖的关键“药效基团”。此外,TLR4相关活性多糖的连接方式主要包括α-1, 3-,α-1, 4-,β-1, 3-和β-1, 4-糖苷键[23]。
黄原胶含有以β-1, 4-糖苷键连接的葡聚糖主链,以及以α-甘露糖、β-葡糖醛酸和β-甘露糖连接而成侧链,这种结构及单糖组分符合文献报道的TLR4相关活性多糖的基本特征,其分子结构中的葡聚糖、葡糖醛酸和甘露糖可能是其生物学活性的必需基团,是其发挥免疫调节作用的结构基础。
目前的研究已经证明,多糖的活性与其Mr密切相关,Mr太小或太大的多糖通常没有活性,合适的分子聚合度是多糖发挥免疫调节活性的关键[23, 28]。文献中用于治疗实验性骨关节炎的具有药理活性的黄原胶Mr范围为1×106~5×106[8-11]。目前尚缺乏黄原胶Mr与其免疫佐剂活性及抗炎活性之间的相关性研究,也并不清楚不同Mr黄原胶与TLR4的亲和力是否不同,其免疫调节作用否有差异,有待进一步研究。黄原胶的结构特征、免疫调节作用及分子作用机制的研究结果见表 1。
| 表 1 黄原胶的结构、免疫调节作用及分子作用机制 |
现有研究表明黄原胶具有调节机体免疫功能的作用,在新型免疫调节类药物的研发方面具有潜力。黄原胶已被证明对TLR4具有高亲和力,是一种TLR4相关活性多糖。几乎所有的免疫细胞都表达TLR4,包括单核细胞/巨噬细胞,树突状细胞,B淋巴细胞,T淋巴细胞,粒细胞以及自然杀伤细胞等。目前只有少数免疫细胞被识别为TLR4相关多糖的靶细胞(例如树突状细胞和巨噬细胞)[23]。黄原胶能够通过TLR4信号通路诱导巨噬细胞的免疫应答,但其对其他免疫细胞如T淋巴细胞等是否具有靶向的能力目前尚不清楚。进一步探讨黄原胶对其他免疫细胞的影响,明确其诱导免疫作用的量效关系,探明作用机制,将为黄原胶开发成免疫佐剂或免疫调节类药物奠定理论基础,并可为其他多糖类药物的研发提供思路。
| [1] |
Kumar A, Rao KM, Han SS. Application of xanthan gum as polysaccharide in tissue engineering:a review[J]. Carbohydr Polym, 2018, 180: 128-144. DOI:10.1016/j.carbpol.2017.10.009 |
| [2] |
Wang ZC, Wu JR, Zhu L, et al. Activation of glycerol metabolism in Xanthomonas campestris by adaptive evolution to produce a high-transparency and low-viscosity xanthan gum from glycerol[J]. Bioresour Technol, 2016, 211: 390-397. DOI:10.1016/j.biortech.2016.03.096 |
| [3] |
Sharma PK, Taneja S, Singh Y. Hydrazone-linkage-based self-healing and injectable xanthan-poly(ethylene glycol) hydrogels for controlled drug release and 3D cell culture[J]. ACS Appl Mater Interfaces, 2018, 10(37): 30936-30945. DOI:10.1021/acsami.8b07310 |
| [4] |
Westin CB, Trinca RB, Zuliani C, et al. Differentiation of dental pulp stem cells into chondrocytes upon culture on porous chitosan-xanthan scaffolds in the presence of kartogenin[J]. Mater Sci Eng C Mater Biol Appl, 2017, 80: 594-602. DOI:10.1016/j.msec.2017.07.005 |
| [5] |
Mei L, Shen BJ, Xue JJ, et al. Adipose tissue-derived stem cells in combination with xanthan gum attenuate osteoarthritis progression in an experimental rat model[J]. Biochem Biophys Res Commun, 2017, 494(1/2): 285-291. DOI:10.1016/j.bbrc.2017.10.039 |
| [6] |
Sehgal RR, Roohani-Esfahani SI, Zreiqat H, et al. Nanostructured gellan and xanthan hydrogel depot integrated within a baghdadite scaffold augments bone regeneration[J]. J Tissue Eng Regen Med, 2017, 11(4): 1195-1211. DOI:10.1002/term.2023 |
| [7] |
Laffleur F, Michalek M. Modified xanthan gum for buccal delivery-A promising approach in treating sialorrhea[J]. Int J Biol Macromol, 2017, 102: 1250-1256. DOI:10.1016/j.ijbiomac.2017.04.123 |
| [8] |
Chen QX, Shao XT, Ling PX, et al. Recent advances in polysaccharides for osteoarthritis therapy[J]. Eur J Med Chem, 2017, 139: 926-935. DOI:10.1016/j.ejmech.2017.08.048 |
| [9] |
Chen QX, Mei XF, Han GY, et al. Xanthan gum protects rabbit articular chondrocytes against sodium nitroprusside-induced apoptosis in vitro[J]. Carbohydr Polym, 2015, 131: 363-369. DOI:10.1016/j.carbpol.2015.06.004 |
| [10] |
Han GY, Chen QX, Liu F, et al. Low molecular weight xanthan gum for treating osteoarthritis[J]. Carbohydr Polym, 2017, 164: 386-395. DOI:10.1016/j.carbpol.2017.01.101 |
| [11] |
Chen QX, Shao XT, Ling PX, et al. Low molecular weight xanthan gum suppresses oxidative stress-induced apoptosis in rabbit chondrocytes[J]. Carbohydr Polym, 2017, 169: 255-263. DOI:10.1016/j.carbpol.2017.04.018 |
| [12] |
Sun LN, Middleton DR, Wantuch PL, et al. Carbohydrates as T-cell antigens with implications in health and disease[J]. Glycobiology, 2016, 26(10): 1029-1040. DOI:10.1093/glycob/cww062 |
| [13] |
Usoltseva RV, Shevchenko NM, Malyarenko OS, et al. Structure and anticancer activity of native and modified polysaccharides from Brown alga Dictyota dichotoma[J]. Carbohydr Polym, 2018, 180: 21-28. DOI:10.1016/j.carbpol.2017.10.006 |
| [14] |
Zong AZ, Cao HZ, Wang FS. Anticancer polysaccharides from natural resources:a review of recent research[J]. Carbohydr Polym, 2012, 90(4): 1395-1410. DOI:10.1016/j.carbpol.2012.07.026 |
| [15] |
Ishizaka S, Sugawara I, Hasuma T, et al. Immune responses to xanthan gum.I.The characteristics of lymphocyte activation by xanthan gum[J]. Eur J Immunol, 1983, 13(3): 225-231. DOI:10.1002/eji.1830130309 |
| [16] |
Schuch RA, Oliveira TL, Collares TF, et al. The use of xanthan gum as vaccine adjuvant:an evaluation of immunostimulatory potential in BALB/c mice and cytotoxicity in vitro[J]. Biomed Res Int, 2017, 2017: 3925024. DOI:10.1155/2017/3925024 |
| [17] |
Bacelo KL, Hartwig DD, Seixas FK, et al. Xanthan gum as an adjuvant in a subunit vaccine preparation against leptospirosis[J]. Biomed Res Int, 2014, 2014: 636491. DOI:10.1155/2014/636491 |
| [18] |
Sacre K, Goulenok T, Bahuaud M, et al. Impaired long-term immune protection following pneumococcal 13-valent/23-valent polysaccharide vaccine in systemic lupus erythematosus (SLE)[J]. Ann Rheum Dis, 2018, 77(10): 1540-1542. DOI:10.1136/annrheumdis-2017-212789 |
| [19] |
O'Connor D, Clutterbuck EA, Thompson AJ, et al. High-dimensional assessment of B-cell responses to quadrivalent meningococcal conjugate and plain polysaccharide vaccine[J]. Genome Med, 2017, 9(1): 11. DOI:10.1186/s13073-017-0400-x |
| [20] |
Takeuchi A, Kamiryou Y, Yamada H, et al. Oral administration of xanthan gum enhances antitumor activity through Toll-like receptor 4[J]. Int Immunopharmacol, 2009, 9(13/14): 1562-1567. DOI:10.1016/j.intimp.2009.09.012 |
| [21] |
Liu FY, Zhang XF, Ling PX, et al. Immunomodulatory effects of xanthan gum in LPS-stimulated RAW 264.7 macrophages[J]. Carbohydr Polym, 2017, 169: 65-74. DOI:10.1016/j.carbpol.2017.04.003 |
| [22] |
刘福艳.两种多糖XG和MP-A作用于细胞表面受体Toll-like receptor 4(TLR4)的免疫药理学效应及胞内信号传导分子机制研究[D].济南: 山东大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10422-1017267722.htm
|
| [23] |
Zhang XR, Qi CH, Guo Y, et al. Toll-like receptor 4-related immunostimulatory polysaccharides:Primary structure, activity relationships, and possible interaction models[J]. Carbohydr Polym, 2016, 149: 186-206. DOI:10.1016/j.carbpol.2016.04.097 |
| [24] |
高丽娜. Toll样受体4介导的巨噬细胞泡沫化与动脉粥样硬化[J]. 济宁医学院学报, 2018, 41(3): 153-157. DOI:10.3969/j.issn.1000-9760.2018.03.001 |
| [25] |
Fuster JJ. TLR4 in atherogenesis:paying the toll for antimicrobial Defense[J]. J Am Coll Cardiol, 2018, 71(14): 1571-1573. DOI:10.1016/j.jacc.2018.02.014 |
| [26] |
Li J, Wang XH, Zhang FC, et al. Toll-like receptors as therapeutic targets for autoimmune connective tissue diseases[J]. Pharmacol Ther, 2013, 138(3): 441-451. DOI:10.1016/j.pharmthera.2013.03.003 |
| [27] |
Araldi E, Fernández-Fuertes M, Canfrán-Duque A, et al. Lanosterol modulates TLR4-mediated innate immune responses in macrophages[J]. Cell Rep, 2017, 19(13): 2743-2755. DOI:10.1016/j.celrep.2017.05.093 |
| [28] |
Zhang Q, Xu Y, Lv J, et al. Structure characterization of two functional polysaccharides from Polygonum multiflorum and its immunomodulatory[J]. Int J Biol Macromol, 2018, 113: 195-204. DOI:10.1016/j.ijbiomac.2018.02.064 |



