2. 济宁医学院附属医院, 济宁 272029
2. Affiliated Hospital of Jining Medical University, Jining 272029, China
周围神经病是一组临床常见的、由多种原因引发的周围神经损伤的疾病统称。布洛芬是临床常用的一种非甾体抗炎药,它可以通过抑制环氧化酶的生成、减少前列腺素的合成而发挥作用。研究表明,布洛芬可以通过影响Ras同源基因家族(Ras homolog gene family member, Rho)成员-RhoA及其下游的Rho激酶(Rho kinase, ROCK)而促进神经再生[1]。然而,RhoA/ROCK均处于细胞信号通路的末端,布洛芬通过调控何种信号分子而影响RhoA/ROCK,目前尚不清楚。有研究证明RhoA/ROCK通过调控丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路在神经元的存活和和生长过程中发挥了重要的作用[2]。本文通过观察布洛芬对小鼠原代脊髓前角运动神经元MAPK表达的影响,旨在探讨布洛芬促神经元轴索生长的分子机制,为其下一步在周围神经病临床治疗中的应用提供依据。
1 材料与方法 1.1 材料 1.1.1 实验动物8~10周龄C57BL/6小鼠(济南朋悦实验动物公司),雄鼠10只,雌鼠30只,SPF级饲养。动物实验符合动物伦理学要求。
1.1.2 试剂Hibernate-E(美国Gibco公司)、胎牛血清(美国Gibco公司)、DMEM/F-12培养基(美国Gibco公司)、NABG培养基(美国Gibco公司)、OptiPrep分离液(美国Sigma公司)、布洛芬(美国Sigma公司)、神经生长因子(美国Sigma公司)、抗小鼠ChAT(美国Abcam公司)、Alexa Fluor 488标记驴抗兔二抗(美国Abcam公司)、RNA提取试剂盒(北京天根生化科技有限公司)、All-in-One cDNA第一链合成试剂盒(广州复能基因)、RIPA裂解液(江苏碧云天生物技术研究所)、ROCK活性测定试剂盒(美国Cell Biolabs公司)。
1.2 方法 1.2.1 运动神经元的分离及干预分离小鼠脊髓前角运动神经元[3],具体如下:将C57BL/6小鼠按雄雌1:2比例合笼,于次日检查雌鼠阴道见有阴栓者记为E0d。取E13.5d的孕鼠,用CO2麻醉后颈椎脱臼处死,于70%酒精中快速浸泡30s后置于100mm无菌培养皿中,加入D-PBS后分离胎鼠脊髓,将分离好的脊髓转移到含有0.5ml预冷的Hibernate-E的60mm无菌培养皿中,剪碎后加入37℃预热的0.25%胰蛋白酶-EDTA溶液,于37℃细胞培养箱中消化25min,期间每5min轻柔吹打一次,以含2%胎牛血清的DMEM/F-12培养基终止消化。于4℃水平离心机中1000r离心5min,以4ml NABG培养基重悬沉淀。于15ml离心管分别加入OptiPrep分离液和DMEM/F-12培养基(OptiPrep分离液的终浓度为12.4%,v/v),将重悬后的细胞缓慢加入上述混合分离液中,于4℃水平离心机中2200r离心10min,吸取中间云雾层,1000r离心5min,所得沉淀即为运动神经元,加入适量的NABG培养基重新悬浮细胞。将运动神经元按1×104的密度接种于多聚赖氨酸包被的24孔板中,随机分组如下:布洛芬组、神经生长因子(nerve growth factor, NGF)组和对照组(无处理),布洛芬的浓度为400μmol/L,NGF浓度为100ng/ml。每组均设6个复孔,培养48h后进行后续检测。
1.2.2 轴索生长测定将培养完毕的运动神经元加入4%的多聚甲醛固定10min,以PBS洗涤一次后加入0.3%曲拉通(0.1M PBS配制)室温下破膜5min,PBS洗涤3次×5min,以10%的山羊血清(0.1M PBS配制)室温下封闭1h,加入PBS稀释的兔抗小鼠ChAT(1:500)于4℃中过夜孵育,PBS洗涤3次×5min,然后加入PBS稀释的Alexa Fluor 488标记驴抗兔二抗(1:1000)在室温下孵育1h,以PBS洗涤3次×5 min,加入PBS稀释的DAPI(1:25)染细胞核10min,PBS洗1次×5min后,封片后于倒置荧光显微镜中拍照。随机选取20个视野,用Image-Pro Plus 6.0软件测量视野中每个运动神经元的轴突长度,神经元轴突的实际长度是从轴突起始部到生长锥末端的距离。每组均测量200个运动神经元。实验重复3次。
1.2.3 荧光定量PCR将培养完毕的运动神经元以RNA提取试剂盒提取总RNA,以All-in-OneTM cDNA第一链合成试剂盒合成cDNA,于ABI7500荧光定量PCR进行扩增反应。PCR反应引物由上海生工生物工程股份有限公司合成,具体序列参照Huang等[4]如下:ERK上游引物5’-cgcttcagacatgagaacatc-3’,下游引物5’-ggtccgtctccatgaggt-3’;JNK上游引物5’-tcccagctgactcagagcat-3’,下游引物5’-gcttcatctacggagatcctt-3’;p38上游引物5’-cccagcaacctagctgtg-3’,下游引物5’-gctcggtaccacctggtag-3’;内参GAPDH上游引物5’-cgaccactttgtcaagctca-3’,下游引物5’-aggggtctacatggcaactg-3’。20μl的反应体系如下:SYBR MIX 10μl、无酶去离子水5.6μl、上下游引物各1μl、cDNA模版2μl、ROX 0.4μl。反应条件如下:95℃预变性10min,95℃变性10min,60℃退火20min,72℃延伸10min,共反应40个循环。结果采用2-ΔΔCt进行分析(ΔΔCt=干预组目的基因Ct与内参Ct之差-对照组目的基因与内参Ct之差)。实验重复3次。
1.2.4 ROCK活性测定在培养完毕的运动神经元中加入含蛋白酶抑制剂的RIPA裂解液,冰上孵育20min后,以ROCK活性测定试剂盒检测不同处理组中神经元的ROCK活性。参照说明书进行操作,于450nm波长处测定OD值。
1.3 统计学方法计量资料以x±s表示,以Graphpad Prism 6.0软件进行数据分析及作图,多组间比较采用方差分析,进一步两两比较采用Dunnet-t检验。以P<0.05为有统计学意义。
2 结果 2.1 布洛芬对运动神经元轴索生长的影响培养48h后,布洛芬组的运动神经元轴索长度[(89.1±10.7)μm]显著大于对照组[(66.5±8.4)μm],差异有统计学意义(P<0.05);与NGF组[(86.0±11.8)μm]相比,差异无统计学意义(P=0.732)。见图 1。
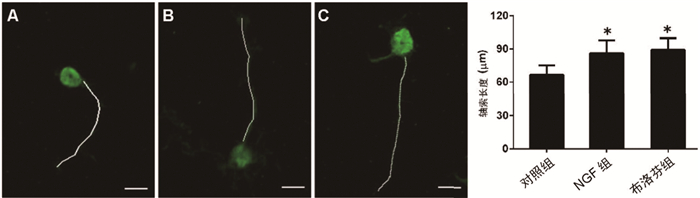
|
图 1 布洛芬对运动神经元轴索生长的影响 注:A.对照组;B.NGF组;C.布洛芬组;Bar=10μm。图中白线标记为运动神经元轴索。与对照组相比,*P<0.05;与NGF组相比,#P>0.05 |
对照组运动神经元的ROCK活性显著高于布洛芬组和NGF组(均P<0.05);布洛芬组ROCK活性与NGF组相比差异无统计学意义(P=0.564)。见图 2。
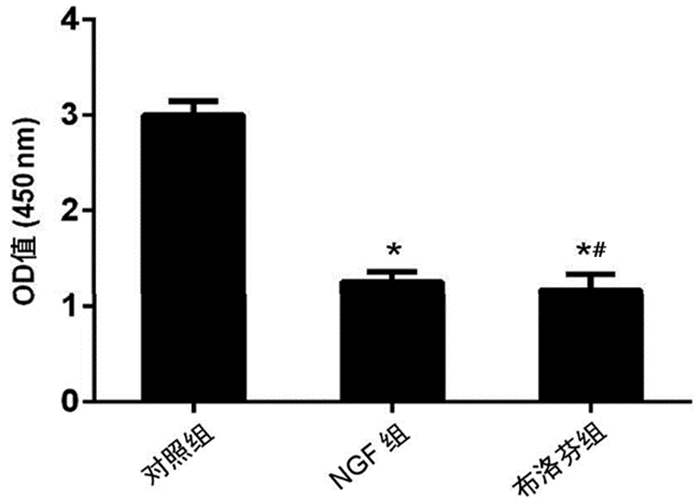
|
图 2 布洛芬对小鼠运动神经元中ROCK活性的影响 注:与对照组相比,*P<0.05;与NGF组相比,#P>0.05 |
布洛芬组运动神经元中JNK mRNA的相对表达量显著高于NGF组和对照组(均P<0.05),NGF组与对照组的JNK mRNA相对表达量无差异(P=0.975)。3组间p38和ERK的相对表达量均无显著性差异(均P>0.05)。见图 3。
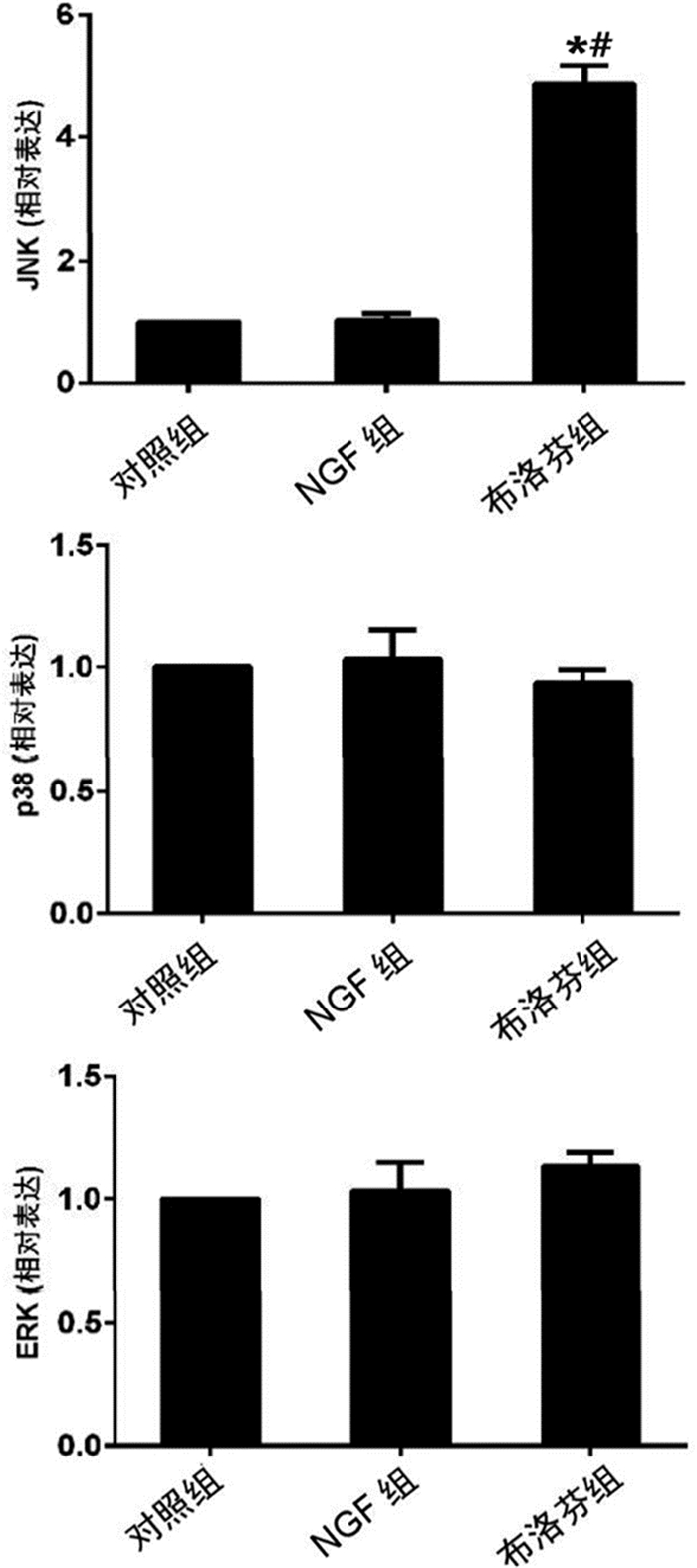
|
图 3 布洛芬对MAPK信号分子(ERK、p38、JNK)mRNA表达的影响 注:与对照组、NGF组相比,*P<0.05;与NGF组相比,#P<0.05 |
周围神经损伤后,其相应的神经元胞体会启动一系列信号通路并最终借助其远端的生长锥完成轴索再生的过程[5],但这一过程缓慢而且易受外部因素的影响;此外,严重的轴索损伤可引发神经元胞体的继发性损伤或凋亡[1]。因此,探讨神经元轴索生长或再生的分子机制、开发有效的治疗策略,对于周围神经病的临床治疗具有重要的意义。
Rho家族成员是调控生长锥收缩/伸展反应的关键性下游分子[6]。Rho家族属于小G蛋白分子,该家族成员共包括3种:RhoA、Rac1和Cdc42,其中Rac1和Cdc42能够通过调节肌动蛋白促进轴索生长锥的生长和稳定,而RhoA及其下游的ROCK可刺激肌动球蛋白收缩和应力纤维的形成,引起轴索生长锥的塌陷和回缩[7]。目前已发现的多种内源性轴索生长抑制因子如髓磷脂相关糖蛋白和少突胶质细胞髓鞘糖蛋白等均与RhoA/ROCK信号通路有关[8]。Fu等[9]利用脊髓损伤模型首次发现,布洛芬可以通过抑制RhoA/ROCK级联通路而促进脊髓(中枢神经)损伤后的神经再生。Madura等[10]证明布洛芬也可以通过抑制RhoA的生成而促进坐骨神经损伤(周围神经)后的神经再生。以往研究布洛芬对神经再生的影响大多是采用细胞株,如SH-SY5Y成神经细胞瘤细胞株[11-12]。本研究中,我们首次利用原代培养的小鼠脊髓前角运动神经元探讨布洛芬调控神经元轴索生长的分子机制。与以往的研究发现一致,布洛芬可显著促进小鼠运动神经元的轴索生长,其促进作用与NGF相比无显著性差异。以往的体内研究证明,布洛芬是通过RhoA/ROCK信号通路影响中枢或周围神经的再生。本研究中,布洛芬促进体外培养的运动神经元轴索生长也是通过抑制ROCK的活性来发挥作用。我们发现,NGF处理组ROCK活性与布洛芬处理组无显著性差异,并显著低于对照组,这提示NGF也是通过抑制ROCK来发挥其对运动神经元轴索生长的调控作用。上述结果进一步证实了ROCK在轴索生长过程中关键性负性调控作用。
MAPKs是一组真核生物中非常保守的丝/苏氨酸蛋白激酶,主要包括细胞外信号调节激酶(extracellular signal regulated kinase,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinases,JNK)和p38。MAPK是多种细胞活动传递的枢纽,参与调控细胞增殖、分化等。Fukushima等[13]和Zhou等[14]分别利用肝星状细胞和心肌细胞证明Rho/ROCK信号通路通过调控MAPKs信号通路参与细胞代谢活动。但神经再生过程是否亦通过以上通路调控目前尚未有报道。本文结果显示,布洛芬可显著上调运动神经元中JNK mRNA的相对表达,而对p38和ERK的mRNA表达无影响,提示布洛芬可能通过上调JNK的表达而促进神经元的轴索生长。我们的结果与以往的研究发现,即ERK在神经元轴索生长过程中发挥重要的作用不一致;此外,尽管布洛芬和NGF均显著抑制运动神经元中的ROCK活性,我们未发现NGF对MAPK信号分子的mRNA表达产生影响。我们推测不同的促轴索生长因子/药物可能通过启动不同的信号通路来调控神经元的轴索生长。值得注意的是,本研究中我们仅对MAPK信号分子进行了mRNA水平的检测,其原因在于原代脊髓前角运动神经元的分离较一般的神经元更为困难,一次难以获得足够的数量进行蛋白水平的检测,本研究结果还需要基于蛋白水平的技术验证。此外,借助于先进的蛋白质组学技术可更为全面的、深入的阐明布洛芬调控神经元轴索生长的具体机制。
综上所述,我们发现证明布洛芬可通过上调JNK的表达而促进小鼠运动神经元的轴索生长。由于布洛芬是已经在临床广泛应用的药物,在进一步评估布洛芬促轴索再生的疗效及潜在的毒副作用后,有必要开展利用布洛芬治疗周围神经病的临床药物试验。
| [1] |
Chan KM, Gordon T, Zochodne DW, et al. Improving peripheral nerve regeneration:from molecular mechanisms to potential therapeutic targets[J]. Exp Neurol, 2014, 261: 826-835. DOI:10.1016/j.expneurol.2014.09.006 |
| [2] |
Kaplan DR, Miller FD. Neurotrophin signal transduction in the nervous system[J]. Curr Opin Neurobiol, 2000, 10(3): 381-391. DOI:10.1016/S0959-4388(00)00092-1 |
| [3] |
Wang W, Qi B, Lv H, et al. A new method of isolating spinal motor neurons from fetal mouse[J]. J Neurosci Methods, 2017, 288: 57-61. DOI:10.1016/j.jneumeth.2017.06.014 |
| [4] |
Huang T, Xiao Y, Yi L, et al. Coptisine from rhizoma coptidis suppresses HCT-116 cells-related tumor growth in vitro and in vivo[J]. Sci Rep, 2017, 7: 38524. DOI:10.1038/srep38524 |
| [5] |
Abankwa D, Kury P, Muller HW. Dynamic changes in gene expression profiles following axotomy of projection fibres in the mammalian CNS[J]. Mol Cell Neurosci, 2002, 21(3): 421-435. DOI:10.1006/mcne.2002.1183 |
| [6] |
Hall A, Lalli G. Rho and Ras GTPases in axon growth, guidance, and branching[J]. Cold Spring Harb Perspect Biol, 2010, 2(2): a1818. DOI:10.1101/cshperspect.a001818 |
| [7] |
Dickson BJ. Rho GTPases in growth cone guidance[J]. Curr Opin Neurobiol, 2001, 11(1): 103-110. DOI:10.1016/S0959-4388(00)00180-X |
| [8] |
Tan HB, Zhong YS, Cheng Y, et al. Rho/ROCK pathway and neural regeneration:a potential therapeutic target for central nervous system and optic nerve damage[J]. Int J Ophthalmol, 2011, 4(6): 652-657. DOI:10.3980/j.issn.2222-3959.2011.06.16 |
| [9] |
Fu Q, Hue J, Li S. Nonsteroidal anti-inflammatory drugs promote axon regeneration via RhoA inhibition[J]. J Neurosci, 2007, 27(15): 4154-4164. DOI:10.1523/JNEUROSCI.4353-06.2007 |
| [10] |
Madura T, Tomita K, Terenghi G. Ibuprofen improves functional outcome after axotomy and immediate repair in the peripheral nervous system[J]. J Plast Reconstr Aesthet Surg, 2011, 64(12): 1641-1646. DOI:10.1016/j.bjps.2011.07.014 |
| [11] |
Xing B, Li H, Wang H, et al. RhoA-inhibiting NSAIDs promote axonal myelination after spinal cord injury[J]. Exp Neurol, 2011, 231(2): 247-260. DOI:10.1016/j.expneurol.2011.06.018 |
| [12] |
Wang X, Budel S, Baughman K, et al. Ibuprofen enhances recovery from spinal cord injury by limiting tissue loss and stimulating axonal growth[J]. J Neurotrauma, 2009, 26(1): 81-95. DOI:10.1089/neu.2007.0464 |
| [13] |
Fukushima M, Nakamuta M, Kohjima M, et al. Fasudil hydrochloride hydrate, a Rho-kinase (ROCK) inhibitor, suppresses collagen production and enhances collagenase activity in hepatic stellate cells[J]. Liver Int, 2005, 25(4): 829-838. DOI:10.1111/j.1478-3231.2005.01142.x |
| [14] |
Zhou H, Li YJ, Wang M, et al. Involvement of RhoA/ROCK in myocardial fibrosis in a rat model of type 2 diabetes[J]. Acta Pharmacol Sin, 2011, 32(8): 999-1008. DOI:10.1038/aps.2011.54 |



