农业生产中,渗透胁迫是影响作物产量的一个重要环境因素,包括干旱胁迫和高盐胁迫。我国每年因干旱等自然灾害导致粮食减产达10%以上,而这个比例因温室效应加剧还在逐年增加[1]。因此,面对这些自然灾害,提高农业生产力,是我们亟待解决的科学问题。
DnaJ蛋白,是广泛存在于细胞内的一种分子伴侣,具有完成蛋白质折叠、解折叠、向特定细胞器运输和调节蛋白复合物解聚等功能[2]。据报道,DnaJ蛋白能参与细胞内多种生化过程和响应多种胁迫反应,进而增强植物的抗逆性[3]。大肠杆菌(Escherichia coli)是一种革兰氏阴性菌,是遗传学和生物化学研究常用的菌体。酵母作为一种真核生物,细胞对渗透压的反应是相对恒定的,比植物更易用于遗传研究。本研究中,我们首次从番茄叶片中分离克隆得到SlCDJ2基因,经过生物信息分析发现,SlCDJ2基因编码的蛋白属于DnaJ蛋白家族[4]。将SlCDJ2基因转入大肠杆菌和酵母中,与野生菌株相比,转基因大肠杆菌和酵母均提高了对渗透胁迫的抗性。报道如下。
1 材料与方法 1.1 材料实验菌株:大肠杆菌(Escherichia coli strain BL21)和酿酒酵母(Saccharomyces cerevisiae strain YPH500),由山东农业大学作物生物学国家重点实验室提供。
1.2 方法 1.2.1 SlCDJ2基因的克隆及测序在NCBI GEN EBANK数据库中查得SlCDJ2基因的mRNA序列(GenBank序列号:AK323942),设计特异引物(上游引物:ATGAGCAATTTGAGATCGAT;下游引物:CTATAGATTCTTATCGTCCTCCT),以番茄叶片的cDNA为模板,进行PCR扩增,程序为95℃预变性5min;95℃ 50s,55℃退火50s,72℃延伸1min,35个循环;72℃延伸10min。随后对PCR产物进行测序验证。
1.2.2 SlCDJ2基因在大肠杆菌中的表达设计特异性引物,上游引物:GGATCCATGAGCAATTTGAGATCGAT,下划线是BamH Ⅰ;下游引物:GAGCTCCTATAGATTCTTATCGTCCTCCT,下划线是Sac Ⅰ。将SlCDJ2基因的编码序列采用PCR技术扩增出来,利用酶切位点BamH Ⅰ和Sac I,进行双酶切反应,将该基因编码序列连接到原核表达载体pET30a上。然后,将重组质粒转化E.coli BL21,获得阳性菌株,再将野生菌株和阳性菌株分别在20ml LB液体培养基中培养(37℃,200rpm/min),当菌液OD600=0.6时,首先将野生菌液和转基因菌液各取1ml,置于4℃冰箱内备用,再向剩余菌液加入IPTG(Isopropylthio-β-d-galactoside),使其终浓度为1mM,持续培养6h,每隔1h,取样1次,将所有样品,经10000rpm/min,离心1min,倒掉上清,菌体沉淀备用。最后,经SDS-聚丙烯酰氨凝胶电泳(SDS-PAGE)将诱导表达的蛋白分离开来[5]。
1.2.3 大肠杆菌在渗透胁迫下的生长分析为了分析含空载pET30a和含有pET30a-SlCDJ2重组质粒的大肠杆菌在正常和盐胁迫下的生长情况,首先配制IPTG终浓度为1mM,NaCl终浓度分别为200mM、400mM和800mM的LB液体培养基,各100ml。然后,取100μl OD600=0.8的菌液分别加入以上LB液体培养基中,37℃,200rpm/min,持续培养28h。同样,为了分析含空载pET30a和含有pET30a-SlCDJ2重组质粒的大肠杆菌在干旱胁迫下的生长情况,首先配制IPTG终浓度为1mM,甘露醇(Mannitol)终浓度分别为200mM、400mM和800mM的LB液体培养基,各100ml。然后,取100μl OD600=0.8的菌液分别加入以上LB液体培养基中,37℃,200rpm/min,震荡培养28h。最后,使用分光光度计检测不同时间点的菌体OD600值。以上实验均进行3次生物学重复。
1.2.4 酵母表达载体的构建首先设计特异性引物,上游引物:GAGCTCATGAGCAATTTGAGAT CGAT,下划线是Sac Ⅰ;下游引物:GGATCCCTATAGATTCTTATCGTCCTCCT,下划线是BamH Ⅰ。采用PCR技术扩增SlCDJ2基因的编码序列。再利用Sac I和BamH Ⅰ内切酶将PCR产物和酵母表达载体pYES2进行双酶切反应,最终将SlCDJ2基因的编码序列连接到酵母表达载体pYES2上,构建重组质粒。
1.2.5 酵母遗传转化将酵母空载pYES2和pYES2-SlCDJ2重组质粒转入酵母(Saccharomyces cerevisiae strain YPH500)中。利用醋酸锂酵母转化系统获得了阳性酵母菌株[6]。
1.2.6 酵母在渗透胁迫下的生长分析S.cerevisiae strain YPH500在YPD(yeast extract/peptone/dextrose)培养基中培养,而含有重组质粒的酵母菌株在YNBUra-(yeast nitrogen extract,(NH4)2SO4,glucose,His/trp/leu/lys和Ademine)培养基中培养。为了分析含空载pYES2和pYES2-SlCDJ2重组质粒的酵母菌在正常和渗透迫下的生长情况,首先,分别配制NaCl和Mannitol终浓度为200mM、400mM和800mM的YNBUra-固体培养基。然后,挑取阳性菌株到10ml YNBUra-液体培养基(含终浓度2%的棉子糖)中,28℃,200rpm/min,震荡培养72h后,吸取1ml培养物到25ml YNBUra-液体培养基(含终浓度2%的半乳糖,1% NP-40)中,22℃,200rpm/min,继续震荡培养48h,直至菌液OD600=1.0。吸取100μl的菌液连续稀释10倍,稀释3次,将稀释后的菌液吸取10μl点在不同浓度NaCl和Mannitol的培养基上,28℃条件下,培养5d,拍照记录。
1.3 统计学方法所有数据结果均以x±s表示,在SPSS 18.0统计分析软件中利用t检验进行组间比较,P < 0.05,为差异有统计学意义。
2 结果与分析 2.1 SlCDJ2基因的克隆根据NCBI GenBank数据库中的mRNA序列(GenBank序列号:AK323942),设计特异引物,以番茄叶片总RNA反转录获得的cDNA为模板,进行PCR扩增,经过琼脂糖凝胶电泳分离到一条834 bp的DNA条带,与GenBank数据库中查得的大小一致(图 1),测序结果显示序列完全正确。这些结果说明,成功地克隆得到了SlCDJ2基因。SlCDJ2基因全长为1159bp,开放阅读框为834bp,第66个核苷酸处为起始密码子ATG,第898个核苷酸处为终止密码子TAG,开放阅读框编码277个氨基酸,预测分子量为32.7kDa,等电点为9.30(http://web.expasy.org/compute_pi/)。

|
图 1 SlCDJ2基因核酸凝胶电泳图 |
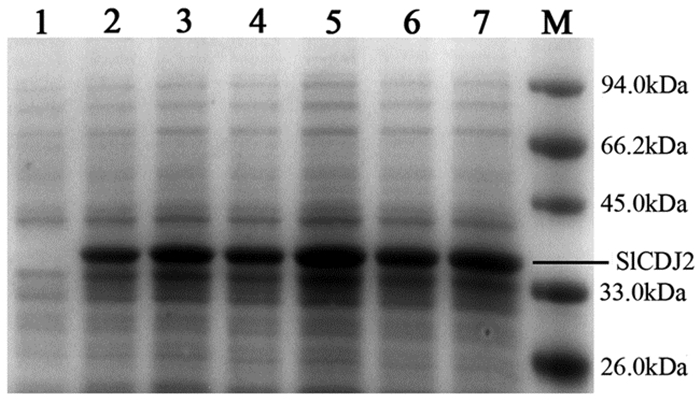
将转pET-SlCDJ2融合质粒的大肠杆菌阳性菌株,进行IPTG诱导6h后,将样品进行聚丙烯酰胺凝胶电泳,结果显示在大肠杆菌中有一条大约34kDa的带,诱导后的蛋白为连有组氨酸标签的融合蛋白(图 2)。这个结果说明SlCDJ2蛋白能在大肠杆菌中经诱导表达。
|
图 2 SDS-聚丙烯酰胺凝胶电泳 1:pET-SlCDJ2未经IPTG诱导;2-7:分别经IPTG诱导1~6h;M:蛋白Maker |
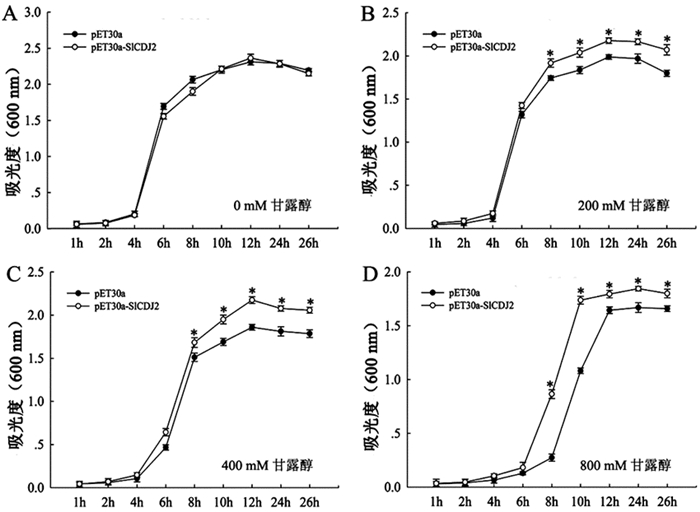
将结果2.1中获得的转pET30a-SlCDJ2阳性菌株和转pET30a空载菌株在甘露醇模拟的干旱胁迫下,进行持续26h诱导表达,分别在1、2、4、6、8、10、12、24h和26h时间点取样检测。结果如图 3显示:在没有胁迫条件下(0mM甘露醇),转基因菌株和对照菌株的生长情况没有明显差异(图 3A)。在干旱胁迫条件下,转基因菌株的生长状况明显好于对照菌株(图 3B、3C、3D),只是随着胁迫程度的加深,转基因菌株和对照菌株生长情况均在变差。在进行盐胁迫处理时,如结果图 4显示:与干旱胁迫的结果极其相似(图 4A、4B、4C、4D)。只是盐胁迫对转基因和对照菌株生长的影响明显大于干旱胁迫。总之,将番茄SlCDJ2蛋白在大肠杆菌中进行表达,增强了转基因大肠杆菌对渗透胁迫的抗性。
|
图 3 干旱胁迫对转SlCDJ2基因的大肠杆菌生长的影响(Mean ± SE,n=6) **代表与对照组相比存在显著差异(*P < 0.05,**P < 0.01) |

|
图 4 盐胁迫对转SlCDJ2基因的大肠杆菌生长的影响(x±s,n=6) *代表与对照组相比存在显著差异(P < 0.05) |
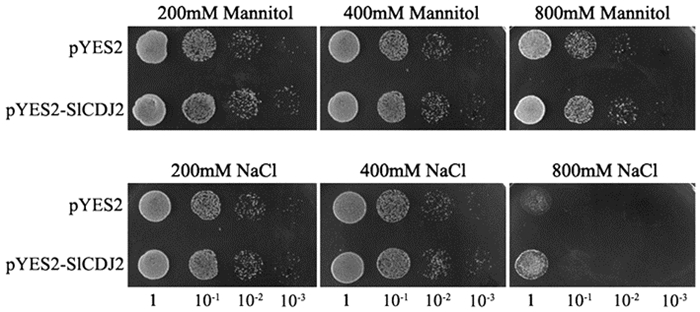
为了进一步探究SlCDJ2在酵母中是否具有与在大肠杆菌中同样的功能,我们构建了pYES2-SlCDJ2酵母表达载体,并成功转化酵母,获得阳性菌株。如图 5显示:不论是在干旱胁迫下还是盐胁迫下,转pYES2-SlCDJ2的酵母菌株均比转pYES2空载的对照菌株菌落密度要大,只是随着胁迫程度加大,阳性菌株和对照菌株的菌落密度均在逐渐减小,这就说明阳性菌株的生长状况要优于对照菌株的生长状况。这些结果说明,SlCDJ2蛋白有助于增强转基因酵母对渗透胁迫的抗性。
|
图 5 干旱和盐胁迫对转SlCDJ2基因酵母生长的影响 |
DnaJ蛋白是生物体内广泛存在的一种参与多种生理生化过程,并响应多种胁迫的热激蛋白,最早发现于大肠杆菌中[7]。近几年,几乎在所有的生物类群中均有DnaJ蛋白的发现,且具有多种不同的生物特征[8]。Hsp70-DnaJ分子伴侣系统能够维持多种胁迫下细胞内蛋白质的稳定,进而提高生物体的抗逆性[9]。例如AtDjA2和AtDjA3蛋白有助于提高拟南芥的高温抗性[10]。AtDjB1可以通过保护细胞免受高温诱导的氧化胁迫的伤害,进而提高拟南芥的耐热性[11]。异源表达大豆GmDjp1能够显著提高大肠杆菌的高温抗性[12]。Schafleitner等[13]研究发现6个DnaJ蛋白均受到水分胁迫的诱导而上调表达,其作用可能是维持干旱胁迫下细胞内蛋白组分的稳定性,从而减轻细胞的损伤。Zhao等[14]研究表明,在大肠杆菌中异源表达拟南芥DnaJ蛋白能够增强细菌对盐的耐受性。目前,番茄中DnaJ蛋白功能研究较少,尤其是对渗透胁迫条件下其功能研究更少。因此,本研究中我们从番茄叶片中克隆得到一个DnaJ基因(SlCDJ2),该基因全长为1159 bp,开放阅读框为834 bp,编码277个氨基酸(图 1)。先前研究表明,番茄SlCDJ2基因受干旱胁迫的诱导表达[15]。在本研究中,在大肠杆菌中表达SlCDJ2蛋白(图 2),转基因大肠杆菌在干旱和盐胁迫的生长状况明显好于对照菌株(图 3、4),说明SlCDJ2蛋白有助于提高转基因大肠杆菌对渗透胁迫的抗性。同样,在酵母中表达SlCDJ2蛋白,转基因酵母菌株在干旱和盐胁迫下的菌落密度均高于对照菌株(图 5),说明SlCDJ2蛋白有助于转基因酵母提高对渗透胁迫的抗性。这些研究初步表明,番茄SlCDJ2基因在响应渗透胁迫过程发挥重要的功能,但SlCDJ2基因在番茄中的具体功能仍有待进一步研究。
| [1] |
张峭, 王克. 我国农业自然灾害风险评估与区划[J]. 中国农业资源与区划, 2011, 32(3): 32-36. |
| [2] |
孔凡英, 邓永胜, 孟庆伟. 叶绿体J蛋白研究进展[J]. 植物生理学报, 2011, 47(3): 235-243. |
| [3] |
Rajan VBV, D'Silva P. Arabidopsis thaliana J-class heat shock proteins:cellular stress sensors[J]. Functional & Integrative Genomics, 2009, 9: 433-446. |
| [4] |
Wang GD, Kong FY, Zhang S, et al. A tomato chloroplast-targeted DnaJ protein protects Rubisco activity under heat stress[J]. Journal of Experimental Botany, 2015, 66(11): 3027-3040. DOI:10.1093/jxb/erv102 |
| [5] |
Laemmli UK. Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J]. Nature, 1970, 227: 680-685. DOI:10.1038/227680a0 |
| [6] |
Cai GH, Wang GD, Wang L, et al. A maize mitogen-activated protein kinase kinase, ZmMKK1, positively regulated the salt and drought tolerance in transgenic Arabidopsis[J]. Journal of Plant Physiology, 2014, 171: 1003-1016. DOI:10.1016/j.jplph.2014.02.012 |
| [7] |
Georgopoulos CP, Heil AL, Yochem J, et al. Identification of the E.coli DnaJ gene product[J]. Molecular Genetics and Metabolism, 1980, 178: 583-588. |
| [8] |
Craig EA, Huang P, Aron R, et al. The diverse roles of J proteins, the obligate Hsp70 co-chaperone[J]. Reviews of Physiology Biochemistry and Pharmacology, 2006, 156(156): 1-21. |
| [9] |
Pulido P, Leister D. Novel DNAJ-related proteins in Arabidopsis thaliana[J]. New Phytologist, 2018, 217: 480-490. DOI:10.1111/nph.14827 |
| [10] |
Li GL, Chang H, Li B, et al. The roles of the atDjA2 and atDjA3 molecular chaperone proteins in improving thermotolerance of Arabidopsis thaliana seedlings[J]. Plant Science, 2007, 173: 408-416. DOI:10.1016/j.plantsci.2007.06.013 |
| [11] |
Zhou W, Zhou T, Li MX, et al. The Arabidopsis J-protein AtDjB1 facilitates thermotolerance by protecting cells against heat-induced oxidative damage[J]. New Phytologist, 2012, 194: 364-378. DOI:10.1111/j.1469-8137.2012.04070.x |
| [12] |
So HA, Chung E, Lee JH. Molecular characterization of soybean GmDjp1 encoding a type Ⅲ J-protein induced by abiotic stress[J]. Genes & Genomics, 2013, 35(2): 247-256. |
| [13] |
Schafleitner R, Gutierrez Rosales RO. Capturing candidate drought tolerance traits in two native Andean potato clones by transcription profiling of field grown plants under water stress[J]. Plant Physiology and Biochemistry, 2007, 45(9): 673-90. DOI:10.1016/j.plaphy.2007.06.003 |
| [14] |
Zhao ZC, Zhang WR, Yan JP, et al. Overexpression of Arabidopsis DnaJ (Hsp40) contributes to NaCl-stress tolerance[J]. African Journal of Biotechnology, 2010, 9: 972-978. DOI:10.5897/AJB |
| [15] |
Wang GD, Cai GH, Kong FY, et al. Overexpression of tomato chloroplast-targeted DnaJ protein enhances tolerance to drought stress and resistance to Pseudomonas solanacearum in transgenic tobacco[J]. Plant Physiology and Biochemistry, 2014, 82: 95-104. DOI:10.1016/j.plaphy.2014.05.011 |



