乳腺癌是女性最常见的恶性肿瘤之一,严重危害女性的身心健康,已成为导致女性死亡的重要因素。PIWI是一类肿瘤相关基因,参与了包括乳腺癌在内的多种肿瘤的发生发展过程。PIWI基因家族有4个成员,即Piwil1(Piwi-like homolog1)、Piwil2、Piwil3和Piwil4。PIWIL1(PIWI-like protein 1,PIWIL1)是Argonaute蛋白家族的重要成员,在细胞增殖、肿瘤发生、胚胎发育等生物学过程中发挥重要的作用[1]。Sun等[2]研究发现,结肠癌组织中PIWIL1蛋白表达水平远远高于正常结肠组织,提示PIWIL1可作为检测结肠癌的重要的分子标记物。随着研究的不断深入,已发现多种分子在乳腺癌的发生过程中发挥重要的作用。CYP3A4是墨西哥女性乳腺癌发病的重要检测分子[3]。ESR1和PGR与乳腺导管癌的发生密切相关[4],同时EMSY(一种新的BRCA2连接蛋白)参与了乳腺癌的淋巴结转移[5]。PIWIL的高表达与肿瘤的低分化和高转移率密切相关,甚至会导致周围神经侵袭[6]。胃癌组织高水平表达PIWIL,常被看作癌细胞生长的标志物[7],而敲除PIWIL则会抑制裸鼠肺癌的生长[8],这充分表明PIWIL参与了多种肿瘤发生,并可作为癌症治疗的潜在药物靶标。
本实验应用RNAi技术特异性沉默乳腺癌细胞株MCF-7中PIWIL1基因的表达,探讨PIWIL1基因的靶向抑制对乳腺癌细胞增殖的影响,为乳腺癌的早期基因诊断和治疗提供理论依据。
1 材料与方法 1.1 材料乳腺癌MCF-7细胞株由本研究所培养保存,细胞培养所用胎牛血清和DMEM培养基均购自美国Gibco公司;SYBR Green Ⅰ购自罗氏公司;RNA提取试剂TRIzol和细胞转染试剂LipofectamineTM2000均购自Invitrogen公司;RT-PCR试剂盒购自天根生化科技(北京)有限公司。针对目的基因PIWIL1的干扰质粒pGCsilencerTMH1/GFP/Neo/PIWIL1和对照质粒pGCsilencerTMH1/GFP/Neo/Non均由上海吉凯公司设计并构建。
1.2 靶向PIWIL1的shRNA表达载体的构建根据目的基因PIWIL1的mRNA序列(Accession number of PIWIL1 mRNA:AB079366)设计合成其靶向siRNA,并从中选择干扰效率最高的一条siRNA构建表达载体pGCsilencerTMH1/GFP/Neo/PIWIL1,该表达载体在脊椎动物细胞内表达针对PIWIL1的shRNA。同时设计合成一条非特异siRNA,构建阴性对照表达载体pGCsilencerTM H1/GFP/Neo/Non。
1.3 细胞培养人乳腺癌MCF-7细胞株常规培养于含10%胎牛血清的DMEM培养基中, 5% CO2,37℃条件下培养、传代。实验随机分为脂质体对照组,阴性质粒转染对照组(阴性对照组)及PIWIL1-shRNA)重组质粒转染组(PIWIL1-shRNA组)。
1.4 稳定转染细胞株的筛选MCF-7细胞接种于24孔板,24h后转染干扰质粒,48h后更换含有G418的DMEM培养基,每2~3天更换一次新鲜培养液,G418浓度由预实验确定。约10~15d后转染PIWIL1-shRNA组质粒的细胞多数死亡,未转染带有抗性基因质粒的细胞组全部死亡。最后,挑取阳性细胞克隆继续扩大培养,直至获得稳定转染的细胞。
1.5 PIWIL1 mRNA表达的检测为检测干扰质粒对目的基因表达水平的影响,对PIWIL1-shRNA组、阴性对照组和脂质体对照组各组细胞进行PIWIL1 mRNA表达水平检测。提取各组细胞总RNA,然后反转录成cDNA。利用软件Primer Premier 5.0设计PIWIL1和内参GAPDH引物,为避免基因组DNA的污染,上下游引物跨越2个内含子。PIWIL1:上游引物5′-TCACCTGAGCAAAGACAAC-3′,下游引物5′-TCCCGTAAAGGACAGTAAG-3′, 片段长度126bp;GAPDH:上游引物5′-CGATCTGAACTACATGGTTTAC-3′,下游引物5′-TCTGCCCATTTGATGTTGC-3′,片段长度151bp。按照试剂盒操作规程,运用实时荧光定量PCR检测各组细胞中PIWIL1 mRNA表达水平。以GAPDH作内参,用公式2Ct(GAPDH)-Ct(PIWIL1)计算目的基因mRNA相对表达量。
1.6 Western blot检测细胞中PIWIL1蛋白表达将培养于6孔细胞培养板中的MCF-7细胞去除培养基,预冷的PBS洗两遍。每孔加入200μl RIPA细胞裂解液(含1% PMSF),置于冰上裂解30min,提取细胞总蛋白,BCA法测定蛋白浓度。10%的SDS-PAGE进行电泳分离、转膜。5%的脱脂蛋白室温封闭1h,TBST洗3次,10min/次;PIWIL1一抗4℃孵育过夜,TBST洗3次,10min/次;辣根过氧化物酶标记的二抗山羊抗兔IgG室温孵育1h,TBST洗3次,10min/次;ECL显色、X曝光。扫描仪扫描X光片上的条带,Image J2x软件进行条带的灰度值计算。所得结果用SPSS13.0进行统计分析,结果以3次独立实验的x±s表示。
1.7 CCK-8(Cell Counting Kit-8)检测细胞增殖活性将脂质体对照组、PIWIL1-shRNA组和阴性对照组等各组MCF-7细胞接种于96孔培养板中,细胞密度为104个/孔,CO2培养箱常规培养。24h后,每孔加入10μL CCK-8溶液;细胞培养箱内继续孵育1h;在450nm测定吸光度。实验重复3次。
1.8 统计学方法数据用SPSS18.0软件进行统计分析,采用方差分析进行多组间比较,采用SNK-q检验进一步两两比较。以P<0.05为差异有统计学意义。
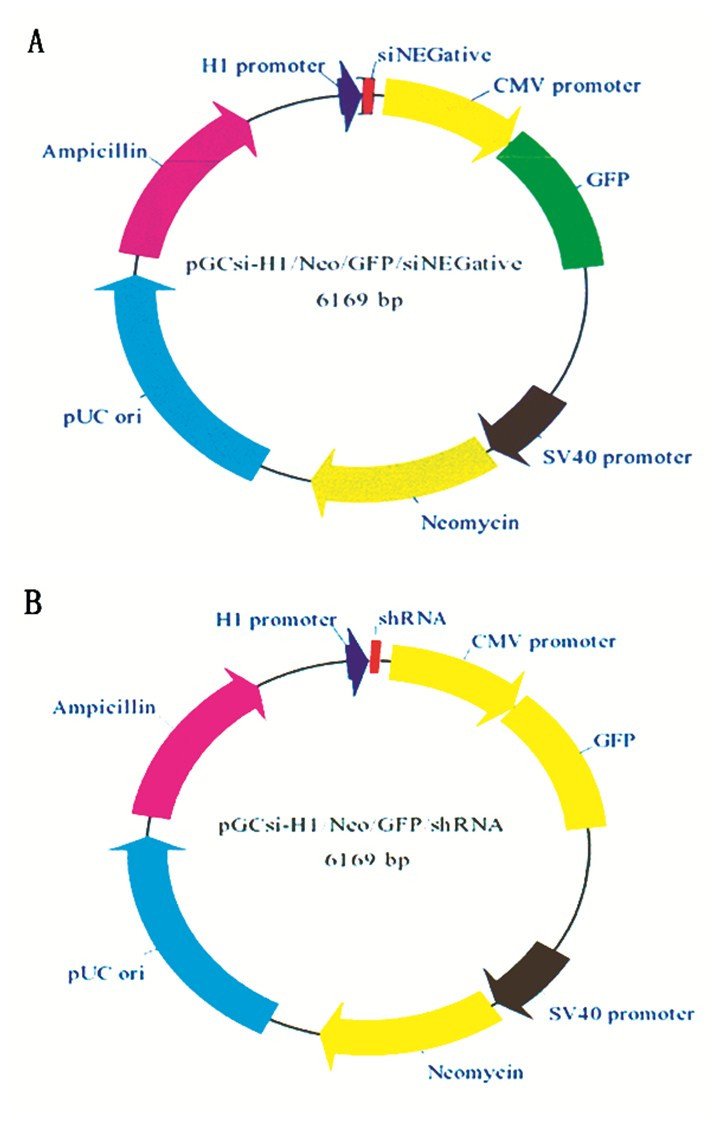
2 结果 2.1 PIWIL1-shRNA表达载体的构建与鉴定阳性干扰质粒pGCsilencerTMH1/GFP/Neo/PIWIL1和阴性对照重组质粒构建后经测序证实100%靶向目的基因,同时该载体在细胞内可表达用于筛选的GFP蛋白,表明该重组质粒构建成功。见图 1。
|
图 1 RNAi质粒构建图谱 注:A.pGCsilencerTMH1/GFP/Neo/NON RNAi质粒图谱; B.pGCsilencerTMH1/GFP/Neo/PIWIL1 RNAi质粒图谱 |
含阳性重组质粒的MCF-7细胞株在经过G418抗性筛选后,细胞爬片,荧光显微镜观察,证实已成功获得稳定转染的阳性细胞克隆,可用于后续实验。见图 2。

|
图 2 MCF-7稳转细胞的筛选及鉴定 注:A.稳定转染pGCsilencerTMH1/GFP/Neo/ PIWIL1质粒的MCF-7细胞在普通显微镜下的生长状态;B.稳定转染pGCsilencerTMH1/GFP/Neo/ PIWIL1质粒的MCF-7细胞在荧光显微镜下的生长状态 |
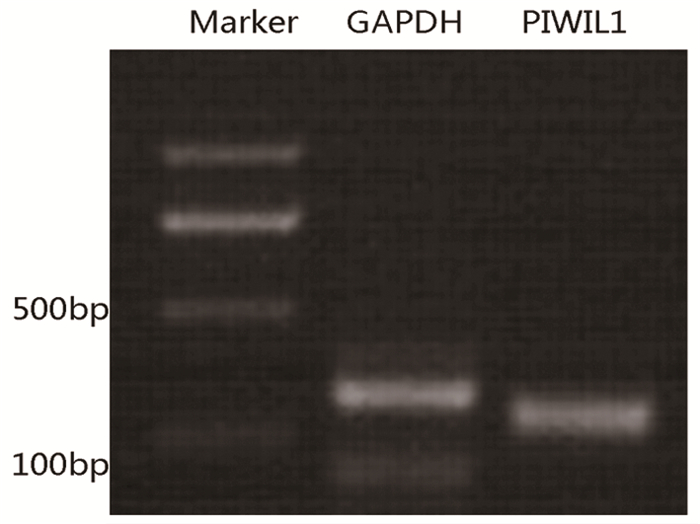
PCR扩增后DNA电泳结果显示,PIWIL1和内参GAPDH大小与实际大小一致,表明MCF-7细胞内源性表达PIWIL1 mRNA,且PCR对2种基因进行了特异性扩增。见图 3。
|
图 3 Real-time PCR扩增后PIWIL1和GAPDH电泳图 |
PIWIL1-shRNA重组质粒转染MCF-7细胞后,目的基因PIWIL1 mRNA的表达水平受到了显著的抑制,mRNA表达水平比脂质体对照组降低了73.9%。阴性对照组和脂质体对照组MCF-7细胞的PIWIL1 mRNA表达水平无显著性差异。见表 1。
| 表 1 稳定转染后各组细胞PIWIL1 mRNA的相对抑制率 |
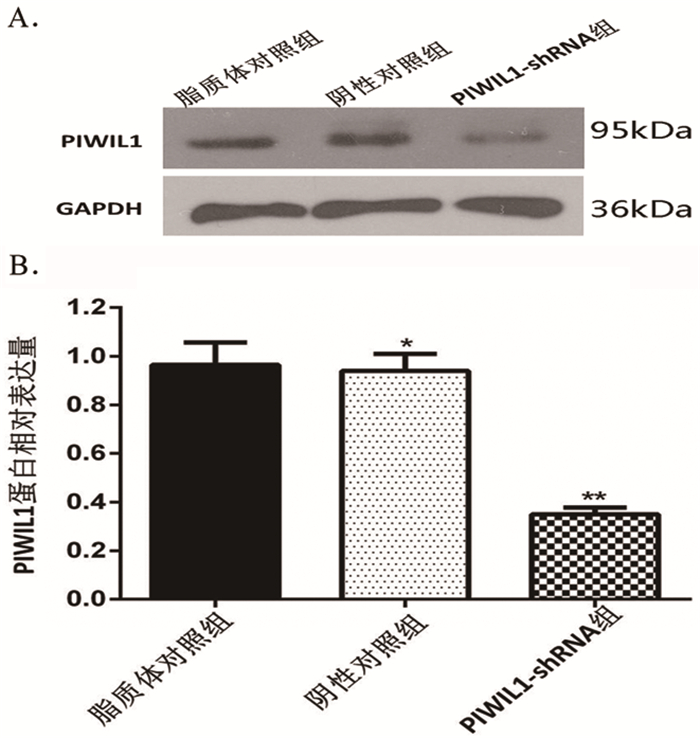
PIWIL1-shRNA组PIWIL1蛋白表达显著低于脂质体对照组和阴性对照组,差异具有统计学意义(P<0.05),而阴性对照组和脂质体对照组间无统计学差异。见图 4。
|
图 4 PIWIL1-shRNA对MCF-7细胞中PIWIL1蛋白表达水平的影响 注:3组间比较,F=51.18,P<0.05;与脂质体对照组及阴性对照组比较,**P<0.05,n=6;与脂质体对照组相比,*P>0.05, n=6 |
PIWIL1-shRNA质粒转染MCF-7细胞后,PIWIL1-shRNA细胞增殖活性显著低于阴性对照组和脂质体对照组,差异具有统计学意义(P<0.05),而阴性对照组和脂质体对照组间没有差异。

|
图 5 PIWIL1-shRNA对MCF-7细胞活性的影响 注:3组间比较,F=40.65,P<0.05;与脂质体对照组及阴性对照组比较,**P<0.05,n=6;与脂质体对照组相比,*P>0.05, n=6 |
PIWI是人类Argonaute蛋白家族重要成员,而Argonaute蛋白是RNA介导的干扰复合物的中心成分。PIWI参与了几乎所有的生物学过程,并且与多种恶性肿瘤的发生密切相关[9]。作为PIWI蛋白亚家族成员,PIWIL1广泛分布于前列腺、卵巢、乳腺、肝脏、心脏等多种人体组织中,在细胞增殖、凋亡、粘附、转移和肿瘤的发生等生物学过程中发挥了关键的作用[10-11]。
本实验中,我们首先根据siRNA设计原则,针对PIWIL1基因设计了3条siRNA和1条阴性对照siRNA,通过筛选优化得到了一条干扰效果最佳的siRNA,随后用这条siRNA构建了PIWIL1-shRNA表达质粒,用以筛选稳转细胞和后期的动物实验。该表达质粒除可高效表达shRNA,还可表达GFP和Neo 2种蛋白,用以检测转染效率和进行抗性筛选,扩大培养。
稳转细胞株的筛选,我们选用了G418抗性筛选方法。荧光显微镜检测结果显示,转染PIWIL1-shRNA质粒的MCF-7细胞经过抗性筛选后稳定高效表达绿色荧光蛋白,且PIWIL1主要在细胞质中表达,表明稳定表达PIWIL1-shRNA质粒和阴性对照质粒的MCF-7细胞株筛选成功,为后续实验的顺利实施奠定了研究基础。随后,我们从mRNA水平和蛋白水平对稳转细胞中PIWIL1基因的表达进行了检测。实时荧光定量PCR结果显示,转染PIWIL1-shRNA质粒的MCF-7细胞,PIWIL1 mRNA的表达受到了明显的抑制,与脂质体对照组相比,mRNA表达水平降低了73.9%。而转染阴性对照质粒的MCF-7细胞和脂质体对照组相比,PIWIL1 mRNA的表达水平无显著性差异,表明PIWIL1-shRNA显著抑制了PIWIL1 mRNA的表达。同样,蛋白免疫印迹结果显示,PIWIL1-shRNA组的蛋白表达水平显著低于脂质体对照组和阴性对照组(P<0.05),表明PIWIL1-shRNA不仅抑制了PIWIL1基因的mRNA的表达,进而还引起了PIWIL1蛋白表达的降低。
研究表明,PIWIL1参与了多种恶性肿瘤的发生发展。PIWIL1的异常表达促进了结肠癌细胞的增殖,还可通过上调DNA的甲基化影响癌细胞的活性[12-13]。肺癌细胞增殖活性的激活同样依赖PIWIL1基因的过表达[14],因此,PIWIL1常被作为多种恶性肿瘤早期诊断和预后的标志物[2, 15]。本实验中,PIWIL1-shRNA重组质粒的转染抑制了乳腺癌细胞MCF-7中PIWIL1 mRNA和蛋白的表达。为检测基因水平的变化是否会影响细胞的增殖,我们运用CCK-8方法进行了细胞增殖活性检测。实验结果显示,PIWIL1-shRNA组细胞的增殖活性显著低于脂质体组和阴性对照组细胞(P<0.05),表明PIWIL1表达水平的降低抑制了细胞的增殖,进而也说明PIWIL1能够促进MCF-7细胞的增殖,具有促进乳腺癌增殖的潜力,是一种促癌基因。
综上所述,我们运用RNAi和实时荧光定量等方法,证实在对乳腺癌细胞MCF-7中的PIWIL1进行沉默后,PIWIL1 mRNA和蛋白表达显著降低。CCK-8细胞活性分析实验表明,PIWIL1能够促进乳腺癌细胞MCF-7的增殖,提示PIWIL1是一种肿瘤促进基因,为乳腺癌的早期诊断和治疗提供了新的思路,为抗癌药物的设计和研究提供了新的实验依据。
| [1] |
Liu WK, Jiang XY, Zhang ZX. Expression of PSCA, PIWIL1 and TBX2 and its correlation with HPV16 infection in formalin-fixed, paraffin-embedded cervical squamous cell carcinoma specimens[J]. Arch Virol, 2010, 155(5): 657-663. DOI:10.1007/s00705-010-0635-y |
| [2] |
Sun R, Gao CL, Li DH, et al. Expression status of PIWIL1 as a prognostic marker of colorectal cancer[J]. Dis Markers, 2017, 2017: 1204937. DOI:10.1155/2017/1204937 |
| [3] |
Floriano-Sanchez E, Rodriguez NC, Bandala C, et al. CYP3A4 expression in breast cancer and its association with risk factors in Mexican women[J]. Asian Pac J Cancer Prev, 2014, 15(8): 3805-3809. DOI:10.7314/APJCP.2014.15.8.3805 |
| [4] |
Medina-Jaime AD, Reyes-Vargas F, Martinez-Gaytan V, et al. ESR1 and PGR gene promoter methylation and correlations with estrogen and progesterone receptors in ductal and lobular breast cancer[J]. Asian Pac J Cancer Prev, 2014, 15(7): 3041-3044. DOI:10.7314/APJCP.2014.15.7.3041 |
| [5] |
Madjd Z, Akbari ME, Zarnani AH, et al. Expression of EMSY, a novel BRCA2-Link protein, is associated with lymph node metastasis and increased tumor size in breast carcinomas[J]. Asian Pac J Cancer Prev, 2014, 15(4): 1783-1789. DOI:10.7314/APJCP.2014.15.4.1783 |
| [6] |
Oh SJ, Kim SM, Kim YO, et al. Clinicopathologic implications of PIWIL2 expression in colorectal cancer[J]. Korean J Pathol, 2012, 46(4): 318-323. DOI:10.4132/KoreanJPathol.2012.46.4.318 |
| [7] |
Liu XY, Sun Y, Guo JP, et al. Expression of hiwi gene in human gastric cancer was associated with proliferation of cancer cells[J]. Int J Cancer, 2006, 118(8): 1922-1929. DOI:10.1002/ijc.21575 |
| [8] |
Liang D, Dong M, Hu LJ, et al. Hiwi knockdown inhibits the growth of lung cancer in nude mice[J]. Asian Pac J Cancer Prev, 2013, 14(2): 1067-1072. DOI:10.7314/APJCP.2013.14.2.1067 |
| [9] |
Völler D, Linck L, Bruckmann A, et al. Argonaute family protein expression in normal tissue and cancer entities[J]. PLoS One, 2016, 11(8): e0161165. DOI:10.1371/journal.pone.0161165 |
| [10] |
Girard A, Sachidanandam R, Hannon GJ, et al. A germline-specific class of small RNAs binds mammalian Piwi proteins[J]. Nature, 2006, 442(7099): 199-202. DOI:10.1038/nature04917 |
| [11] |
Kwon C, Tak H, Rho M, et al. Detection of PIWI and piRNAs in the mitochondria of mammalian cancer cells[J]. Biochem Biophys Res Commun, 2014, 446(1): 218-223. DOI:10.1016/j.bbrc.2014.02.112 |
| [12] |
Yang L, Bi L, Liu QW, et al. Hiwi promotes the proliferation of colorectal cancer cells via upregulating global DNA methylation[J]. Dis Markers, 2015, 2015: 383056. DOI:10.1155/2015/383056 |
| [13] |
Wang HL, Chen BB, Cao XG, et al. The clinical significances of the abnormal expressions of Piwil1 and Piwil2 in colonic adenoma and adenocarcinoma[J]. Onco Targets Ther, 2015, 8: 1259-1264. DOI:10.2147/OTT.S77003 |
| [14] |
Reeves ME, Firek M, Chen ST, et al. Evidence that RASSF1C stimulation of lung cancer cell proliferation depends on IGFBP-5 and PIWIL1 expression levels[J]. PLoS One, 2014, 9(7): e101679. DOI:10.1371/journal.pone.0101679 |
| [15] |
Wang Y, Liu YX, Shen XY, et al. The PIWI protein acts as a predictive marker for human gastric cancer[J]. Int J Clin Exp Pathol, 2012, 5(4): 315-325. |



