2. 日照市人民医院, 日照 276800
2. Department of Neurology, Rizhao People's Hospital, Rizhao 276800, China
神经干细胞和间充质干细胞等增殖分化形成神经元及神经胶质细胞为神经系统疾病替代疗法的有效策略[1-3]。在神经系统发育过程发挥重要作用的碱性成纤维细胞生长因子(basic fibroblast growth factor,b-FGF)在神经保护和增强神经再生能力方面具有很好的潜质。相关研究显示b-FGF可以诱导神经元前体细胞的形成和分化,促进神经元轴突的延伸以及突触形成[4-5],新生血管的出芽过程、参与新形成血管改建和再塑调节[6-7]。不足之处在于b-FGF维持时间较为短暂,导致刺激信号不能持续,为增强其生物学效应,建构壳聚糖缓释复合体,缓慢持续的释放b-FGF,较长时间维持有效浓度[8],明显提高神经元分化比例[9-10]。本研究通过培养SD大鼠来源神经干细胞,经b-FGF壳聚糖缓释体外诱导分化,探讨这种持续释放b-FGF的方法对神经元形成的影响,进一步揭示细胞Akt信号通道蛋白磷酸化水平在此过程中的作用,为神经干细胞分化相关信号系统的研究提供参考。
1 材料与方法 1.1 材料SPF清洁级新生SD大鼠,济宁医学院实验动物中心提供,实验动物符合伦理学相关要求, 实验过程尽一切努力最大限度减少其疼痛、痛苦和死亡。DMEM/F12(1 :1)培养基、胎牛血清FBS、胰岛素、马血清(HS)、B27添加剂购自美国Gibco公司。b-FGF、表皮生长因子(EGF)购自Peprotech公司。PE Mouse anti-Nestin、同型对照PE Mouse IgG1、Perm/Wash Buffer、Fixation Buffer购自BD公司。山羊抗小鼠、山羊抗兔二抗购自Earthox公司。抗β微管蛋白Ⅲ抗体、大鼠nestin抗体、NSE抗体、GFAP购自Abcam公司。anti-phospho-Akt抗体购自Santa Cruz Biotechnology公司。青霉素、链霉素购自HyClone公司。ECL检测试剂购自Amersha公司。显微图像Image-pro Plus 2.0软件包购自Media Cybernetics公司。解剖显微镜、激光共聚焦倒置荧光显微镜购自Leica公司。
1.2 方法 1.2.1 细胞培养酒精消毒后断颈处死24h新生鼠,超净工作台内,解剖显微镜下,无菌操作取脑腹侧10mm×12mm×15mm大小组织, 剪碎后胰蛋白酶分解,200目尼龙网滤过离心(1000r/min,10min)处理,移液器吸头吹打细胞制成悬液稀释(密度5×105/ml)加入DMEM/F12(1 :1)培养基(含青霉素100U/ml和链霉素100mg/l)后接种到25cm 2T75型号培养瓶培养。37℃、5% CO2及95%湿度条件,恒温培养箱环境下孵育细胞。每72h换液,每6d化学消化和轻柔机械吹打方法传代1次。
1.2.2 细胞鉴定传代细胞绘制生长曲线图。标志物巢蛋白nestin免疫荧光检测,取第4代接种到铺有多聚赖氨酸盖片培养24h, 经多聚甲醛固定细胞15min,PBS清洗3次,每次5min,血清蛋白封闭,加入一抗(1 :400)4℃过夜。恢复室温60min,PBS清洗加入二抗(1 :800),室温下2h,舍弃液体,PBS清洗3次后封片,倒置荧光显微镜观察摄影。神经元特异性烯醇化酶NSE和神经胶质细胞酸性蛋白GFAP免疫组织化学检测。
1.2.3 Image-pro Plus 2.0软件分析取P4分化细胞,胰蛋白酶分解消化,离心稀释5×105/ml后,随机分壳聚糖对照组(壳聚糖10g/L+培养液),b-FGF对照组(b-FGF 20μg/L+培养液),b-FGF壳聚糖缓释组(培养液+壳聚糖10g/L+b-FGF 20μg/L)。培养48h镜下随机高倍视野观察和计数细胞。神经突起出现即为计数细胞,突起的数目和长度随着培养时间延长增加,显微图像Image-pro Plus 2.0软件采集图像后统计突起长度数值。
1.2.4 Western blot分析细胞裂解后提取总蛋白行免疫印迹检测,10%的SDS-PAGE凝胶进行电泳,电泳分离后电转至硝酸纤维素膜。大鼠抗β微管蛋白Ⅲ抗体(1 :10000),大鼠磷酸化Akt抗体(1 :10000)。
1.3 统计学方法应用SPSS 22.0软件对相关实验数据进行统计学分析。数据用x±s表示,两组数据比较用LSD-t检验,P < 0.05为差异具有统计学意义。
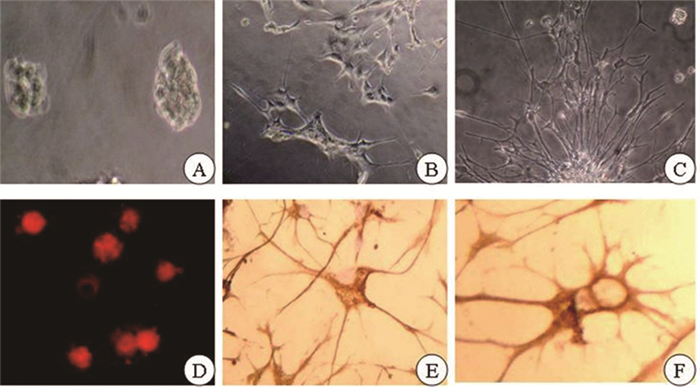
2 结果 2.1 神经干细胞与分化细胞传代计数绘制细胞增殖生长曲线(图 1),培养24h即可形成椭圆形桑椹状的神经球,每个神经球由40~80个分化细胞聚集形成(图 2A),神经干细胞标志Nestin细胞质中表达,鲜亮红色荧光(图 2D)。培养液中加入胎牛血清和马血清24h见树状突起形成和延伸(图 2B),末端见微细分叉结构,48h突起之间相互连接构筑网络状结构(图 2C)。免疫组织化学显示NSE在分化细胞中表达(图 2E),星形胶质细胞标志物GFAP在细胞突起中表达(图 2F)。

|
图 1 细胞增殖曲线 |
|
图 2 神经干细胞与分化细胞 注:A.神经球形成(×100);B.24h细胞分化形成突起(×100);C.48h神经元网络形成(×100);D.Nestin阳性细胞(SABC法,×400);E.NSE阳性细胞(SABC法,×400);F.GFAP阳性细胞(SABC法,×400) |
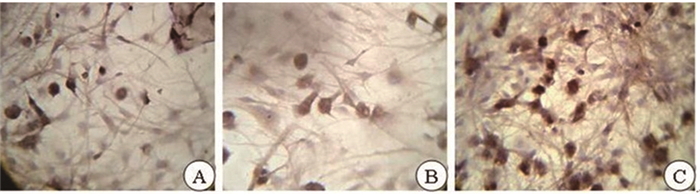
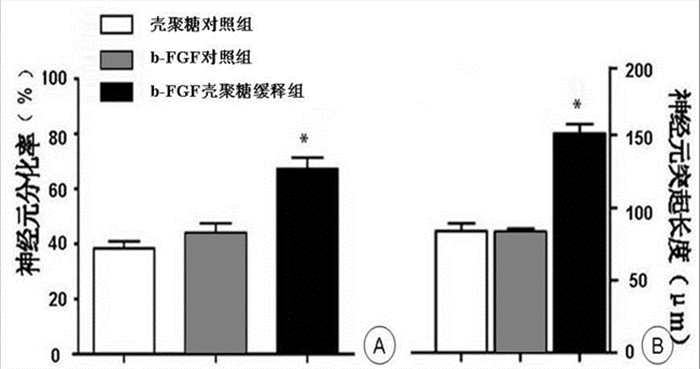
诱导48h后,壳聚糖对照组、b-FGF对照组和b-FGF壳聚糖缓释组神经干细胞分化为神经元的分化率分别为38.5%、42.6%和70.8%, 神经元突起的长度分别为(75±4)μm、(77±1)μm和(150±4)μm。见图 3和图 4。
|
图 3 诱导48h后各组神经元变化情况(SABC法,×400) 注:A.壳聚糖对照组;B.b-FGF对照组;C.b-FGF壳聚糖缓释组; |
|
图 4
诱导48h后各组神经元变化情况
注:3组间比较,F=53.48,P < 0.05(神经元分化率); 3组间比较,F=62.23,P < 0.05(神经元突起长度); 与壳聚糖对照组相比, *P < 0.05; 与b-FGF对照组相比,*P < 0.05 |
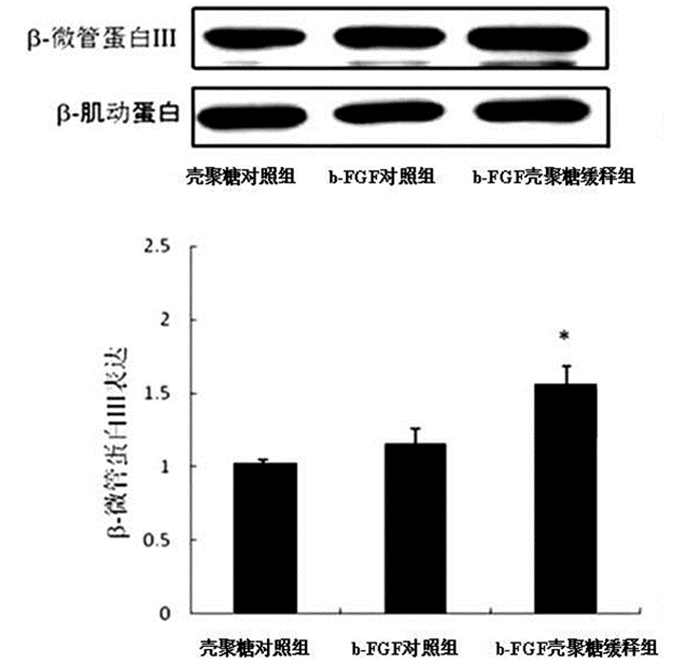
诱导作用48h后壳聚糖对照组、b-FGF对照组和b-FGF壳聚糖缓释组神经元骨架蛋白βⅢ-tubulin分别为1.0±0.1、1.2±0.2和1.5±0.3, b-FGF壳聚糖缓释组与其他组相比,βⅢ-tubulin表达增加(P < 0.05)。见图 5。
|
图 5 诱导48h后各组神经元骨架蛋白βⅢ-tubulin表达水平变化情况 注:3组间比较,F=43.66,P < 0.05;与壳聚糖组相比, *P < 0.05;与b-FGF组相比, *P < 0.05 |
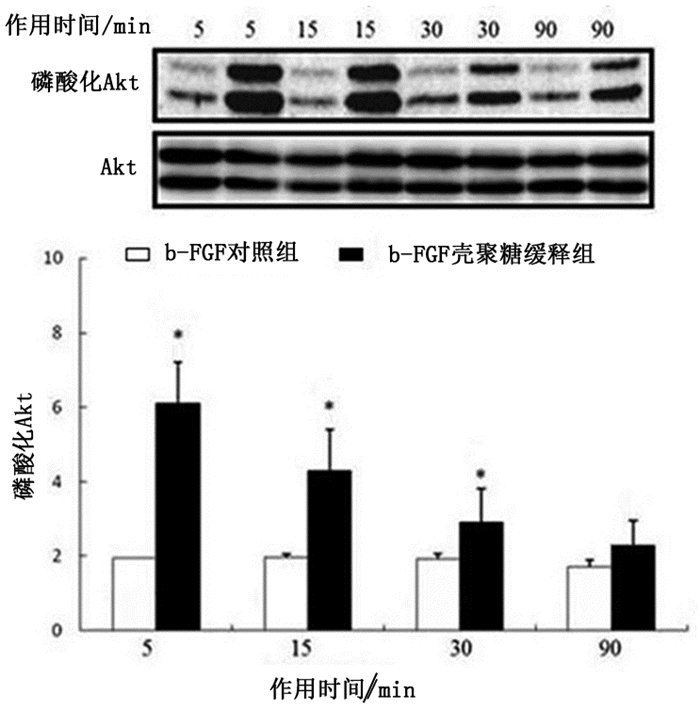
与b-FGF对照组相比,b-FGF壳聚糖缓释组b-FGF壳聚糖缓释处理5、15、30min后,Akt磷酸化水平明显升高(P < 0.05), 且Akt磷酸化水平随着时间延长下降趋势明显。见图 6。
|
图 6 b-FGF壳聚糖缓释处理Akt磷酸化水平随时间发生变化情况 注:与b-FGF对照组比较,*P < 0.05 |
神经元变性死亡后,有望通过诱导其他神经前体细胞的再生或移植干细胞参与组织修复,这一直是神经干细胞领域研究的热点。神经干细胞移植后面临的问题主要是所处微环境中各种炎症因子的释放,严重干扰神经干细胞的增殖和分化,甚至诱导细胞凋亡或者坏死,加之组织变性,胶质瘢痕的形成,神经胶质细胞释放损伤性炎症因子,严重干扰了神经元的修复和再生[11]。近来相关研究显示b-FGF具有对抗损伤诱发的细胞凋亡作用,增强各种类型神经元在体外的存活能力,促进轴突再生和延长,还有利于横断的神经内血管再生[12-13]。b-FGF参与细胞有丝分裂过程,在一定程度上可诱导神经干细胞增殖和分化,阻止神经元损伤后细胞凋亡,有利于神经元存活,为轴突再生和延伸修复创造了条件,加之其诱导横断神经血管再生,因此b-FGF解决了神经细胞增殖、再生和血管形成问题,一定范围浓度控制下b-FGF的修复损伤神经效果显著[14-16]。
壳聚糖是一种发展较快的医用高分子材料,具有低免疫原性,降解可控性和多孔性等特点,为制造缓蚀剂的良好材料之一,支持神经干细胞增殖分化的多功能壳聚糖基支架,研究证实其所含的纤维连接蛋白或纤维连接蛋白中所含的RGD肽在促进大鼠和人神经干细胞的黏附、存活和生长方面同样有效[17]。表皮生长因子与神经干细胞在壳聚糖环境培养Western blot分析和基因表达分析显示神经干细胞的生长速度增加了3倍[18]。基于以上研究成果,本课题组用b-FGF壳聚糖制成缓释剂,通过b-FGF持续释放作用,长时间维持有效浓度,保证了体外神经干细胞分化信号的持续性。本文结果表明经b-FGF壳聚糖诱导后神经元的标志物NSE蛋白表达增加,神经元分化率达70.8%,伴有神经突起形成增多,并与浓度呈正相关,神经元骨架蛋白βⅢ-tubulin表达增加,证实b-FGF壳聚制成的缓释剂对神经干细胞分化的持续诱导作用,明显提高神经元分化率。b-FGF壳聚糖的缓释效果为神经干细胞生长提供了优良的信号环境,进一步促进其向神经元方向的分化,所分化的神经元结构较为成熟,树突或轴突延伸明显,甚至可见类似突触的结构形成。另外值得关注的是b-FGF壳聚糖缓释处理后,与b-FGF对照组相比,诱导分化5min时检测发现其对值较高,并且随时间推移15min时和30min时,其水平下降,提示b-FGF壳聚糖的缓释诱导神经干细胞分化过程中涉及较为复杂的信号调节过程,我们推测不同时间内的Akt磷酸化水平可能与神经干细胞分化速度相关,Akt信号通道的磷酸化修饰参与了神经干细胞向神经元分化过程中分化速度的调节。
综上所述,b-FGF壳聚糖缓释作用下对神经元的分化起到重要调节作用,临床应用中可能根据不同的损伤区域选择进行诱导不同种类的神经元和神经胶质细胞,参与神经组织修复,期待达到精准修复的目的。如何精确调节分化神经元的种类和神经元与神经胶质细胞的比例成为下一步深入研究的方向。总之本研究为胆碱能神经元、多巴胺能神经元和少突胶质细胞等定向细胞分化信号途径提供有益参考,为阿尔茨海默病、帕金森病、多发性硬化症的干细胞治疗研究提供实验依据。
| [1] |
Bramlett HM, Dietrich WD. Long-term consequences of traumatic brain injury:current status of potential mechanisms of injury and neurological outcomes[J]. J Neurotrauma, 2015, 32(23): 1834-1848. DOI:10.1089/neu.2014.3352 |
| [2] |
Mahmoud AA, Salama AH. Norfloxacin-loaded collagen/chitosan scaffolds for skin reconstruction:preparation, evaluation and in-vivo wound healing assessment[J]. Eur J Pharm Sci, 2016, 83: 155-165. DOI:10.1016/j.ejps.2015.12.026 |
| [3] |
Yamamoto K, Tajima Y, Hasegawa A, et al. Contrasting effects of stanniocalcin-related polypeptides on macrophage foam cell formation and vascular smooth muscle cell migration[J]. Peptides, 2016, 82: 120-127. DOI:10.1016/j.peptides.2016.06.009 |
| [4] |
王光辉, 钟鸣, 张敏娜. 丹参注射液体外对神经干细胞分化细胞突起形成的影响[J]. 中风与神经疾病杂志, 2018, 35(7): 580-584. |
| [5] |
Yang Z, Zhang A, Duan H, et al. NT3-chitosan elicits robust endogenous neurogenesis to enable functional recovery after spinal cord injury[J]. Proc Natl Acad Sci USA, 2015, 112(43): 13354-13359. DOI:10.1073/pnas.1510194112 |
| [6] |
Duan H, Ge W, Zhang A, et al. Transcriptome analyses reveal molecular mechanisms underlying functional recovery after spinal cord injury[J]. Proc Natl Acad Sci USA, 2015, 112(43): 13360-13365. DOI:10.1073/pnas.1510176112 |
| [7] |
Palmer TD, Markakis EA, Willhoite AR, et al. Fibroblast growth factor-2 activates a latent neurogenic program in neural stem cells from diverse regions of the adult CNS[J]. J Neurosci, 1999, 19(19): 8487-8497. DOI:10.1523/jneurosci.19-19-08487.1999 |
| [8] |
翟婧妍, 段红梅, 尚俊奎, 等. 碱性成纤维细胞生长因子-壳聚糖载体诱导神经干细胞分化及与肌细胞的共培养[J]. 中国组织工程研究, 2017, 21(6): 877-882. |
| [9] |
周靖, 包丽雯, 梁静. 神经干细胞移植帕金森病模型大鼠行为学及对炎症因子的调节效应[J]. 中国组织工程研究, 2017, 21(33): 5299-5304. DOI:10.3969/j.issn.2095-4344.2017.33.009 |
| [10] |
许刚, 赵晨光, 孙玮, 等. LINGO-1在脊髓神经干细胞分化过程中的表达特征及效应[J]. 中国组织工程研究, 2017, 21(33): 5394-5399. DOI:10.3969/j.issn.2095-4344.2017.33.023 |
| [11] |
王光辉, 钟鸣, 郑公朴, 等. 青蒿素对老年小鼠学习记忆及炎性细胞因子和单胺类神经递质的影响[J]. 中华行为医学与脑科学杂志, 2018, 27(7): 593-597. DOI:10.3760/cma.j.issn.1674-6554.2018.07.004 |
| [12] |
Tanaka Y, Isomura T, Shimba K, et al. Neurogenesis enhances response specificity to spatial pattern stimulation in hippocampal cultures[J]. IEEE Trans Biomed Eng, 2017, 64(11): 2555-2561. DOI:10.1109/TBME.2016.2639468 |
| [13] |
Ladeira K, Macedo F, Longatto-Filho A, et al. Angiogenic factors:role in esophageal cancer, a brief review[J]. Esophagus, 2018, 15(2): 53-58. DOI:10.1007/s10388-017-0597-1 |
| [14] |
Zhang JJ, Zhu JJ, Hu YB, et al. Transplantation of bFGF-expressing neural stem cells promotes cell migration and functional recovery in rat brain after transient ischemic stroke[J]. Oncotarget, 2017, 8(60): 102067-102077. DOI:10.18632/oncotarget.22155 |
| [15] |
Li C, Che LH, Shi L, et al. Suppression of basic fibroblast growth factor expression by antisense oligonucleotides inhibits neural stem cell proliferation and differentiation in rat models with focal cerebral infarction[J]. J Cell Biochem, 2017, 118(11): 3875-3882. DOI:10.1002/jcb.26038 |
| [16] |
Abouzaripour M, Fathi F, Daneshi E, et al. Combined effect of retinoic acid and basic fibroblast growth factor on maturation of mouse oocyte and subsequent fertilization and development[J]. Int J Fertil Steril, 2018, 12(1): 68-71. DOI:10.22074/ijfs.2018.5293 |
| [17] |
Wei Z, Zhao J, Chen YM, et al. Self-healing polysaccharide-based hydrogels as injectable carriers for neural stem cells[J]. Sci Rep, 2016, 6: 37841. DOI:10.1038/srep37841 |
| [18] |
Moore L, Skop NB, Rothbard DE, et al. Tethered growth factors on biocompatible scaffolds improve stemness of cultured rat and human neural stem cells and growth of oligodendrocyte progenitors[J]. Methods, 2018, 133: 54-64. DOI:10.1016/j.ymeth.2017.08.015 |



