目前,肺癌是最常见的呼吸系统恶性肿瘤,研究发现肺癌拥有所有癌症中最高的死亡率,其死亡人数约占所有癌症的26%[1]。随着科学技术的不断进步,越来越多的治疗手段应用于肺癌,从化疗到靶向治疗再到免疫治疗[2]。虽然治疗方法在不断丰富,但医务工作者依然在努力寻找肺癌早期的诊断及治疗标志,从而完全攻克癌症。随着对表观遗传学的深入研究,我们发现表观遗传学的改变对于肺癌的发生起到不可替代的作用[3]。p14在细胞生长过程中起到抑癌基因的作用[4],而p14ARF基因启动子区域异常甲基化在肺癌与癌旁组织存在明显差异,提示p14ARF基因启动子区域异常甲基化与肺癌的发生发展有着密切的关系[5]。本实验利用巢式甲基化特异性PCR(NMSP)对spca1细胞系进行甲基化分析,并通过DAC去除p14ARF基因启动子区域异常甲基化,检测其对ARF蛋白表达及肿瘤细胞凋亡的影响,由此得出p14启动子区异常甲基化对肺癌生物学功能的影响,初步研究去除p14ARF基因启动子区域异常甲基化对肺癌生物学功能的影响。
1 材料与方法 1.1 细胞系及主要试剂人肺癌细胞系spca1、人支气管上皮细胞系beas-2b购自中科院上海细胞库;RPMI1640培养基、胎牛血清购自BI公司;胰蛋白酶、双抗、ANNEXIN V-FITC/PI凋亡检测试剂盒及cck8试剂盒购自Solarbio公司;5-氮杂-2脱氧胞苷购自MCE公司;兔抗人p14ARF、兔抗人β-actin抗体、羊抗兔IgG、RIPA蛋白裂解液等试剂均购自Abcam公司;DNA提取试剂盒TIANamp Genomic DNAKit、重亚硫酸修饰试剂盒、甲基化pcr试剂盒购自北京天根生化公司。
1.2 细胞培养spca1培养于含有10%胎牛血清与1%青链霉素的RPMI1640培养基中,beas2b细胞培养于BEGM培养基中。培养箱条件为:5% CO2、37℃、饱和湿度。
1.3 DNA提取与修饰按TIANamp Genomic DNA Kit试剂盒说明提取细胞DNA,并测纯度在1.8~2.0,用重亚硫酸盐修饰试剂盒对提取的基因组DNA进行修饰。将所有经亚硫酸氢盐转化的DNA样品储存在-20℃直至后续PCR。
1.4 DAC处理根据细胞类型及是否进行去甲基化处理将细胞分为4组,spca1 DAC处理组、spca1对照组、beas2b DAC处理组、beas2b对照组,每组设置6个复孔,其中各处理组用10μM DAC处理4d。每天更换培养基和DAC。
1.5 NMSPNMPCR引物由文献中查得[5]。p14ARF外部引物是5'-TGGGTTTTAGTTTGTAGTTAA-3'(正向)和5'-CTCCTCAATAACATCAACAC-3'(反向)。甲基化特异性p14ARF引物是5'-TTTTTGGTGTTAAAGGGTGGTGTAGT-3'(未甲基化正向),5'-ACCACACACACACCAAATCCA-3'(未甲基化反向),5'-GTGTTAAAGGGCGGCGTAGC-3'(甲基化正向)和5'-CGC-GACGAACCGCACGCGCG-3'(甲基化反向)。对于亚硫酸氢钠修饰后的基因组DNA进行三轮PCR,第一轮产物使用外部引物,产物包含目的基因,再将第一轮产物进行第二轮PCR,实验步骤按照实验说明进行。最后得到的产物采用2%琼脂糖凝胶进行电泳。
1.6 Western blot用细胞刮擦除去细胞,并加入含有1%苯基甲磺酰氟(PMSF)的放射免疫沉淀测定(RIPA)裂解缓冲液。然后,将生产物在冰上孵育30min,并离心以除去细胞碎片。通过蛋白质定量试剂盒测定蛋白质浓度。在12%十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)上将50μg蛋白质以250mA转移至聚偏二氟乙烯(PVDF)膜。将膜在含有0.05%TBST和5%脱脂奶粉的TBS中在室温下封闭2h,然后加入1:500抗ARF抗体,1:1000 β-肌动蛋白抗体,在4℃保持过夜,用TBST洗涤。将膜孵育3次,然后与辣根过氧化物酶缀合的山羊抗兔二抗在37℃下孵育1h。使用ECL检测目的蛋白质。通过Image J软件定量条带的密度测定,实验重复3次。
1.7 流式细胞为了评估细胞凋亡,将4组细胞分别消化并调节密度为1×106/ml,用冷PBS洗涤两次并加入1ml binding buffer以在离心后打浆,用Annexin V-FITC和碘化丙啶(PI)对细胞进行荧光染色,由FCM检测细胞凋亡,实验重复3次。
1.8 统计学方法用SPSS进行统计学分析。实验数据以x±s表示。通过Student's t检验分析两个独立组之间的差异。检验水准为α= 0.05。
2 结果 2.1 p14启动子区域甲基化状态通过NMSP对spca1及beas2b细胞系进行p14基因启动子区甲基化状态进行检测,结果显示spca1细胞系p14基因启动子区呈甲基化状态,而beas2b此区域无甲基化。见图 1。
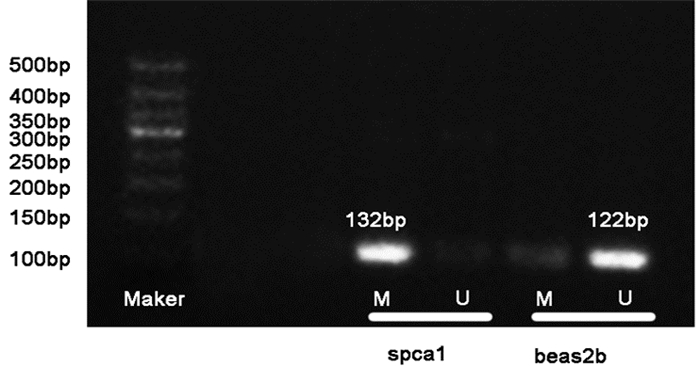
|
图 1
各组细胞p14基因启动子甲基化情况
注:Maker, 分子量标记物;M, p14启动子甲基化; U, p14启动子非甲基化 |
我们用DAC使细胞spca1及beas2b细胞中的p14基因启动子区去甲基化,通过Western blot检测ARF蛋白表达,结果显示DAC处理的spca1细胞恢复了ARF蛋白的表达,而beas2b细胞DAC处理组与beas2b对照组表达无明显差异。这些结果表明去除p14启动子区域甲基化,可以使该蛋白重新表达。见图 2。
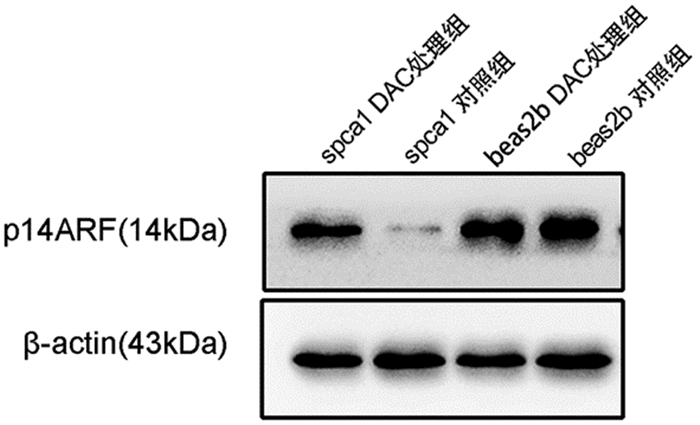
|
图 2 各组p14ARF蛋白表达情况 |
应用10μm DAC处理细胞96h后,经流式细胞检测,结果显示spca1 DAC处理组细胞凋亡率(20.69±1.03)%显著高于spca1对照组(10.63±0.82)%,差异有统计学意义(t=13.17,P < 0.05);而beas2b DAC处理组细胞凋亡率(7.38±0.36)%与beas2b对照组(6.98±0.42)%无显著差异,差异无统计学意义(t=1.25,P>0.05)。该结果显示p14基因的去甲基化诱导spca1细胞的凋亡。见图 3。
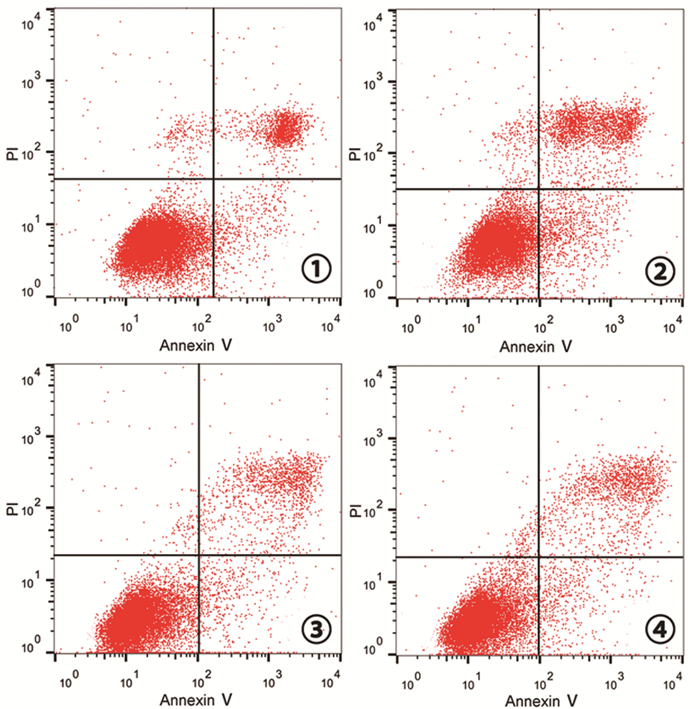
|
图 3
各组细胞凋亡情况
注:①spca1对照组;②spca1 DAC处理组; ③beas2b对照组; ④beas2b DAC处理组 |
随着对表观遗传学的不断深入研究发现,DNA甲基化作为表观遗传学的一部分,对于细胞正常的功能及癌症的发生发展都起到很重要的作用[6]。已有研究证明p14ARF在细胞中起到很多作用,p14作为抑癌基因主要通过中和E3泛素连接酶hMdm2对癌细胞的抑制作用来稳定和激活p53[7],也有证据表明它可以通过p53非依赖途径来起到促使细胞周期停滞或凋亡,从而起到抑癌的作用[8-9]。导致p14基因的失活的因素有很多,本文主要针对p14基因启动子区域甲基化进行研究,验证其对p14表达的影响。
本文首先通过NMSPCR检测发现,肺癌肿瘤细胞系spca1中p14ARF启动子区域存在异常甲基化状态,而人正常支气管上皮细胞系beas2b此基因并未表现出异常甲基化,因此可以说明此区域甲基化对于肺癌的发展具有一定影响,这与它在肝癌、膀胱癌、肠癌等癌症中的发现结果一致[10]。已经有研究证明,ARF的表达可以起到抑制癌症发生的作用[11]。本文结果显示spca1细胞系无ARF蛋白表达而beas2b细胞系此蛋白正常表达,证明p14ARF启动子区域甲基化抑制其蛋白的表达。
有研究表明,DAC通过抑制DNA甲基转移酶Ⅰ从而起到去甲基化的作用,从而可以恢复基因的作用[12]。因此,本文通过应用DAC处理spca1细胞系,使启动子异常甲基化的p14基因去除甲基化,恢复p14基因的表达。根据Western blot检测结果,验证了DAC可恢复ARF蛋白表达的猜测。现有的研究表明,细胞凋亡是调控细胞正常生长与增值的重要因素[13],而在癌细胞中细胞凋亡异常往往会导致癌细胞的异常增殖[14]。进而我们针对ARF恢复表达后对细胞凋亡的影响进行了检测,通过流式细胞凋亡检测显示DAC处理后spca1细胞系凋亡增加,而对于正常的beas2b细胞系以上检测结果均无明显差异。由此我们分析,这种差异的原因可能是恢复表达后的p14基因通过两条抑癌途径[15],促进肺腺癌细胞凋亡,因此,可以得出p14ARF基因启动子区域异常甲基化可以抑制ARF蛋白的合成从而抑制肺癌细胞凋亡,使肺癌细胞异常增值。
综上所述,本文结果表明去除肺癌p14ARF启动异常甲基化对肺癌生物学功能存在影响,可以将其作为一种肺癌治疗靶点,或者影响其他抗癌药物的敏感性,为后续药物的研究提供一个研究方向。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer Statistics, 2017[J]. CA Cancer J Clin, 2017, 67(1): 7-30. DOI:10.3322/caac.21387 |
| [2] |
JWP B, Mayo-de-Las-Casas C, Berenguer J, et al. The present and future of liquid biopsies in non-small cell lung cancer:combining four biosources for diagnosis, prognosis, prediction, and disease monitoring[J]. Curr Oncol Rep, 2018, 20(9): 70. DOI:10.1007/s11912-018-0720-z |
| [3] |
Mehta A, Dobersch S, Romero-olmedo AL, et al. Epigenetics in lung cancer diagnosis and therapy[J]. Cancer Metastasis Rev, 2015, 34(2): 229-241. DOI:10.1007/s10555-015-9563-3 |
| [4] |
Ito T, Nishida N, Fukuda Y, et al. Alteration of the p14(ARF) gene and p53 status in human hepatocellular carcinomas[J]. J Gastroenterol, 2004, 39(4): 355-361. DOI:10.1007/s00535-003-1302-9 |
| [5] |
Li L, Shen L, Wang M, et al. Tian.Identification of the methylation of p14 ARF promoter as a novel non-invasive biomarker for early detection of lung cancer[J]. Clinical & Translational Oncology, 2014, 16(6): 581-589. DOI:10.1007/s12094-013-1122-1 |
| [6] |
Koch A, Joosten SC, Feng Z, et al. Analysis of DNA methylation in cancer:location revisited[J]. Nat Rev Clin Oncol, 2018, 15(7): 459-466. DOI:10.1038/s41571-018-0004-4 |
| [7] |
Sharpless NE. INK4 a/ARF:a multifunctional tumor suppressor locus[J]. Mutat Res, 2005, 576(1-2): 22-38. DOI:10.1016/j.mrfmmm.2004.08.021 |
| [8] |
Weber JD, Jeffers JR, Rehg JE, et al. p53-independent functions of the p19(ARF) tumor suppressor[J]. Genes Dev, 2000, 14(18): 2358-2365. DOI:10.1101/gad.827300 |
| [9] |
Müer A, Overkamp T, Gillissen B, et al. p14(ARF)-induced apoptosis in p53 protein-deficient cells is mediated by BH3-only protein-independent derepression of Bak protein through down-regulation of Mcl-1 and Bcl-xL proteins[J]. J Biol Chem, 2012, 287(21): 17343-17352. DOI:10.1074/jbc.M111.314898 |
| [10] |
Ozenne P, Eymin B, Brambilla E, et al. The ARF tumor suppressor:structure, functions and status in cancer[J]. Int J Cancer, 2010, 127(10): 2239-2247. DOI:10.1002/ijc.25511 |
| [11] |
Zindy F, Williams RT, Baudino TA, et al. Arf tumor suppressor promoter monitors latent oncogenic signals in vivo[J]. Proc Nati Acad Sci USA, 2003, 100(26): 15930-15935. DOI:10.1073/pnas.2536808100 |
| [12] |
Karahoca M, Momparler RL. Pharmacokinetic and pharmacodynamic analysis of 5-aza-2'-deoxycytidine (decitabine) in the design of its dose-schedule for cancer therapy[J]. Clin Epigenetics, 2013, 5(1): 3. DOI:10.1186/1868-7083-5-3 |
| [13] |
Fuchs Y, Steller H. Programmed cell death in animal development and disease[J]. Cell, 2011, 147(4): 742-758. DOI:10.1016/j.cell.2011.10.033 |
| [14] |
Shivapurkar N, Reddy J, Chaudhary PM, et al. Apoptosis and lung cancer:a review[J]. J Cell Biochem, 2003, 88(5): 885-898. DOI:10.1002/jcb.10440 |
| [15] |
Ko A, Han SY, Song J. Regulatory network of ARF in cancer development[J]. Mol Cells, 2018, 41(5): 381-389. DOI:10.14348/molcells.2018.0100 |



