在体内维持蛋白质稳态平衡对于生物体来说至关重要,而该平衡的维持主要依靠泛素蛋白质酶系统[1]以及自噬-内溶酶体系统[2]。在泛素蛋白酶系统中,泛素通过泛素激活酶、结合酶和连接酶的作用结合到蛋白质底物上,作为蛋白降解的标志被28S蛋白酶复合体所识别启动蛋白质的降解[1]。除了参与蛋白降解外,泛素化修饰也是生物体蛋白质翻译后修饰的一种重要形式,几乎在所有功能细胞内部发挥着重要的作用,这些作用包括蛋白质降解,DNA损伤反应,应激和细胞内信号转导等[3]。
泛素最初是从牛胸腺中分离出来,随后发现泛素高度保守,普遍存在于从原生动物到脊椎动物的活细胞中,由分子量为8.4~8.5kDa的74~76个氨基酸残基组成[4]。泛素研究主要集中于高等动植物体内,但是对于海洋无脊椎动物的研究较少,目前仅在拟穴青蟹[5]、太平洋牡蛎[6]等物种中有所报道。单环刺螠属于螠虫动物门,螠纲,无管螠目,刺螠属,是居住在潮间带和潮下带U型洞穴的海洋无脊椎生物,也是无管螠目在我国存在的唯一物种[7]。本文以单环刺螠为研究对象,克隆单环刺螠泛素基因,分析其结构特征及其器官分布规律,为单环刺螠泛素基因功能的进一步研究提供理论依据。
1 材料与方法 1.1 材料 1.1.1 动物单环刺螠购买于山东省日照市石臼水产市场,产地为烟台近海潮间带,于实验室内通气人工海水(18℃、pH 7.8和盐度26)不投饵暂养。
1.1.2 取样暂养3天后,挑取6只个体对体壁、肛门囊、中肠、后肠和体腔液进行取样,液氮冻存,-80℃长期保存。
1.1.3 仪器及试剂试剂主要为Trizol(上海生工)、乙醇(国药集团)、氯仿(国药集团)、异丙醇(国药集团)、琼脂糖(上海生工)、Golden View(Solarbio)、cDNA反转录试剂盒Primescript RT reagent Kit With gDNA Eraser(Takara)和荧光定量试剂盒TB Green Premix Ex Taq(Takara),引物由上海生工公司合成。
仪器主要为PCR仪(Biorad S100)、电泳仪(北京六一)、凝胶成像(Biorad GelDoc XR)和荧光定量PCR仪(Biorad CFX Connect)。
1.2 方法 1.2.1 RNA提取及cDNA合成采用Trizol法提取单环刺螠器官mRNA,将0.1 g组织加入1ml Trizol溶液中,电动匀浆器匀浆,根据Trizol说明书的步骤提取RNA,1.2%琼脂糖凝胶电泳检测质量。随后根据Takara反转录试剂盒Primescript RT Reagent Kit with gDNA Eraser(Takara)说明书的流程反转录RNA,获得cDNA。
1.2.2 单环刺螠泛素基因的克隆及分析利用太平洋牡蛎泛素基因(注册号:JQ030888)在单环刺螠转录组(注册号:SRA122323)中进行BLAST搜索,获得单环刺螠泛素的相似序列,随后利用开放阅读框(open reading frame, ORF)finder确定序列的ORF,设计ORF验证引物(表 1)进行PCR,模板1μl,2 × PCR Mix 5μl(上海生工),正向引物(2μM)4μl,反向引物(2μM)4μl,水6μl,总体积为20μl。混匀离心后,行PCR扩增,96℃预变性10 min;96℃ 30s,45℃退火30s,72℃延伸30s,35个循环;72℃延伸5min。随后对PCR产物测序验证。确定后利用NCBI查找其他物种泛素基因序列,利用CLUSTAL X2对其进行多序列比对,获得其保守序列;利用MEGA 7软件采用邻位相连法对其进行进化分析。
| 表 1 PCR引物序列 |
利用qRT-PCR对单环刺螠泛素基因在各个器官中的表达分布规律进行分析。将反转录的cDNA模板利用TB GreenTM Premix Ex TaqTM试剂盒(Takara)行在进行qRT-PCR检测,2×TB Green Premix Ex Taq 10μl、正、反向引物(2mM)各4μl,模板2μl。反应程序为95℃预变性10min;95℃变性15s,60℃退火延伸1min,40个循环;随后进行溶解曲线反应验证产物扩增的特异性。β-actin作为内参基因,2-ΔΔCt方法来确定目的基因的相对表达。引物见表 1。
1.3 统计学方法所有数据均以x±s表示,利用SPSS 18.0统计分析软件进行数据分析。
2 结果 2.1 单环刺螠泛素基因的克隆利用已知的与单环刺螠在进化上关系最近的太平洋牡蛎泛素基因在单环刺螠转录组中进行BLAST获得单环刺螠泛素序列,全长500 bp,利用ORF Finder发现其ORF在37~270位点,长度234 bp,利用设计的ORF引物(表 1)行PCR验证,其电泳结果如图 1所示,PCR后获得单一条带,大小在250 bp左右,与预测大小基本一致,测序公司测序确定结果与转录组结果一致。
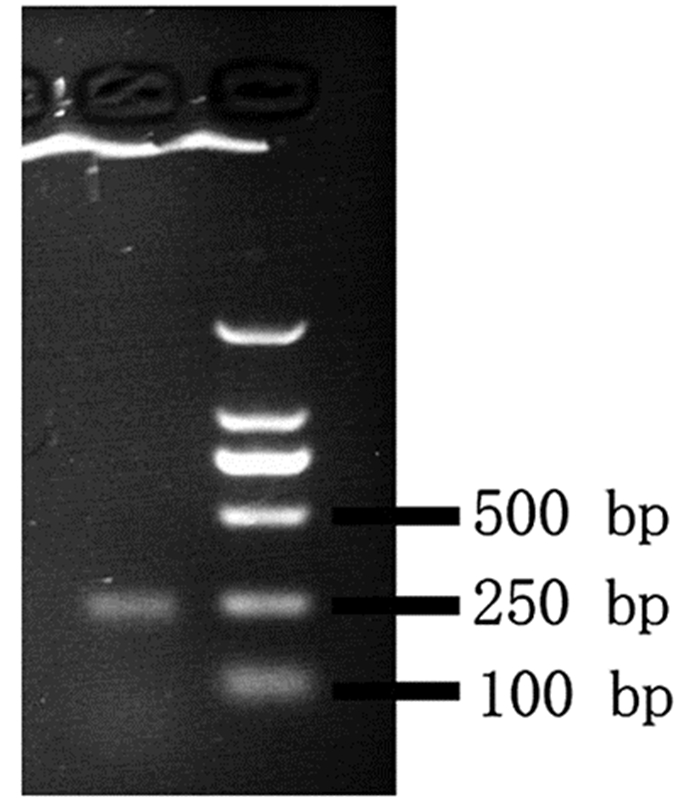
|
图 1 单环刺螠泛素ORF验证 |
其序列特征如图 2所示,序列全长500 bp,ORF长度234 bp,编码76个氨基酸,分子式C382H638N106O119S1,含有1246个原子,相对分子质量为8651.97,等电点是6.56。

|
图 2 单环刺螠泛素基因及其推导的氨基酸序列 |
利用多序列比对分析发现,单环刺螠的泛素基因序列与其他物种的泛素基因具有高度的一致性,仅仅只有C端的一个氨基酸序列不同(图 3)。根据其多序列比对结果利用MEGA7.0构建进化树,单环刺螠与无脊椎动物聚为一枝,再与高等脊椎动物聚为一枝,与进化关系基本保持一致。见图 4。
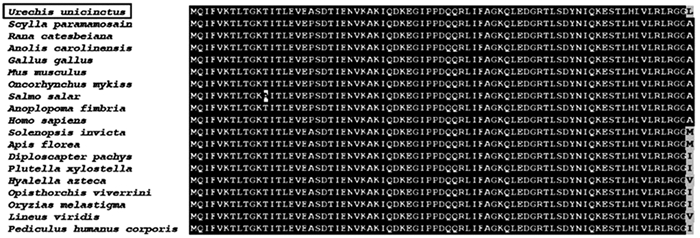
|
图 3 泛素序列比对分析图 |

|
图 4 泛素进化分析 |
分析单环刺螠泛素基因在单环刺螠各个器官中的表达规律,体腔液中表达量最低,其次是肠道,后肠的表达量是体腔液的2.39倍,中肠是2.78倍,然后是体壁,表达量是体腔液表达量的3.46倍,而肛门囊表达量最高,达到体腔液表达量的4.55倍。除体腔液外,其他器官中泛素基因的相对表达量无统计学差异(P>0.05)。见图 5。

|
图 5 单环刺螠泛素基因在单环刺螠各器官分布规律(x±s,n=4) 注:与体腔液泛素基因mRNA相比,*P < 0.05。 |
泛素蛋白质酶系统一直是生物科学的研究热点之一,泛素蛋白与目标蛋白的共价结合介导蛋白的选择性降解是泛素参与的经典途径,这一途径广泛存在于真核生物中[8]。因此,为了维持功能的稳定,泛素基因序列从高等无脊椎动物到低等的真菌具有高度的保守性,例如人和酵母的泛素基因仅有3个氨基酸残基的差别[9]。本研究克隆得到的单环刺螠泛素基因蛋白质序列与其他物种的序列也具有极高的保守性,仅仅在C端存在着一个氨基酸的不同,这些结果进一步说明泛素基因在生物进化过程中具有相同的祖先,而且进化过程中为了维持功能的稳定,序列几乎不发生变异,从另外角度也证明了其功能的重要性。
单环刺螠泛素基因在各器官中广泛存在,而且除体腔液外在其他器官中的表达量无统计学差异,这一结果恰好与泛素基因的名字在各组织中广泛存在相对应,这也与拟穴青蟹中泛素在各器官中的分布规律一致[5]。但是泛素基因在精卵发生过程中发挥着重要作用,其表达量会出现显著性的变化,例如在小鼠精原细胞中含量很低,精母细胞含量开始升高,到达精子表达量最高[10]。对于单环刺螠来说,其体腔液中会存在大量生殖细胞[11-12],这会导致泛素基因的相对表达量改变。此外,泛素参与的非经典途径参与多种生理生化反应,在低等的海洋无脊椎动物中,泛素具有抗菌的特性[6],单环刺螠泛素的功能需要进一步的研究。
| [1] | Ciechanover A. Theubiquitin-proteasomeproteolytic pathway[J]. Cell, 1994, 79(1): 13–21. DOI:10.1016/0092-8674(94)90396-4 |
| [2] | Pillay CS, Elliott E, Dennison C. Endolysosomal proteolysis and its regulation[J]. Biochemical Journal, 2003, 363(3): 417–429. DOI:10.1042/bj3630417 |
| [3] | 张宏, 杜亚琼, 李凤良, 等. 小菜蛾泛素基因的克隆与分析[J]. 南京师大学报(自然科学版), 2013, 36(3): 116–119. DOI:10.3969/j.issn.1001-4616.2013.03.022 |
| [4] | Schlesinger D H, Goldstein G. Molecular conservation of 74 amino acid sequence of ubiquitin between cattle and man[J]. Nature, 1975, 255(5507): 423–424. DOI:10.1038/255423a0 |
| [5] | 戴燕彬, 韩坤煌, 颜素芬, 等. 拟穴青蟹泛素基因的克隆及其在性腺发育过程中的表达[J]. 中国水产科学, 2012(6): 946–955. DOI:10.3724/SP.J.1118.2012.00946 |
| [6] | Seo JK, Min JL, Go HJ, et al. Purification and antimicrobial function of ubiquitin isolated from the gill of Pacific oyster, Crassostrea gigas[J]. Molecular Immunology, 2013, 53(1-2): 88–98. DOI:10.1016/j.molimm.2012.07.003 |
| [7] | 刘峰, 孙涛, 纪元, 等. 单环刺螠生物学及生态学研究进展[J]. 海洋科学, 2017, 41(10): 125–131. DOI:10.11759/hykx20170414001 |
| [8] | 黄新敏, 张艳霞, 万小荣. 泛素蛋白的研究进展[J]. 广东农业科学, 2010, 37(6): 191–194. DOI:10.3969/j.issn.1004-874X.2010.06.079 |
| [9] | 王金昌, 李燕萍. 泛素-蛋白酶体途径的生物学功能[J]. 江西科学, 2006, 24(2): 54–57, 85. DOI:10.3969/j.issn.1001-3679.2006.02.016 |
| [10] | 于晖, 王永潮, 费仁仁, 等. 小鼠精子发生过程中泛素的表达[J]. 发育与生殖生物学学报(英文版), 2001(S1): 32. |
| [11] | 王航宁, 邵明瑜, 张志峰. 单环刺螠精巢年周期发育及精子发生[J]. 中国水产科学, 2011, 18(5): 1189–1195. DOI:10.3724/SP.J.1118.2011.01189 |
| [12] | 李昀, 王航宁, 邵明瑜, 等. 单环刺螠生殖腺的发生及雌体的生殖周期[J]. 中国海洋大学学报(自然科学版), 2012, 42(6): 85–88. DOI:10.3969/j.issn.1672-5174.2012.06.013 |

