2. 济宁医学院, 济宁 272067
2. Jining Medical University, Jining 272067, China
炎症性肠病(inflammatory bowel disease, IBD)是一组累及肠道的慢性非特异性炎症疾病,主要包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn’s disease, CD)。其病因和发病机制尚不明确,但有研究表明,机体多种免疫成分在IBD的发病过程中扮演着十分重要的角色,如T细胞、NK细胞等免疫细胞浸润以及IL-6、TNF-α、IFN-γ等细胞因子的大量分泌[1-3]。目前我国UC发病率明显高于CD,UC患病率在近10年里显著增加[4]。
IL-16是一种免疫分子,在多种细胞生命活动和疾病发生中起重要作用,与风湿性关节炎、过敏性哮喘、肾移植等有密切的关系,有数据显示IL-16在IBD患者体内高表达[5]。目前,IL-16在IBD中的作用和功能尚不明确。本文拟利用恶唑酮诱导建立小鼠IBD模型,观察IL-16在IBD中的表达水平,进一步探究IL-16在IBD中的作用和功能。
1 材料和方法 1.1 材料 1.1.1 动物与分组C57BL/6小鼠,雌性,7周龄,体重约18g,购于济南朋悦实验动物技术有限公司,SPF级饲养。20只C57BL/6小鼠适应喂养1周后,随机分为正常对照组和模型组, 各10只。动物实验符合实验动物福利和动物伦理学要求。
1.1.2 试剂器材恶唑酮(Sigma公司);Trizol、反转录试剂盒(美国Thermo Fisher公司);SYBR Green MasterMix(美国Vazyme公司);IL-16 ELISA试剂盒(武汉华美公司)。
1.2 方法 1.2.1 IBD模型的建立及标本采集小鼠腹腔注射3%戊巴比妥钠致麻,暴露小鼠背部皮肤0.2cm×0.2cm,分别在第1、2天用0.2ml的3%恶唑酮(溶于100%乙醇中)涂擦皮肤致敏1次,对照组用100%乙醇涂抹皮肤,5d后将直径约1.5mm细导管插入小鼠肛门约4cm处,100μl 1%恶唑酮(溶于100%乙醇中)灌肠,注入后捏紧肛门倒置小鼠约1min,以便药液与结肠充分接触,对照组同样做100%乙醇处理,待麻醉清醒后正常喂养,7d后重复灌肠1次。7d后眼球取血处死小鼠,75%乙醇浸泡消毒5min,置动物于解剖台,固定四肢,剪开腹壁暴露腹腔分离全结肠,冲洗干净内容物保存样本。
1.2.2 HE染色取部分结肠组织冲洗干净内容物,卷起固定于4%多聚甲醛,经脱水透明、浸蜡包埋、切片、脱蜡染色等步骤制作HE染色组织切片。
1.2.3 实时荧光定量PCR取部分结肠组织剪碎,加入5ml 0.01%胶原酶中37℃温箱孵育1.5h,1500rpm离心5min收集细胞,加入700μl Trizol提取总RNA,RevertAid FirstStand cDNA Synthesis Kit反转录试剂盒合成cDNA,按照说明书进行实时荧光定量PCR反应。甘油醛-3-磷酸脱氢酶(GAPDH)作为内参对照,引物序列如下:
IL-16
上游引物:5’-AGTGAGAACCAT AGCCATACA-3’
下游引物:5’-ACCCAGGAGACCAGAAAA-3’
GAPDH
上游引物:5’- CTAGAG AGCTGACAGTGGG-TAT-3’
下游引物:5’-AGACGACCAATGCGTCCAAA-3’
1.2.4 ELISA检测取部分结肠组织剪碎加入500μl RIPA强裂解液中,强烈涡旋充分裂解后14000rpm离心5min,取上清,使用IL-16的ELISA试剂盒检测其在结肠组织中的浓度,按照试剂盒说明书操作。
1.3 统计学方法数据采用GraphPad Prism 5统计软件进行分析。
2 结果 2.1 两组小鼠体重变化、全结肠长度及结肠HE染色情况与正常对照组相比,恶唑酮诱导模型组小鼠体重从第4天开始显著降低且具有统计学差异,造模期间模型组小鼠便血较为严重,解剖分离小鼠全结肠可见模型组小鼠结肠充血、水肿,粪便不成颗粒状。镜下观察小鼠结肠HE染色切片,模型组小鼠结肠黏膜上皮细胞脱落、糜烂和溃疡形成,杯状细胞减少,肠腺萎缩或消失,密度减低。见图 1。
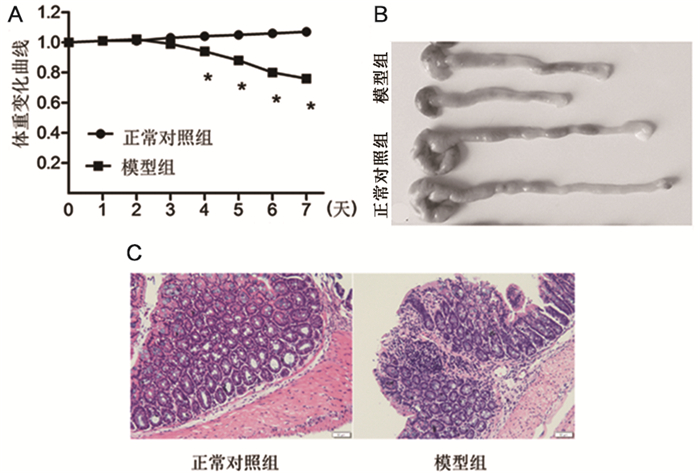
|
图 1 两组小鼠体重变化,全结肠长度及结肠HE染色情况 注:A.小鼠造模期间体重变化及体重变化曲线;B.两组小鼠全结肠照片;C.两组小鼠部分结肠制作切片HE染色,200×镜下观察组织损伤; 与正常对照组相比,*P < 0.05。 |
与正常对照组相比,模型组小鼠结肠组织IL-16 mRNA水平表达明显升高,差异具有统计学意义(t=5.80,P < 0.05)。与正常对照组相比,模型组小鼠结肠组织中IL-16蛋白水平明显升高,差异具有统计学意义(t=44.62,P < 0.05)。见图 2。

|
图 2 两组小鼠结肠IL-16及IL-16 mRNA的表达情况 注:A.两组小鼠结肠组织IL-16 mRNA表达;B.两组结肠组织中IL-16蛋白水平的变化;与正常对照组相比,*P < 0.05。 |
恶唑酮诱导的IBD模型小鼠结肠炎是一种IL-4介导的以一种IL-4/IL-5细胞因子表达量升高为主的Th2型炎症,其组织学特征主要表现为上皮细胞缺失导致糜烂和浅溃疡的形成,杯状细胞和腺体密度降低,黏膜和黏膜下层可见多种炎性细胞浸润,恶唑酮诱导的炎症性肠炎这些特征与人类IBD患者最相似[6]。因此,我们利用恶唑酮诱导小鼠肠炎模型来探究IBD的病因和发病机制,为临床治疗提供依据。
IL-16不仅可以作为一种T细胞的趋化因子、对T细胞的增殖具有一定的促进作用[7],还可以趋化活化的单核细胞、树突状细胞以及嗜酸性粒细胞[8],IL-16还参与急性间质性肾炎的发生发展[9]。目前已有临床报道显示IBD患者血清中IL-16异常表达[10]。研究表明,IBD尤其是UC的发病过程中T细胞、巨噬细胞、骨髓来源的抑制性细胞[11]等免疫细胞均发挥重要的生理作用。由此,本文主要观察IL-16在炎症性肠病是否通过调控某种或多种免疫细胞从而参与炎症性肠病的发生发展过程。
本文结果显示建模过程中IBD模型小鼠较正常对照组小鼠体重逐渐下降且从第4天开始小鼠伴随腹泻和便血,全结肠HE染色也显示经典的肠炎损伤,这表明恶唑酮诱导的IBD模型成功建立。随后我们发现IBD模型组小鼠结肠组织中IL-16 mRNA水平和蛋白水平的表达均具有显著性的增强,说明IL-16的高表达可能参与小鼠IBD的发病。已有的研究中提及IL-16主要由T细胞分泌作用于自身或趋化其他免疫细胞参与炎症的发生发展,提示IL-16对IBD模型中效应细胞具有一定的调控作用。
综上所述,本研究采用恶唑酮成功诱导小鼠IBD模型,并发现IL-16在恶唑酮诱导的IBD模型小鼠全结肠组织中高表达,但是IL-16参与IBD中的具体调控机制尚不清楚,这是我们接下来进一步的研究方向。
| [1] | Giuffrida P, Corazza GR, Di Sabatino A. Old and new lymphocyte players in inflammatory bowel disease[J]. Dig Dis Sci, 2018, 63(2): 277–288. DOI:10.1007/s10620-017-4892-4 |
| [2] | 谢睿, 李全朋, 缪林. 炎症性肠病免疫发病机制研究进展[J]. 医学研究生学报, 2013, 26(2): 206–210. DOI:10.3969/j.issn.1008-8199.2013.02.024 |
| [3] | 董冠军, 司传平. IFN-α在SLE发生发展中的作用[J]. 济宁医学院学报, 2016, 39(1): 6–11. DOI:10.3969/j.issn.1000-9760.2016.01.002 |
| [4] | Jiang XL, Cui HF. An analysis of 10218 ulcerative colitis cases in China[J]. World J Gastroenterol, 2002, 8(1): 158–161. DOI:10.3748/wjg.v8.i1.158 |
| [5] | Singh UP, Singh NP, Murphy EA, et al. Chemokine and cytokine levels in inflammatory bowel disease patients[J]. Cytokine, 2016, 77: 44–49. DOI:10.1016/j.cyto.2015.10.008 |
| [6] | Kojima R, Kuroda S, Ohkishi T, et al. Oxazolone-induced colitis in BALB/C mice:a new method to evaluate the efficacy of therapeutic agents for ulcerative colitis[J]. J Pharmacol Sci, 2004, 96(3): 307–313. DOI:10.1254/jphs.fp0040214 |
| [7] | Conti P, Kempuraj D, Kandere K, et al. Interleukin-16 network in inflammation and allergy[J]. Allergy Asthma Proc, 2002, 23(2): 103–108. |
| [8] | Cruikshank W, Little F. lnterleukin-16:the ins and outs of regulating T-cell activation[J]. Crit Rev Immunol, 2008, 28(6): 467–483. DOI:10.1615/critrevimmunol.v28.i6.10 |
| [9] | Zand L, Monaghan M, Griffin BR, et al. The role of type Ⅰ hypersensitivity reaction and IgE-mediated mast cell activation in acute interstitial nephritis[J]. Clinical Nephrology, 2015, 84(9): 138–144. DOI:10.5414/cn108254 |
| [10] | Middel P, Reich K, Polzien F, et al. Interleukin 16 expression and phenotype of interleukin 16 producing cells in Crohn's disease[J]. Gut, 2001, 49(6): 795–803. DOI:10.1136/gut.49.6.795 |
| [11] | Kontaki E, Boumpas DT, Tzardi M, et al. Aberrant function of myeloid-derived suppressor cells(MDSCs)in experimental colitis and in inflammatory bowel disease(IBD)immune responses[J]. Autoimmunity, 2017, 50(3): 170–181. DOI:10.1080/08916934.2017.1283405 |



