百草枯是一种效果优异且被广泛使用的除草剂,如果使用得当,其效果极佳[1]。Weidel和Rosso于1882年首次发现了百草枯,但是,直到1962年,百草枯才被作为除草剂被Syngenta公司引入农业市场[2]。百草枯可以快速高效地杀除众多杂草和种子,在世界范围内得到了广泛地应用。百草枯是一把双刃剑,在过去的几十年里,它也严重威胁着人类的健康。百草枯可以在肺部集中,其在肺部的浓度为在血浆中浓度的6~10倍,进而引起肺部纤维化,现有医疗条件很难治愈肺部纤维化,导致百草枯中毒后死亡率极高。
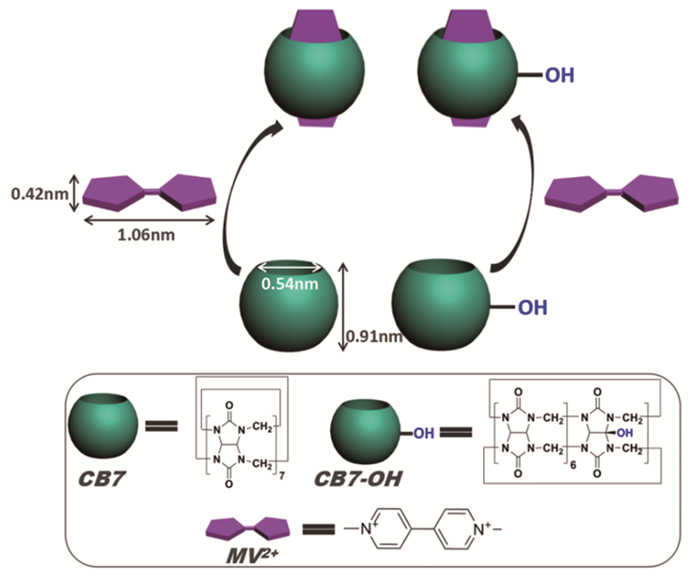
葫芦[n]脲是一类由甘脲通过亚甲基桥连而成的环状化合物,根据甘脲数目的不同,可以分为葫芦[5]脲、葫芦[6]脲、葫芦[7]脲和葫芦[8]脲等[3]。尽管1905年Behrend等首次合成出了葫芦[6]脲[4],直到1981年Mock等才充分表征出了其分子结构,葫芦[6]脲为具有疏水性空腔的南瓜状分子[5]。在众多的葫芦[n]脲中,葫芦[7]脲(CB7)以其良好的水溶性和适中的分子尺寸,得到了广泛地研究[6-9]。CB7是7个甘脲通过亚甲基桥连而成南瓜状分子(图 1),可以通过主客体识别作用包合带有正电荷的分子如二茂铁和金刚烷的衍生物等[10-11]。CB7衍生化比较难,Ouari等报道了一种光化学催化方法,成功合成了单羟基葫芦[7]脲(CB7-OH),产率较高[12]。
|
图 1 葫芦[7]脲(CB7)、单羟基葫芦[7]脲(CB7-OH)和百草枯(MV2+)的分子结构以及CB7和CB7-OH对MV2+的包合机理图 |
在本研究中,我们首先通过光化学反应合成出了CB7-OH纯品。然后通过连续滴定的方法分别测试了CB7和CB7-OH与百草枯在尿素溶液中的包合常数。研究发现,在尿素溶液中,CB7和CB7-OH与百草枯的包合常数均比较大。由于人体血清中含有蛋白质的代谢产物尿素,因而,CB7和CB7-OH有望实现对血清中百草枯的吸附,进而起到解毒的功效。
1 实验部分 1.1 试剂与仪器百草枯、双氧水、尿素和MCI GEL CHP20P固定相(上海阿拉丁生化科技股份有限公司);紫外光化学反应器(Rayonet);电喷雾质谱(API 4000 MS);1H核磁共振(布鲁克Avance 300 M);紫外可见分光光度计(UV-2600,日本岛津)。
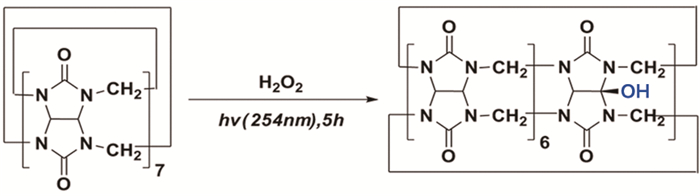
1.2 CB7-OH的合成称取0.5mmol CB7于石英反应管中,加入干净的磁子,加入25ml盐酸溶液。然后向CB7溶液中加入2mmol双氧水,通氮气,于紫外光化学反应器中,反应5h。旋转蒸发仪干燥,以MCI GEL CHP20P固定相装填色谱柱,以水为流动相进行柱层析,收集流出液,电喷雾质谱检测成分,旋转蒸发仪干燥,即可得CB7-OH纯品。见图 2。
|
图 2 以CB7为原料通过光化学反应合成CB7-OH的反应方程式 |
在比色皿中加入2.5ml二茂钴溶液,然后用移液枪向比色皿中加入不同体积的CB7-OH溶液,使用紫外分光光度计测定不同含量CB7-OH溶液的吸光度。取出261nm处的吸光度值,作图,利用公式MWeff=(Cep/C)×MW,即可算出CB7-OH的表观分子量。
1.4 百草枯在尿素溶液中的摩尔吸光系数将一定摩尔量的百草枯溶于8 M的尿素溶液中,配制5~40μM的系列溶液,使用紫外分光光度计测定系列溶液的吸光度,取最大吸光度值作图,根据朗伯-比尔定律即可计算出百草枯在尿素溶液中的摩尔吸光系数。
1.5 包合常数的测定配制不同比例的CB7或者CB7-OH与百草枯的尿素溶液,使用紫外分光光度计测定系列溶液的吸光度,取最大吸光度值,使用PSI-Plot软件模拟计算,可得主客体分子之间的包合常数。
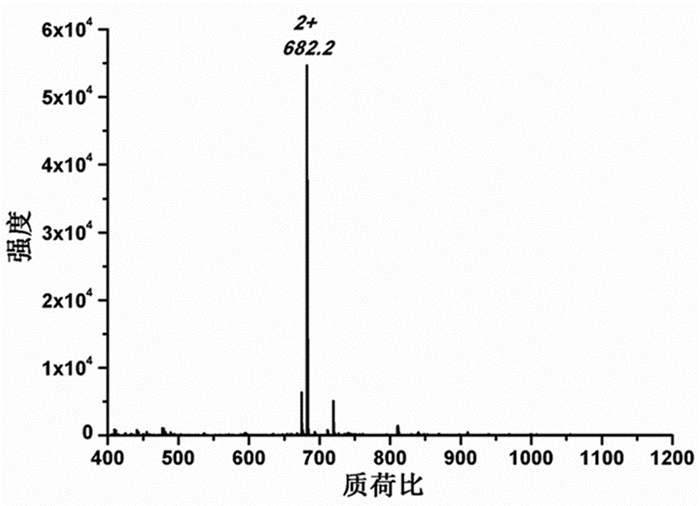
2 结果与讨论 2.1 CB7-OH的合成及表征通过光化学反应,我们可以得到CB7-OH粗品。通过柱层析,我们可以得到CB7-OH纯品。CB7-OH不带电荷,为电中性分子,所以在进行电喷雾质谱分析时,需要向CB7-OH体系中加入一定量的甲基紫精作为电荷源,测试其分子离子峰。在电喷雾质谱中出现了一个非常强的分子离子峰,峰值为682.2。CB7-OH相对分子质量为1178g/mol,甲基紫精相对分子质量为186g/mol,甲基紫精带有两个单位的正电荷。因此,CB7-OH与甲基紫精包合物的质荷比为682,该数值与电喷雾质谱结果十分吻合,初步证明我们合成了CB7-OH纯品。见图 3。
|
图 3 CB7-OH的质谱表征结果 |
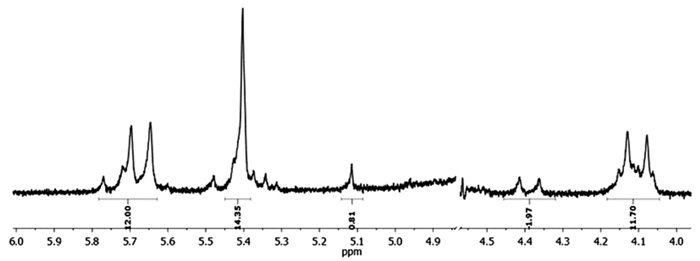
我们进一步使用1H核磁表征了CB7-OH的分子结构。CB7-OH分子的1H核磁结果中氢的具体归属如下:(300MHz, D2O)δH 5.77-5.63(12H, m), 5.44-5.36(14H, m), 4.99(1H, s), 4.41-4.35(2H, d, J=9), 4.16-4.07(12H, m)。该结果与文献报道的结果一致[12]。因此,我们成功合成了CB7-OH纯品。见图 4。
|
图 4 CB7-OH的1H核磁表征结果 |
CB7-OH,与CB7一样,是具有空腔结构的分子,容易吸收空气中的气体和水分,导致其分子质量的改变。因而,在使用CB7-OH之前,需要测试其表观相对分子质量,以减少称量误差。我们采用连续滴定法[13],测试了不同比例的CB7-OH和二茂钴系列水溶液的紫外吸收,取最强吸收处的吸光度值作图,可得到两条相交的直线,根据公式MWeff =(Cep/C)×MW,即可算出CB7-OH的表观分子量为1419g/mol。见图 5。

|
图 5 紫外测定CB7-OH的表观相对分子质量 |
在测试CB7和CB7-OH与百草枯在尿素溶液中的包合常数时,我们首先需要测试百草枯在尿素溶液中的摩尔吸光系数。使用紫外分光光度计,我们测试了5~40μm之间5个浓度的百草枯在8M尿素溶液中的紫外吸收。取最强吸收处的吸光度值作图,可得到一条直线,根据朗伯-比尔定律,可以求得其摩尔吸光系数为11000M-1·cm-1。见图 6。
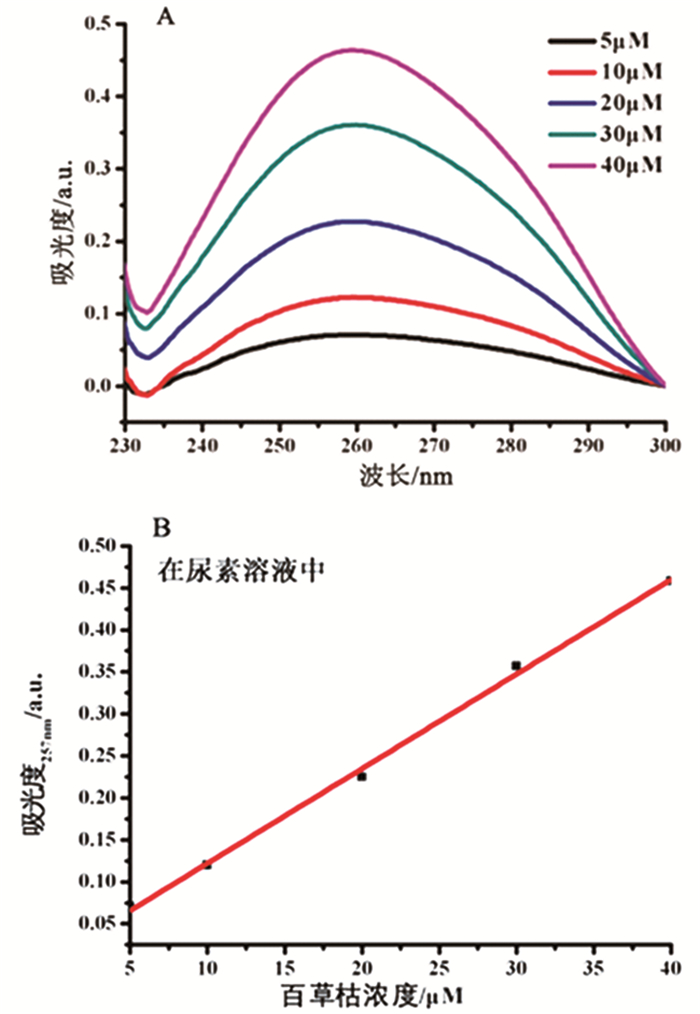
|
图 6 紫外测定百草枯在尿素溶液中的摩尔吸光系数 |
如图 1所示,CB7是具有空腔结构的南瓜状分子,两端端口处共有14个羰基,布满了电子云团,因而容易与一些分子尺寸契合且带有正电荷的分子结合形成包合物[14]。已有文献报道了CB7空腔最窄处为0.54nm,分子高度为0.91nm[15]。利用Materials Studio 5.5软件,我们计算出了百草枯分子的尺寸,分子宽为0.42nm,分子长为1.06nm。百草枯分子的尺寸刚好与CB7空腔契合。此外,百草枯分子两端带有两个正电荷,容易受到CB7端口处羰基吸引,使得CB7和百草枯之间形成稳定的包合物。虽然,CB7和百草枯的包合已有研究[16],但是CB7和百草枯在尿素溶液中的包合常数还未被报道。如图 7中A和B所示,经过两次实验,通过连续滴定的方法,利用PSI-Plot软件模拟计算,可得CB7和百草枯在尿素溶液中的包合常数分别为35803M-1和35775M-1,平均值为35789M-1。

|
图 7 CB7与百草枯在尿素溶液中的包合常数 |
与CB7结构类似,CB7-OH也是南瓜状分子(图 1),因而也容易与百草枯进行包合。作为一种新颖的CB7衍生物,CB7-OH研究较少,目前,CB7-OH和百草枯在尿素溶液中的包合常数也未被报道。如图 8中A和B所示,经过两次实验,通过连续滴定的方法,利用PSI-Plot软件模拟计算,测得CB7-OH和百草枯在尿素溶液中的包合常数分别为36802M-1和38566M-1,平均值为37684M-1。
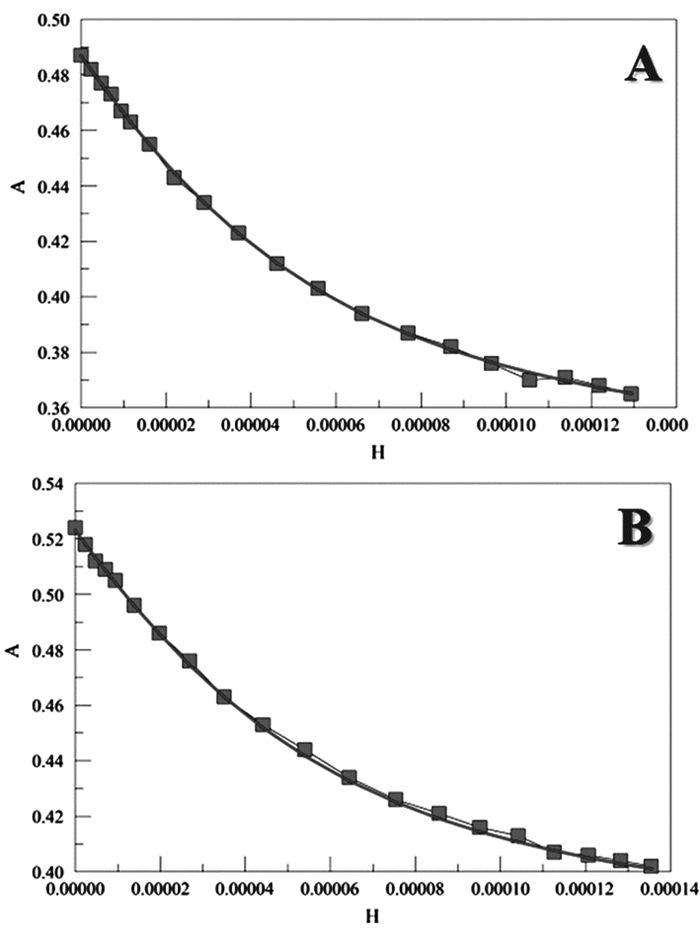
|
图 8 CB7-OH与百草枯在尿素溶液中的包合常数 |
在紫外光催化下,我们成功地合成出了CB7-OH,并利用ESI质谱和1H核磁对其结构进行了充分表征。使用紫外分光光度计,我们分别测试出了CB7-OH的表观相对分子质量以及百草枯在尿素溶液中的摩尔吸光系数。最后,通过连续滴定法,发现在尿素溶液中,CB7和CB7-OH均可以和百草枯进行有效地包合,包合常数相近,且包合常数均比较大。因此,CB7和CB7-OH有望实现对血清中百草枯的吸附,起到解毒的功效,为百草枯中毒的治疗提供了新的可能。
| [1] | Suntres ZE. Role of antioxidants in paraquat toxicity[J]. Toxicology, 2002, 180(1): 65–77. DOI:10.1016/s0300-483x(02)00382-7 |
| [2] | Dinis-Oliveira RJ, Duarte JA, Sáchez-Navarro A, et al. Paraquat poisonings:mechanisms of lung toxicity, clinical features, and treatment[J]. Crit Rev Toxicol, 2008, 38(1): 13–71. DOI:10.1080/10408440701669959 |
| [3] | Kim K, Selvapalam N, Oh DH. Cucurbiturils a new family of host molecules[J]. Journal of Inclusion Phenomena, 2004, 50(1): 31–36. DOI:10.1007/s10847-003-8835-7 |
| [4] | Lee JW, Samal S, Selvapalam N, et al. Cucurbituril homologues and derivatives:new opportunities in supramolecular chemistry[J]. Acc Chem Res, 2003, 36(8): 621–630. DOI:10.1021/ar020254k |
| [5] | Freeman WA, Mock WL, Shih N. Cucurbituril[J]. Journal of the American Chemical Society, 1981, 103: 7367–7368. DOI:10.1021/ja00414a070 |
| [6] | Gadde S, Batchelor EK, Weiss JP, et al. Control of H-and J-aggregate formation via host-guest complexation using cucurbituril hosts[J]. J Am Chem Soc, 2008, 130(50): 17114–17119. DOI:10.1021/ja807197c |
| [7] | Tootoonchi MH, Sharma G, Calles J, et al. Cooperative self-assembly of a quaternary complex formed by two cucurbit[7] uril hosts, cyclobis(paraquat-p-phenylene), and a "designer" guest[J]. Angew Chem Int Ed Engl, 2016, 55(38): 11507–11511. DOI:10.1002/anie.201606038 |
| [8] | Yi S, Li W, Nieto D, et al. Probing the tolerance of cucurbit[7] uril inclusion complexes to small structural changes in the guest[J]. Org Biomol Chem, 2013, 11(2): 287–293. DOI:10.1039/c2ob26834e |
| [9] | Barrow SJ, Kasera S, Rowland MJ, et al. Cucurbituril-based molecular recognition[J]. Chem Rev, 2015, 115(22): 12320–12406. DOI:10.1021/acs.chemrev.5b00341 |
| [10] | Ahn Y, Jang Y, Selvapalam N, et al. Supramolecular velcro for reversible underwater adhesion[J]. Angew Chem Int Ed Engl, 2013, 52(11): 3140–3144. DOI:10.1002/anie.201209382 |
| [11] | Gong B, Choi BK, Kim JY, et al. High affinity host-guest FRET pair for single-vesicle content-mixing assay:observation of flickering fusion events[J]. J Am Chem Soc, 2015, 137(28): 8908–8911. DOI:10.1021/jacs.5b05385 |
| [12] | Ayhan MM, Karoui H, Hardy M, et al. Comprehensive synthesis of monohydroxy-cucurbit[n]urils (n=5, 6, 7, 8):high purity and high conversions[J]. Journal of the American Chemical Society, 2015, 137: 10238–10245. DOI:10.1021/jacs.5b04553 |
| [13] | Yi S, Kaifer AE. Determination of the purity of cucurbit[n]uril (n=7, 8) host samples[J]. J Org Chem, 2011, 76(24): 10275–10278. DOI:10.1021/jo2018312 |
| [14] | Kaifer AE. Toward reversible control of cucurbit[n]uril complexes[J]. Acc Chem Res, 2014, 47(7): 2160–2167. DOI:10.1021/ar5001204 |
| [15] | Assaf KI, Nau WM. Cucurbiturils:from synthesis to high-affinity binding and catalysis[J]. Chem Soc Rev, 2015, 44(2): 394–418. DOI:10.1039/c4cs00273c |
| [16] | Ong W, Gomez-Kaifer M, Kaifer AE. Cucurbit[7] uril:a very effective host for viologens and their cation radicals[J]. Org Lett, 2002, 4(10): 1791–1794. DOI:10.1021/ol025869w |



