近年来脑卒中严重威胁人类的健康,其中缺血性脑卒中在我国中老年人群中发病率极高,且呈上升趋势,严重影响人们的生活质量[1-2]。脑卒中后,尽早恢复脑血流是目前救治患者最有效的手段之一,然而血管再通,恢复血流,反而会加重脑组织的损伤,即脑缺血-再灌注损伤(ischemia reperfusion injury,I/R)[3-5]。脑缺血-再灌注损伤的病理机制十分复杂,其机制与炎症的发生发展、自由基过度形成、细胞内钙离子超载及兴奋性氨基酸毒性等因素相关[6-8]。到目前为止,脑缺血-再灌注损伤的具体分子机制仍尚不明确,亟需深入研究。
自噬(autophagy)是一种在应激情况下,机体所做出的一种防御调控机能,在维护细胞内环境稳态方面起重要作用[9]。研究表明,心、肾、脑等缺血-再灌注损伤过程中均有自噬现象的发生。Matsui等[10]的研究显示,自噬相关蛋白在心肌缺血时表达增多,而在再灌注时期,增多则更为明显。Wu等[11]研究证实在肾脏缺血-再灌注过程中,短时间的缺血-再灌注可以抑制自噬的发生,维持肾脏ATP的水平,增强抗氧化应激能力保护肾脏。国内外学者先后证实了脑缺血-再灌注也可以激活自噬,其中适量自噬对细胞起到一定保护作用[12-13];然而自噬过度激活会对细胞造成一定的损伤[14-15]。目前自噬在脑缺血-再灌注损伤过程中的确切作用与作用机制尚不明确。
本文利用RNA-Sequencing筛选自噬相关基因在大鼠脑缺血-再灌注24h时的表达,采用RT-PCR动态检测自噬相关基因在缺血2 h及不同再灌注时间点(6、12、24、48h)的表达变化,以期验证自噬参与脑缺血-再灌注损伤过程,为进一步研究自噬在脑缺血-再灌注损伤中的机制提供实验基础。
1 材料与方法 1.1 材料 1.1.1 实验动物与分组SPF级雄性Wistar大鼠,体重约180~210g,由济南朋悦实验动物繁育有限公司提供(许可证号:SCXK(鲁)20140007)。大鼠饲养于济宁医学院神经生物学研究所动物房,饲养的环境温度维持在22~28℃,湿度50%~60%。实验操作之前,除实验需求干预外,大鼠均自由觅食、饮水,白昼夜均12h更替,保证大鼠的良好生活环境。动物管理均遵循国家实验动物饲养管理条例和使用指南以及济宁医学院实验动物管理条例。
雄性Wistar大鼠随机分为假手术组(sham, 6只)和模型组(30只)。按造模后缺血和再灌注时间点分为缺血2h(Ⅰ组)和再灌注6h、12h、24h、48h 5个亚组(I/R组),每组6只。造模后分别取缺血侧皮质提取总RNA用于RNA测序、RT-PCR及qRT-PCR基因组测序和差异基因的表达验证。
1.1.2 主要试剂2,3,5-三苯基氯化四氮唑(TTC)购于美国Sigma公司,TRIzol购于赛默飞世尔科技(中国)有限公司,FastQuant RT Kit试剂盒和SuperReal PreMix Plus均购于北京天根生化科技有限公司。
1.2 方法 1.2.1 大鼠局灶性脑缺血-灌注损伤模型制备大鼠腹腔注射10%水合氯醛醉(0.4ml/100g)后,分离右侧颈总动脉(common carotid artery, CCA)、颈内动脉(internal carotid artery, ICA)和颈外动脉(extemal carotid artery, ECA),结扎ECA远端,微动脉夹夹闭颈CCA近心端和ICA远心端。在ECA上剪一小口,用自制处理过的钓鱼线从颈外动脉剪口处插入,经CCA进入ICA,以CCA分叉处开始计算,进线深度为(18.0±0.5)mm,行至大脑中动脉起始部形成栓塞,造成局灶性脑缺血状态。
1.2.2 TTC染色将上述正常组和缺血2h再灌注24h的大鼠处死,取脑组织置于-20℃冰箱30min。随后自大脑前极处连续切取大脑冠状切片,共6张,每张厚度2mm。将切片放置1%的TTC染液中,37℃恒温箱内避光孵育约20min,期间每5min观察1次,待其染色均匀后吸出TTC染液,PBS冲洗2遍后用4%的多聚甲醛室温固定。固定24h后相机拍照,并利用Image J软件进行分析,计算出梗死体积。脑梗死体积=(梗死面积×厚度)/(脑切片总面积×厚度)×100%。
1.2.3 RNA测序Trizol法提取对照组和缺血2h再灌注24h模型组皮层组织总RNA。紫外吸收测定法检测总RNA的浓度和纯度。然后用带有Oligo(dT)的磁珠富集mRNA,在得到的mRNA中加入适量打断剂使其片断化,再以片断后的mRNA为模板,合成cDNA,经过磁珠纯化、末端修复、3’末端加碱基A、加测序接头后进行PCR扩增,完成整个文库制备工作。构建好的文库用Agilent 2100 Bioanalyzer和ABI Step One Plus Real-Time PCR System进行质量和产量检测,文库质控合格后进行测序。
1.2.4 测序数据分析测序所得的原始数据首先进行质控,以确定测序数据是否适用于后续分析。质控后,经过滤得到的序列比对到参考序列,并进行差异基因表达分析和Pathway显著性富集分析。
1.2.5 qRT-PCR利用FastQuant RT试剂盒(TIANGEN)将上述所提总RNA逆转录成cDNA。反应体系及步骤按照试剂盒说明进行。利用SuperReal PreMix Plus (TIANGEN)试剂盒,将上述逆转录的cDNA进行荧光定量PCR扩增(扩增引物序列见表 1)。1)PCR反应体系(20μl):10μl 2×SYBR Premix Ex Taq,0.6μl 10μM正向引物,0.6μl 10μM反向引物,0.4μl 50×ROX,2μl cDNA,6.4μl EDPC水。2)PCR反应条件:95℃预变性15min;95℃变性10s,60℃退火20s,72℃延伸20s,40个循环。其中β-actin为内参对照,反应在LightCyclerR 480荧光定量PCR仪中进行。采用2-△△Ct相对定量法处理数据,通过公式计算获得靶基因表达的相对水平。
| 表 1 差异基因的扩增引物序列 |
分别在缺血2h,缺血2h再灌注6h,12h,24h和48h后处死大鼠,取缺血侧皮层组织提取总RNA,然后反转录cDNA进行PCR扩增(扩增引物序列见表 1)。PCR反应体系(20μl)如下:2×PCR Buffer 10μl,10μM上游引物0.2μl,10μM下游引物0.2μl,cDNA 1μl,EDPC水8.6μl。PCR反应条件:94℃ 2min;94℃ 30s,55℃ 50s,72℃ 50s,32个循环;72℃ 10min,4℃保存。β-actin为靶基因的内参对照。扩增产物经琼脂糖凝胶进行检测后,利用凝胶扫描仪观察结果并拍像记录。
1.3 统计学方法数据用Graphpad Prism 5.0.统计软件进行分析。计量单位以x±s表示,组间比较采用方差分析,进一步两两比较采用t检验。P<0.05为差异有统计学意义。
2 结果 2.1 不同处理组脑梗死体积的变化TTC染色后,sham组脑组织无梗死,呈均匀红色。I/R组梗死体积呈白色,较sham组模型增加(30.17±3.21)%,差异具有统计学意义(P<0.05),表明脑缺血-再灌注损伤诱发脑梗死,该模型制备成功。见图 1。
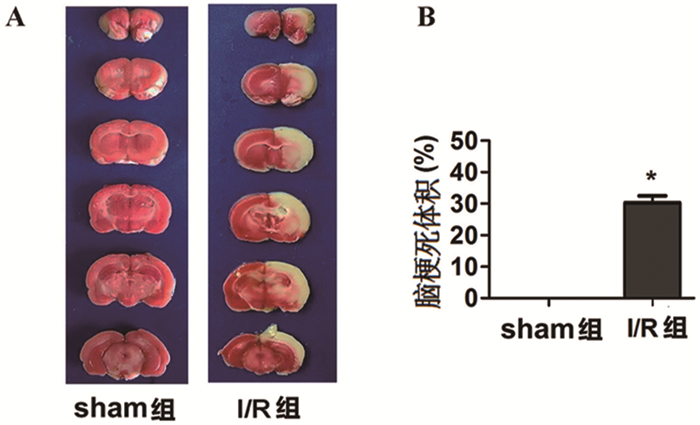
|
图 1 不同处理组的大鼠脑梗死体积 注:A.TTC染色结果;B.梗死体积测量值;与sham组相比, *P<0.05 |
sham组与I/R 24h组间有182个基因表达存在显著差异,其中与自噬相关的差异基因有5个,分别是Calreticulin、ATG3、ATG5、ATG12和ATG13。测序结果显示,在缺血-再灌注24h时Calreticulin下调了0.621,ATG3、ATG5、ATG12和ATG13在缺血-再灌注24h时上调,分别上调了0.621,3.078,2.662和1.764,表明自噬相关基因可能参与了大鼠脑缺血-再灌注损伤。见表 2。
| 表 2 自噬相关基因在sham组与I/R 24h组的表达 |
然后通过KEGG Pathway (Qvalue≤0.05)显著性富集,绘制差异表达基因参与的主要信号转导途径。绘制的自噬信号通路包含4个上调的自噬相关基因ATG3、ATG5、ATG12和ATG13,表明自噬信号通路可能参与了大鼠脑缺血-再灌注损伤。见图 2。

|
图 2 自噬信号通路 注:椭圆形标注基因为RNA-sequencing筛选出的差异表达的自噬相关基因 |
为了验证RNA-sequencing结果,我们进一步利用qRT-PCR方法在sham与I/R 24h组间扩增上述5个差异表达的自噬相关基因。与sham组相比,在I/R 24h组中,Calreticulin的表达下调了0.411,ATG3、ATG5、ATG12和ATG13的表达分别上调了0.457,3.534,2.651和1.719,与RNA-sequencing测序结果基本吻合。见图 3。

|
图 3 qRT-PCR检测差异表达的基因 注:与sham组相比,*P<0.05 |
为了分析自噬相关差异基因在不同缺血-再灌注时间的动态表达,我们分别在缺血2h,再灌注6h,12h,24h,48h时取缺血侧皮层组织,进行RT-PCR分析。与sham组相比,Calreticulin的表达在缺血2h时明显上升,再灌注6 h时其表达继续上升,然后随再灌注时间的延长其表达逐渐下降。与sham组相比,ATG3的表达在缺血2h时上升,再灌注6h时继续上升,到再灌注12h时其表达最高,然后随再灌注时间的延长,其表达逐渐下降且稳定在一定水平。与sham组相比,ATG5的表达在缺血2h时显著升高,再灌注6h和12h时反而降低,然后其表达逐渐升高,到再灌注24h时最高,且这种高表达持续到再灌注48h。ATG12和ATG13的表达趋势基本一致,与sham组相比,它们的表达从缺血2h到再灌注12h持续上升,然后随再灌注时间的延长其表达逐渐下降。见图 4。
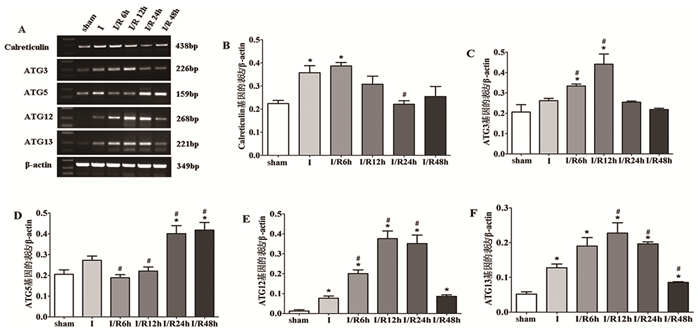
|
图 4 自噬相关基因在不同再灌注时间点的动态变化 注:A.RT-PCR扩增结果图:B~F.基因表达条带的灰度值;与sham组相比, *P<0.05;与Ⅰ组相比, #P<0.05 |
证据表明自噬在脑缺血-再灌注损伤过程中被激活,自噬相关基因表达上调。然而自噬在脑缺血-再灌注损伤中的作用存在争议。大部分研究结果支持自噬的激活对脑缺血-再灌注起保护作用。杜晓薇等[16]研究发现Atg12在大鼠脑缺血-再灌注6h开始表达,在24~48h达到高峰,72h之后逐渐减弱。彭志锋等[17]研究表明,小鼠脑缺血60min再灌注24h时,Atg5表达在mRNA和蛋白水平上均显著升高。而Atg5 siRNA处理使缺血-再灌后的脑梗死体积和水肿率明显增加,表明Atg5在小鼠脑缺血-再灌性损伤后具有神经保护作用。自噬抑制剂3-甲基嘌呤(3-MA)能下调脑缺血-再灌注损伤后神经元中Beclin 1表达,加重细胞坏死,而自噬激活剂雷帕霉素则上调Beclin1表达,减轻大脑损伤[18]。缺氧缺糖(oxygen-glucose deprivation,OGD)细胞模型[19]也证明在OGD情况下自噬活动明显增强,在恢复正常氧浓度及糖含量后一定时间内自噬活动仍持续增强并保持在较高水平。
然而,有研究认为自噬激活是脑缺血-再灌注损伤机制之一。Buckley等[20]采用大脑中动脉模型制备大鼠局灶性脑缺血模型,并采用氯喹来阻断自噬,发现自噬阻断后大鼠的神经功能缺损症状得到明显改善,并且梗死区面积减少约30%。Zheng等[21]研究发现,应用Beclin 1 siRNA能抑制自噬并减轻大鼠大脑缺血-再灌注损伤。Park等[22]研究发现,体外培养的PC12细胞缺血预处理明显上调LC3II表达、增加溶酶体活性及自噬空泡数目,而3-MA明显抑制缺血预处理的神经保护作用。
本研究利用RNA-sequencing分析了大鼠脑缺血-再灌注损伤模型与对照间差异表达基因,与自噬相关的5个基因,Calreticulin、ATG3、ATG5、ATG12和ATG13差异表达。随后进一步检测5个差异基因在缺血-再灌注不同时间点的动态变化,其表达趋势基本一致,与缺血组相比,表达先升高,然后随再灌注时间的延长其表达逐渐下降,但表达动态表达的时间点不尽相同。当脑组织缺血-再灌注时,自噬相关基因的表达逐渐被升高,提示自噬水平逐渐增高,Atg12激活后先后与Atg5、Atg3、Atg7等结合被修饰加工后形成自噬体,再与溶酶体结合形成自噬溶酶体。自噬相关基因的表达水平逐渐降低,可能是由于蛋白质和细胞器的过度消耗引起自噬体形成减少所致,但仍需进一步验证。
本文结果表明自噬相关基因参与了脑缺血-再灌注损伤,而且也揭示了自噬在脑缺血-再灌注损伤过程中的复杂性,为进一步阐述自噬在脑缺血-再灌注损伤中的作用提供了理论基础。本研究虽然证实了缺血-再灌注后自噬相关基因的表达变化趋势,但是其机制并不是十分明确,尚有待于更进一步研究,这也是今后我们研究的一个重点。
| [1] | Kang SK, Lee DH, Bae YC, et al. Improvement of neurological deficits by intracerebral transplantation of human adipose tissue-derived stromal cells after cerebral ischemia in rats[J]. Exp Neurol, 2003, 183(2): 355–366. DOI:10.1016/s0014-4886(03)00089-x |
| [2] | Qi X, Hosoi T, Okuma Y, et al. Sodium 4-phenylbutyrate protects against cerebral ischemic injury[J]. Mol Pharmacol, 2004, 66(4): 899–908. DOI:10.1124/mol.104.001339 |
| [3] | Collard CD, Gelman S. Pathophysiology, clinical manifestations, and prevention of ischemia-reperfusion injury[J]. Anesthesiology, 2001, 94(6): 1133–1138. DOI:10.1097/00000542-200106000-00030 |
| [4] | Pan J, Konstas AA, Bateman B, et al. Reperfusion injury following cerebral ischemia:pathophysiology, MR imaging, and potential therapies[J]. Neuroradiology, 2007, 49(2): 93–102. DOI:10.1007/s00234-006-0183-z |
| [5] | Abas F, Alkan T, Goren B, et al. Neuroprotective effects of postconditioning on lipid peroxidation and apoptosis after focal cerebral ischemia/reperfusion injury in rats[J]. Turk Neurosurg, 2010, 20(1): 1–8. |
| [6] | Yin J, Tu C, Zhao J, et al. Exogenous hydrogen sulfide protects against global cerebral ischemia/reperfusion injury via its anti-oxidative, anti-inflammatory and anti-apoptotic effects in rats[J]. Brain Res, 2013, 1491: 188–196. DOI:10.1016/j.brainres.2012.10.046 |
| [7] | Ketheeswaranathan P, Turner NA, Spary EJ, et al. Changes in glutamate transporter expression in mouse forebrain areas following focal ischemia[J]. Brain Res, 2011, 1418: 93–103. DOI:10.1016/j.brainres.2011.08.029 |
| [8] | Zhang ZG, Sun X, Zhang QZ, et al. Neuroprotective effects of ultra-low-molecular-weight heparin on cerebral ischemia/reperfusion injury in rats:involvement of apoptosis, inflammatory reaction and energy metabolism[J]. Int J Mol Sci, 2013, 14(1): 1932–1939. DOI:10.3390/ijms14011932 |
| [9] | Sheng R, Qin ZH. The divergent roles of autophagy in ischemia and preconditioning[J]. Acta Pharmacol Sin, 2015, 36(4): 411–420. DOI:10.1038/aps.2014.151 |
| [10] | Matsui Y, Takagi H, Qu X, et al. Distinct roles of autophagy in the heart during ischemia and reperfusion:roles of AMP-activated protein kinase and Beclin 1 in mediating autophagy[J]. Circ Res, 2007, 100(6): 914–922. DOI:10.1161/01.RES.0000261924.76669.36 |
| [11] | Wu HH, Hsiao TY, Chien CT, et al. Ischemic conditioning by short periods of reperfusion attenuates renal ischemia/reperfusion induced apoptosis and autophagy in the rat[J]. J Biomed Sci, 2009, 16: 19. DOI:10.1186/1423-0127-16-19 |
| [12] | Sheng R, Zhang LS, Han R, et al. Autophagy activation is associated with neuroprotection in a rat model of focal cerebral ischemic preconditioning[J]. Autophagy, 2010, 6(4): 482–494. DOI:10.4161/auto.6.4.11737 |
| [13] | 石秋艳, 杨斌, 孙原, 等. Beclin-1、LC3-Ⅱ在缺血后处理大鼠再灌注中的表达及意义[J]. 中风与神经疾病杂志, 2014, 31(8): 687–690. |
| [14] | Xie C, Ginet V, Sun Y, et al. Neuroprotection by selective neuronal deletion of Atg7 in neonatal brain injury[J]. Autophagy, 2016, 12(2): 410–423. DOI:10.1080/15548627.2015.1132134 |
| [15] | 陈兴泳, 汪银洲, 雷惠新, 等. 大鼠脑缺血再灌注后自噬的变化及灯盏生脉胶囊干预的影响[J]. 中国康复理论与实践, 2015, 21(7): 773–779. DOI:10.3969/j.issn.1006-9771.2015.07.008 |
| [16] | 杜晓薇, 韩瑞祎, 闵鹤鸣, 等. 自噬相关基因Atg12和LC3-Ⅱ在脑缺血再灌注大脑表达的实验研究[J]. 重庆医科大学学报, 2018, 43(2): 162–166. |
| [17] | 彭志锋, 王喜英, 杨靖辉. 小鼠脑缺血时自噬相关基因5的抗损伤作用[J]. 中国病理生理杂志, 2016, 32(1): 64–68. DOI:10.3969/j.issn.1000-4718.2016.01.011 |
| [18] | Carloni S, Buonocore G, Balduini W. Protective role of autophagy in neonatal hypoxia-ischemia induced brain injury[J]. Neurobiol Dis, 2008, 32(3): 329–339. DOI:10.1016/j.nbd.2008.07.022 |
| [19] | Gao B, Zhang X Y, Han R, et al. The endoplasmic reticulum stress inhibitor salubrinal inhibits the activation of autophagy and neuroprotection induced by brain ischemic preconditioning[J]. Acta Pharmacologica Sinica, 2013, 34(5): 657–666. DOI:10.1038/aps.2013.34 |
| [20] | Buckley KM, Hess DL, Sazonova IY, et al. Rapamycin up-regulation of autophagy reduces infarct size and improves outcomes in both permanent MCAL, and embolic MCAO, murine models of stroke[J]. Exp Transl Stroke Med, 2014, 6: 8. DOI:10.1186/2040-7378-6-8 |
| [21] | Zheng YQ, Liu JX, Li XZ, et al. RNA interference-mediated downregulation of Beclin1 attenuates cerebral ischemic injury in rats[J]. Acta Pharmacol Sin, 2009, 30(7): 919–927. DOI:10.1038/aps.2009.79 |
| [22] | Park HK, Chu K, Jung KH, et al. Autophagy is involved in the ischemic preconditioning[J]. Neurosci Lett, 2009, 451(1): 16–19. DOI:10.1016/j.neulet.2008.12.019 |

