2. 大理大学基础医学院, 大理 671000;
3. 杭州市第一人民医院, 杭州 310006
2. College of Basic Medicine, Dali University, Dali 671000, China;
3. Hangzhou First People's Hospital, Hangzhou 310006, China
组蛋白赖氨酸甲基转移酶(nuclear receptor SET domain containing protein 2,NSD2)也作MMSET或者WHSC1,是NSD蛋白家族的成员之一,利用其含有的SET结构域,主要催化组蛋白H3赖氨酸第36号位的二甲基化(H3K36me2),进一步发挥基因调控作用[1]。NSD2与多种疾病尤其是肿瘤关系密切[2]。如:NSD2的过表达与前列腺癌、头颈部鳞癌的高分级、肿瘤细胞增殖密切相关[3-4],与肝细胞癌[5]、卵巢癌[6]、子宫内膜癌[7]、子宫颈癌[8]的分期、分级以及不良预后密切相关,与骨肉瘤[9]细胞增殖、转移以及不良预后密切相关等。另外,NSD2单倍体不足可以导致以脑部发育过小为特点的沃尔夫综合征[10],在神经母细胞瘤中,NSD2高表达与肿瘤不良临床病理特征联系,与转移和不良预后密切相关[11]。目前NSD2的生理功能和致癌机制大部分仍不清楚,我们在体外诱导了小鼠胚胎干细胞(mESCs)向神经细胞(NCs)方向分化,观察NSD2和相关组蛋白修饰H3K36me2、H3K36me3在mESCs向NCs分化过程中的蛋白表达变化,旨在为进一步研究NSD2在神经系统发育中的生理功能和作用机制提供依据。
1 材料和方法 1.1 材料 1.1.1 细胞系E14Tg2A.4小鼠胚胎干细胞由首都师范大学张伟伟教授实验室赠送。
1.1.2 试剂DMEM培养基、非必需氨基酸、L-谷氨酰胺、核苷酸、β-巯基乙醇、青霉素-链霉素、明胶、1000 U/ml白血病抑制因子(LIF)均为Millipore公司产品; 胎牛血清(Hyclone公司);维甲酸(RA, sigma公司);逆转录酶试剂盒(Fermentas公司);Taq酶(Roche公司);β-actin一抗(60008-1, DATASHEET公司);NSD2一抗(ab75359, abcam公司);H3K36me2一抗(39891,Active Motif公司);H3K36me3一抗(4909S,Cell Signaling公司);H3(ab1791, abcam公司);二抗(ab6709, abcam公司)。
1.1.3 仪器倒置显微镜(ZEISS公司);荧光定量PCR仪(Bio-Rad公司);垂直电泳和转印系统(Bio-Rad公司);蛋白印迹检测系统(ImageQuant LAS4000)。
1.2 方法 1.2.1 维甲酸(RA)法诱导ESCs向NCs分化mESCs用含有15%胎牛血清、各1%非必需氨基酸、L-谷氨酰胺、β-巯基乙醇、核苷酸、青霉素-链霉素、1000U/ml LIF的DMEM完全培养基进行培养,将细胞按照培养天数(D0~D5)分组,将D0细胞作为对照组,其他作为实验组,收集细胞进行后续实验。具体如下:当培养至细胞数18×106,收取3×106细胞,当作第0天(标记为D0,其中1/3细胞沉淀备用于RIPA裂解提取总蛋白做Western Blot, 1/3备用于酸提取组蛋白做Western Blot,1/3备用于提RNA)。其余细胞按照1.5×106/10cm培养皿的密度种植到10个培养皿,用不加LIF的DMEM完全培养基, 加入RA(浓度5×10-7mol/L)进行诱导,其间每天进行细胞换液, 观察细胞形态并拍照保存,于D5诱导结束。于诱导分化的D1~D5分别收集细胞2盘,同样的,其中1/3细胞沉淀备用于提取总蛋白做Western Blot, 1/3细胞沉淀备用于提取组蛋白做Western Blot,1/3备用于提RNA。
1.2.2 RT-qPCR法检测mESCs标记物、NCs早期分化标记物mRNA的表达在细胞分化过程中,按固定时间收获细胞,Trizol试剂提取RNA, 逆转录cDNA, 进行Real-Time PCR。相应小鼠引物设计如下(华大基因合成)。见表 1。
| 表 1 引物序列 |
Blot分析NSD2表达:将收获的细胞沉淀,每管加入100μl碧云天的强RIPA裂解液,冰上裂解30min,用Biosafer 1000细胞超声破碎仪破碎细胞,4℃,16000r,离心10min,取上清,测定蛋白浓度,按照60μg的上样量进行SDS-PAGE蛋白电泳,4℃, 360mA, 60min转膜,3%脱脂奶粉封闭1h, 一抗β-actin (1: 10000)、NSD2(1: 3000)室温孵育1h,TBST洗膜3次,每次5~10 min,二抗(1: 10000)室温孵育1h,再用TBST洗膜3次,每次5~10 min,ECL化学发光,蛋白印迹检测系统显影,利用Image Quant TL软件分析条带灰度值,以β-actin为内参, 计算相对蛋白含量。
组蛋白Western Blot分析H3K36me2、H3K36 me3的表达:采用酸提取法,即0.2N HCl 4℃过夜处理细胞沉淀,4℃, 16000r, 离心10min,取上清,1/5体积的1M NaOH中和,测定蛋白浓度,按照20μg的上样量进行SDS-PAGE蛋白电泳,4℃, 360mA, 20min转膜,3%脱脂奶粉封闭1h, 一抗H3K36me2(1: 1000)、H3K36me3(1: 2000)室温孵育1h,后续操作同上。
1.3 统计学方法采用SPSS17.0软件统计包进行统计分析。
2 结果 2.1 细胞形态观察mESCs细胞呈圆或卵圆形,胞核相对比较大并且核仁比较明显。加入RA诱导1天时(D1),细胞增殖明显,逐渐向外扩展,并且发生明显的形状改变,RA诱导3天时(D3)细胞开始伸出突起,变细变长,在诱导第5天(D5)时,细胞形态已趋于一致,胞体圆亮,多呈双极性,逐渐连接成神经样网络。见图 1。
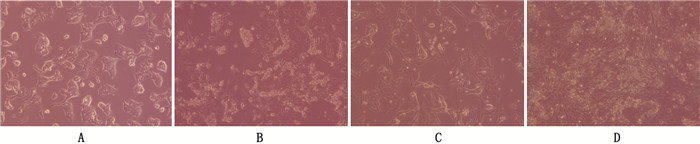
|
图 1 mESCs向NCs诱导分化过程中细胞形态的观察(100×) 注:A, mESCs; B, 诱导分化第1天; C, 诱导分化第3天; D, 诱导分化第5天 |
与初始胚胎干细胞状态(D0)相比,在诱导分化结束时(D5),干细胞标记物Sox2、Oct3/4、Nanong的mRNA水平显著下降,NCs早期分化标记物Nestin、NeuroD、Tuj1的mRNA水平显著上升,差异具有统计学意义(均P<0.05)。见图 2。综合细胞形态学上的变化和mRNA表达水平变化,可以基本确定体外mESCs经RA诱导向NCs方向分化成功。
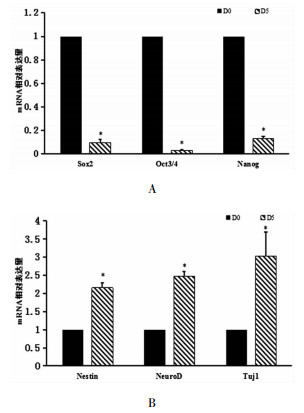
|
图 2 mESCs标记物和NCs早期分化标记物在D0和D5时mRNA的表达 注:与D0组比较,* P<0.05;A,mESCs标记物在D0和D5时mRNA的表达; B,NCs早期分化标记物在D0和D5时mRNA的表达 |
通过Western Blot, 本实验检测到Ⅰ型NSD2(75kd)和Ⅱ型NSD2(150kd)在mESCs向NCs分化过程中的蛋白特异性表达变化,Ⅱ型NSD2因具备甲基转移酶活性,所以更有意义。结果显示:NSD2在mESCs状态(D0)相对蛋白水平表达较低,在加入RA诱导向NCs分化1天后(D1),突然升高,随后在诱导分化的第2天(D2)开始下降, 并于第3天(D3)开始直到观察结束几乎消失,即先升高后下降的变化,与D0相比,差异具有统计学意义(均P<0.05)。见图 3。
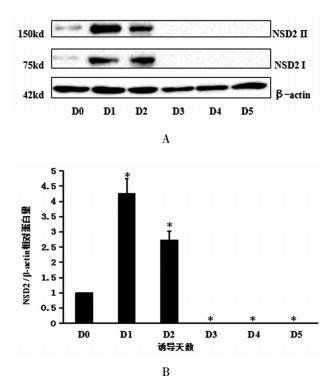
|
图 3 NSD2在ESCs向NCs分化过程中蛋白表达量的变化 注:与D0组比较,* P<0.05 |
本实验观察了在mESCs向NCs分化过程中,NSD2直接催化的组蛋白标记H3K36me2的表达变化,NSD2表达量与H3K36me2变化趋势不完全一致。以总体的组蛋白H3为内参,H3K36me2的相对蛋白表达量未有显著变化。另外,本实验还观察了以H3K36me2为底物的H3K36me3,其变化也不明显。总的来说组蛋白甲基化总量变化较小, 差异无统计学意义(P>0.05)。见图 4。

|
图 4 ESCs向NCs分化过程中NSD2相关组蛋白甲基化标记的表达变化 |
作为表观遗传学研究的一个重要内容,组蛋白修饰与疾病的关系越来越受到人们的重视,成为当前研究的一个热点。组蛋白甲基转移酶NSD2与神经系统疾病尤其是肿瘤的发生发展关系密切,然而,NSD2在神经系统发育中的生理功能以及致癌机制大部分仍不清楚。本文在体外成功地诱导了ESCs向NCs的分化,观察NSD2及相关组蛋白修饰的蛋白表达变化,以期为下一步研究提供依据。
早就有研究表明NSD2单倍体不足可以导致沃尔夫综合征(Wolf Hirschhorn syndrome), 而NSD2缺陷的小鼠出生后死于心脏异常和类似于沃尔夫综合征的表型[10]。沃尔夫综合征儿童具有脑部生长过小和智力发育不全特点,即神经细胞数量减少的情况, 推测NSD2的一个生理功能是促进NCs增殖作用。同时,Hudlebusch等[11]研究表明,NSD2在神经母细胞瘤中的表达水平是升高的,高表达的NSD2与患者预后差相关,并且高表达的NSD2是神经母细胞瘤细胞增殖所必需的,这与NSD2促进NCs增殖的作用是一致的。
本实验采用RA诱导法,在体外成功的诱导了ESCs向NCs的分化,观察到NSD2在mESCs向NCs分化过程中特异性的蛋白表达变化,这与我们先前用拟胚体分化法诱导mESCs向NCs的分化过程中观察到的总体结果是一致的[12]。实验中观察到:RA作用的早期(D1),细胞的增殖明显,而后期(D2-D5)主要是向NCs的分化。我们将整个诱导分化过程分为三个阶段,发现NSD2蛋白发生了特异性的表达变化,第一阶段:即mESCs(D0),NSD2蛋白水平比较低;第二阶段:即在RA作用下细胞明显增殖阶段(D1), NSD2蛋白水平迅速升高,显示出与细胞增殖速度的密切相关;第三阶段:即在RA持续作用下,细胞停止增殖,开始向NCs方向持续分化阶段(D2-D5),NSD2蛋白水平是显著下降的。由此,我们推测NSD2可能具有促进神经细胞增殖,抑制细胞分化的作用,但值得进一步研究。总的来说,NSD2蛋白水平发生的显著变化,可能提示NSD2在调控mESCs向NCs发育中,具有重要的生理功能。在之前我们的另一个研究中,甲基化转移酶EZH2, 在mESCs向NCs的分化过程中也呈现下降趋势的蛋白表达变化,这或许提示了EZH2和NSD2在调控NCs发育中,有一定功能上的协同性[13],有研究也报道过EZH2和NSD2可能通过microRNA存在着密切联系[14],下一步我们将通过沉默和转染NSD2和EZH2, 观察其对神经细胞发育的影响,深入研究NSD2和EZH2在神经系统发育中的生理功能,并进一步研究NSD2和EZH2的相互作用机制。
NSD2主要通过催化H3K36me2进一步调控基因转录激活,研究表明,在某些肿瘤比如在多发性骨髓瘤中,NSD2的过表达可以引起整个基因组的H3K36me2水平升高[15],然而本实验观察到ESCs向NCs分化过程中NSD蛋白表达量的改变与其催化的组蛋白修饰H3K36me2变化趋势不完全一致,组蛋白甲基化修饰总量的变化比较小,这可能是因为同时受到其他甲基化转移酶与去甲基化酶综合作用的结果,NSD2的变化不一定改变总体的H3K36me2水平, 可能只是影响局部少量基因区。尽管如此,NSD2对局部关键基因的调控,可以引起基因的转录激活,仍具有重要意义。
综上所述,本实验在体外成功建立了mESCs向NCs分化体系,观察到了与神经系统发育密切相关的组蛋白甲基化修饰酶NSD2以及相关的组蛋白修饰的表达变化,为下一步研究NSD2在神经系统发育中的生理功能和在肿瘤发生发展中的作用机制打下了基础。
| [1] | Li Y, Trojer P, Xu CF, et al. The target of the NSD family of histone lysine methyltransferases depends on the nature of the substrate[J]. J Biol Chem, 2009, 284: 34283–34295. DOI:10.1074/jbc.M109.034462 |
| [2] | 郇通, 潘云, 李艳. NSD家族组蛋白甲基化转移酶与肿瘤发生[J]. 中国细胞生物学学报, 2015, 35(5): 728–733. DOI:10.11844/cjcb.2015.05.0369 |
| [3] | Yang P, Guo L, Duan ZJ, et al. Histone methyltransferase NSD2/MMSET mediates constitutive NF-κB signaling for cancer cell proliferation, survival, and tumor growth via a feed-forward loop[J]. Mol Cell Biol, 2012, 32(15): 3121–3131. DOI:10.1128/MCB.00204-12 |
| [4] | Saloura V, Cho HS, Kiyotani K, et al. WHSC1 promotes oncogenesis through regulation of NIMA-related kinase-7 in squamous cell carcinoma of the head and neck[J]. Mol Cancer Res, 2015, 13(2): 293–304. DOI:10.1158/1541-7786.MCR-14-0292-T |
| [5] | Zhou P, Wu LL, Wu KM, et al. Overexpression of MMSET is correlation with poor prognosis in hepatocellular carcinoma[J]. Pathol Oncol Res, 2013, 19(2): 303–309. DOI:10.1007/s12253-012-9583-z |
| [6] | Yang S, Zhang Y, Meng F, et al. Overexpression of multiple myeloma SET domain(MMSET)is associated with advanced tumor aggressiveness and poor prognosis in serous ovarian carcinoma[J]. Biomarkers, 2013, 18(3): 257–263. DOI:10.3109/1354750X.2013.773082 |
| [7] | Xiao M, Yang S, Chen J, et al. Overexpression of MMSET in endometrial cancer:a clinicopathologic study[J]. J Surg Oncol, 2013, 107(4): 428–432. DOI:10.1002/jso.23234 |
| [8] | Yin Z, Sun Y, Ge S, et al. Epigenetic activation of WHSC1 functions as an onc-ogene and is associated with poor prognosis in cervical cancer[J]. Oncol Rep, 2017, 37(4): 2286–2294. DOI:10.3892/or.2017.5463 |
| [9] | Lu MH, Fan MF, Yu XD, et al. NSD2 promotes osteosarcoma cell proliferation and metastasis by inhibiting E-cadherin expression[J]. Eur Rev Med Pharmacol Sci, 2017, 21(5): 928–936. |
| [10] | Izumi K, Okuno H, Maeyama K, et al. Interstitial microdeletion of 4p16.3:contribution of WHSC1 haploinsufficiency to the pathogenesis of developmental delay in Wolf-Hirschhorn syndrom[J]. Am J Med Genet A, 2010, 152A(4): 1028–1032. DOI:10.1002/ajmg.a.33121 |
| [11] | Hudlebusch HR, Skotte J, Santoni-Rugiu E, et al. MMSET is highly expressed and associated with aggressiveness in neuroblastoma[J]. Cancer research, 2011, 71(12): 4226–4235. DOI:10.1158/0008-5472.CAN-10-3810 |
| [12] | 郇通, 潘云, 李艳. NSD1与NSD在神经干细胞发育过程中的不同角色[J]. 医学信息, 2014, 10(2): 29–30. |
| [13] | 孙芳, 郇通, 潘云, 等. EZH2蛋白在神经细胞发育中的表达变化[J]. 大理学院学报, 2015, 10(14): 9–12. DOI:10.3969/j.issn.1672-2345.2015.10.003 |
| [14] | Asangani IA, Ateeq B, Cao Q, et al. Characterization of the EZH2-MMSET hist-one methyltransferase regulatory axis in cancer[J]. Mol Cell, 2013, 49(1): 80–93. DOI:10.1016/j.molcel.2012.10.008 |
| [15] | 孙芳, 潘云, 李艳. 组蛋白修饰在常见血液系统肿瘤中作用的研究进展[J]. 中国实验血液学杂志, 2015, 23(4): 1184–1189. |



