2. 中国生长发育行为医学研究中心, 济宁 272029;
3. 北京协和医院内分泌科, 北京 100730
2. Chinese Center for Behavioral Medical Research in Growth and Development, Jining 272029, China;
3. Department of Endocrinology, Peking Union Medical College Hospital, Beijing 100730, China
先天性肾上腺皮质增生症(congenital adrenal hyperplasia, CAH)是由于肾上腺皮质类固醇激素合成途径中所必需的酶的缺陷而导致的一组疾病。任何一种酶的缺陷, 均可导致一种不同类型的CAH, 包括21-羟化酶缺陷症(21-OHD)、11β-羟化酶缺陷症(11β-OHD)、3β-羟类固醇脱氢酶缺陷症(3β-HSD)、17α-羟化酶/17, 20-裂解酶缺陷症(17α-OHD)以及先天性类脂性肾上腺增生症(CLAH)等。其中以21-OHD最常见, 约占所有CAH的90%以上, 11β-OHD次之, 而17α-OHD较罕见, 约占所有CAH的1%。17α-OHD临床表现复杂, 常被漏诊、误诊, 现结合我科诊治的1例17α-OHD患者的临床资料、基因测序、治疗及随访情况对该病进行分析总结, 以加强对CAH及其亚型的认识。
1 对象与方法 1.1 对象患者15岁8月, 性别:女性, 因“至今无月经初潮”于2017年8月就诊。既往9年前因“双侧腹股沟斜疝”行手术治疗, 切除组织不详。患者幼时体质差、体力不佳, 常有发热及恶心、呕吐。查体:BP146/98mmHg, 身高:160cm, 体重:39kg, 指间距162.5cm、上部量75.4cm、下部量84.6cm。体型偏瘦, 全身皮肤颜色偏黑, 未见明显喉结, 甲状腺不大, 双乳Tanner Ⅰ期, 腹软, 左右两侧下腹部可见陈旧手术瘢痕, 无腋毛、阴毛, 女性外阴, 有阴道, 无第二性征发育, 双下肢无水肿。家族史:父母体健, 为非近亲婚配, 有一弟弟, 均无类似症状。
1.2 方法 1.2.1 生化、激素测定及影像学检查促肾上腺皮质激素(ACTH)、皮质醇(F)、黄体生成素(LH)、卵泡刺激素(FSH)、雌二醇(E2)、孕酮(P)、睾酮(T)用直接化学发光法测定; 血浆肾素活性(PRA)、醛固酮(Ald)用化学发光法测定, 17羟孕酮(17α-OHP)由艾迪康公司检测; 血生化用上海罗氏Cobas c 702全自动生化分析仪。骨龄、超声、肾上腺及腹膜后CT、盆腔磁共振等由我院超声科、影像中心完成。
1.2.2 CYP17A1基因检测患者父母签署知情同意书后, 采集患者外周血5ml及其父母、弟弟的外周血各2ml置于EDTA管中, 使用QiagenFlexiGene DNA Kit的方法提取血液样本的基因组DNA。PCR扩增CYP17A1基因。采用引物设计软件Primer 5.0设计特异性引物, 引物序列为:正向:CCTTgTgggggATgAgCATAg; 反向:AgTAgAgCTgCCCCATCTTCTg。PCR扩增条件:95℃预变性10min, 95℃变性30s, 60℃退火30s, 72℃延伸45s, 35个循环。PCR产物用Illumina公司的NextSeq 500测序仪测序。
2 结果 2.1 实验室检查血钾、血皮质醇、雌二醇、睾酮及17-羟孕酮降低, 促肾上腺皮质激素、促性腺激素、孕酮升高, 肾素被明显抑制。见表 1。
| 表 1 患者实验室检查结果 |
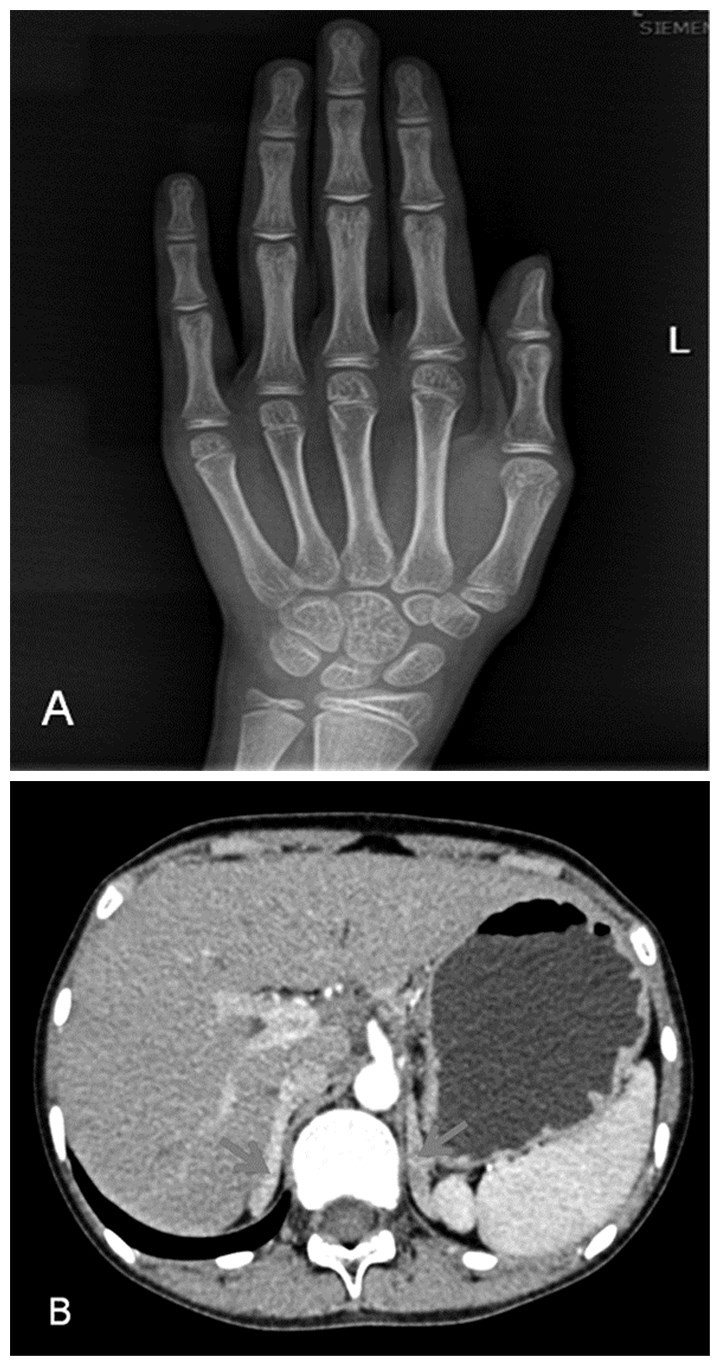
左手骨龄约10岁(G-P图谱法, 见图 1A); 肾上腺CT平扫+增强:双侧肾上腺增生, 增强后强化均匀, 未见异常强化灶(见图 1B); 妇科超声、盆腔磁共振、腹膜后增强CT均未见子宫体、卵巢结构、睾丸样结构; 垂体MR平扫:未见明显异常。
|
图 1 患者影像学检查结果 注:A, 左手骨龄片; B, 肾上腺CT |
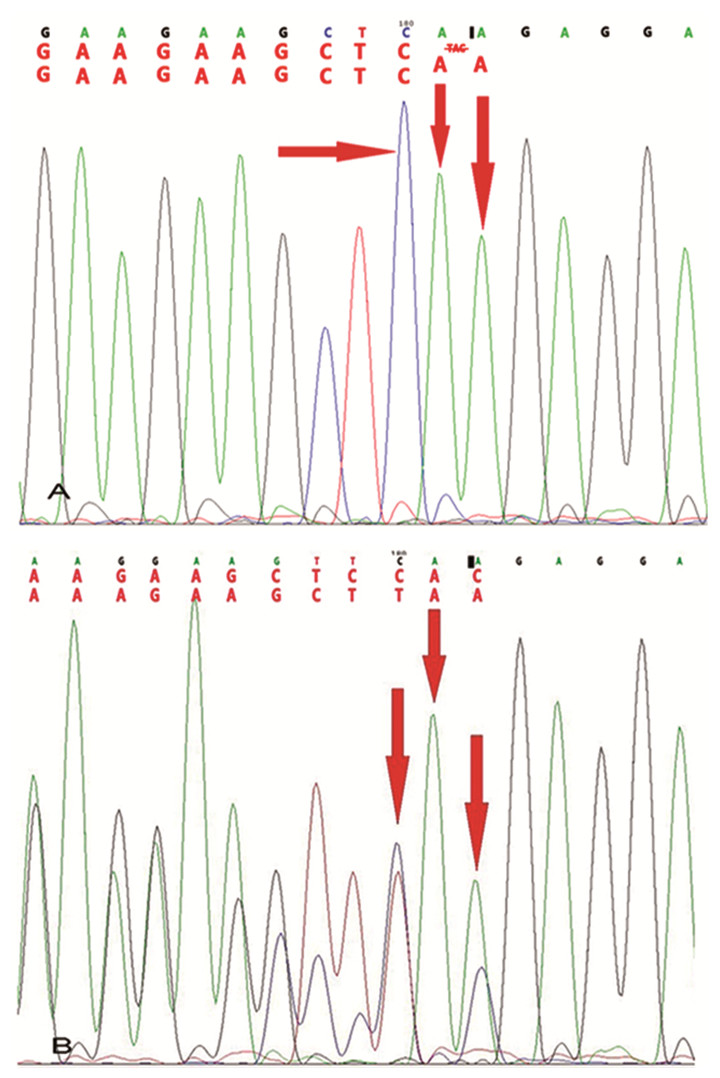
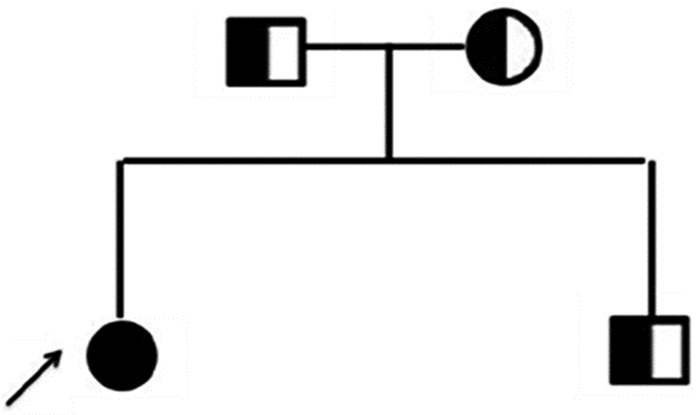
患者染色体为46, XY。基因分析提示第6号外显子c.985-987delinsAA纯合突变(见图 2A), 导致编码第329位密码子TAC→AA, 造成该位点后密码子发生移码突变, 并在改变后的第90个氨基酸提前终止。受检者父母、弟弟该位点均为杂合子(见图 2B), 患者家系图见图 3。
|
图 2 患者及家属基因分析 注:A, 患者CYP17A1基因分析; B, 患者父母及其弟弟CYP17A1基因分析 |
|
图 3 患者家系图 |
综合患者临床资料、染色体核型及基因分析后确诊为CAH 17α-OHD, 给予地塞米松0.75mg/d, 服用1周后复查ACTH 3.73pmol/L、血钾3.41mmol/L, 血压正常。因患者出现下肢水肿遂调整为醋酸氢化可的松10mg/早、20mg/晚, 2月后复查ACTH 75.57pmol/L, 考虑清晨ACTH未得到有效控制, 予调整为醋酸泼尼松早2.5mg、晚5mg。患者及家属选择女性性别抚养, 给于戊酸雌二醇0.5mg/d。
4 讨论在性发育过程中, 染色体决定性腺的分化, 激素决定生殖器的分化[1]。人胚胎性腺的分化大约从妊娠第7周开始, 在Y染色体的影响下, 原始性腺分化形成睾丸, 于孕8周开始出现Leydig细胞, 该细胞可分泌睾酮, 在睾丸及其功能正常的条件下, 特别是Leydig细胞分泌的睾酮及其代谢产物DHT(双氢睾酮)和雄激素受体完全正常时, 可进一步分化形成龟头、阴茎及阴囊。如此时缺乏睾酮, 则不能分化成男性外生殖器, 而是分化成阴蒂和大小阴唇。性发育异常疾病复杂繁多, 其中CAH是引起性发育异常最常见的病因, 由于酶的缺陷, 引起皮质醇合成不足以及雄激素合成的显著增加或减少, 导致性发育异常。不同类型的CAH鉴别依赖于激素水平测定及基因分析, 其中21OHD、11β-OHD、17α-OHD各类特点详见表 2[2]。
| 表 2 21OHD、11β-OHD、17α-OHD基因及临床特点 |
本例患者因无月经初潮就诊。体格检查发现第二性征未发育, 测血皮质醇低、ACTH高, 睾酮低、促性腺激素高, 伴低血钾、17OHP降低, 影像学检查示骨龄落后、双侧肾上腺明显增生, 染色体为46, XY, 拟诊为17α-OHD。17α-OHD为常染色体隐性遗传病, 由CYP17A1基因突变所致。CYP17A1编码的P450c17是肾上腺类固醇激素合成的关键酶之一, 表达于肾上腺和性腺[3-4], 兼具17α-羟化酶和17, 20碳链裂解酶两种酶的活性。P450c17缺陷时, 糖皮质激素及性激素合成通路受阻, 而过多的前体物质转向了盐皮质激素合成通路。皮质醇合成不足, ACTH代偿性分泌增加, 导致肾上腺皮质增生, 前体物质孕酮及孕烯醇酮大量堆积, 使11-去氧皮质酮(DOC)和皮质酮分泌增加, 引起水钠潴留、低血钾, 并抑制RAS系统, 形成低肾素性高血压。由于DOC和皮质酮具有一定的糖皮质激素活性, 患者一般没有肾上腺皮质功能减退的表现, 较少出现肾上腺危象。性激素合成通路受阻后, 雄激素合成障碍, 睾丸发育停止在早期阶段, 不能形成阴茎和阴囊, 外阴呈幼女型, 且其下游雌激素合成减少, 因而青春期缺乏第二性征发育, LH和FSH异常升高。女性患者表现为第二性征不发育、原发闭经, 男性患者表现为假两性畸形。因此, 很多患者在儿童期未被发现, 到了青春期不发育才就诊。本患者即在青春期无第二性征发育前来就诊。
本病的确诊最终需依据基因检测。该患者的CYP17A1基因分析提示第6号外显子c.985-987delinsAA纯合突变, 进一步从分子遗传学证实了患者的诊断。该突变导致编码第329位密码子TAC缺失、AA插入, 造成该位点后密码子发生移码突变。此突变与国内已有报道吻合[5-6]。目前发现已有100多种不同的CYP17A1基因突变, 包括点突变、小片段的插入和缺失, 剪接位点的变化和大的缺失[7]。p.H.373L、p.Y329fs突变在亚洲人群中最为常见[8]。在我国, Y329fs、D487-F489del是最常见的突变类型[9-10], 具有种族特异性, 可能与“祖先效应”有关[3]。c.985-987delinsAA突变最早在韩国人群中被报道, 后发现在中国人群中最为常见[11]。该突变男性核型的多见, 其纯合突变会导致17α-羟化酶/17, 20-裂解酶功能的完全丧失。不同类型的基因突变, 酶活性丧失程度不同[12]。
17α-OHD不能治愈, 主要采取激素替代治疗。糖皮质激素治疗既补充皮质醇的不足, 又抑制过多的盐皮质激素分泌, 改善高血压、低血钾[13]。成人一般选用地塞米松, 初始剂量0.75~1.5mg/d, 维持剂量0.125~0.375mg/d, 根据患者的体重、血压、血钾调整剂量[14]。如服药后出现体重明显增加, 可改为口服氢化可的松或泼尼松。儿童和青少年优先选用氢化可的松, 一般睡前服2/3量, 早晨服1/3量[15], 但最佳用量及服药方式尚无统一标准。如糖皮质激素治疗后仍不能纠正高血压, 可加用降压药, 首选螺内酯, 它可以有效拮抗盐皮质激素[16]。对于典型的17α-OHD患者表现型为女性, 青春期或成人一经诊断便可给予雌激素治疗, 应从小剂量起始, 逐渐增加到成人替代量, 口服雌二醇起始0.5mg/d, 数月后加量至1~2mg/d, 再维持1~3年[7]。由于性激素缺乏可出现骨质疏松, 长期的糖皮质激素治疗也可能增加骨质疏松的风险, 补充雌激素一方面促进第二性征发育, 另一方面还可预防骨质疏松, 除此以外, 还应尽可能增加骨量, 减少骨的丢失[17]。该患者最终给予醋酸泼尼松替代治疗。该患者染色体性别为男性, 表现型及社会性别为女性, 需行性别选择。患者及其父母表示选择女性性别抚养, 因影像学检查未发现子宫及附件, 不具备人工周期条件, 仅给予戊酸雌二醇补充雌激素。核型为46, XY的患者, 因睾酮缺乏致睾丸发育障碍, 且多为隐睾, 隐睾恶变概率为正常睾丸的10~20倍, 发现后应立即切除发育不良和位置不正常睾丸, 以防恶变, 即使行睾丸固定下降术, 亦不能降低恶变概率[18]。该患者各项检查均未发现睾丸组织, 不排除其9年前腹股沟疝手术时已切除。
生理上的缺陷会使患者产生自卑、恐惧等不良情绪, 除药物治疗外, 还应给予心理疏导, 保护患者隐私, 以达到心理与生理的康复。性发育异常疾病的鉴别诊断较难, 由于该病发病率低, 临床上对本病认识不足, 易导致误诊、漏诊, 对于高血压、低血钾伴性发育不良的女性表型患者, 应考虑该病的可能性, 及时完善核型分析, 基因检测可明确诊断。
| [1] | 张惠杰, 李小英. 先天性肾上腺增生症与性发育异常[J]. 中国实用内科杂志, 2011(4): 254–256. |
| [2] | Turcu AF, Auchus RJ. The next 150 years of congenital adrenal hyperplasia[J]. J Steroid Biochem Mol Biol, 2015, 153: 63–71. DOI:10.1016/j.jsbmb.2015.05.013 |
| [3] | 杨军, 李小英, 孙首悦, 等. 10例17α-羟化酶/17, 20碳链裂解酶缺陷症临床和遗传性研究[J]. 上海交通大学学报(医学版), 2006, 26(1): 17–21. |
| [4] | Bee YM, Manju C, Papari-Zareei M, et al. Phenotypic variation in a Chinese family with 46, XY and 46, XX 17α-hydroxylase deficiency[J]. Gynecol Endocrinol, 2012, 28(4): 322–325. DOI:10.3109/09513590.2011.631625 |
| [5] | 孙首悦, 毕宇芳, 刘建民, 等. CYP17A1基因TAC329 AA纯合突变致17α-羟化酶缺陷症一例家系研究[J]. 中华内分泌代谢杂志, 2004(6): 568–571. DOI:10.3760/j.issn:1000-6699.2004.06.028 |
| [6] | 虎子颖, 赵志刚, 汪艳芳, 等. 2例17α-羟化酶/17, 20-碳链裂解酶缺陷症患者临床及遗传学分析[J]. 上海交通大学学报(医学版), 2015, 35(3): 375–379. |
| [7] | Auchus RJ. Steroid 17-hydroxylase and 17, 20-lyase deficiencies, genetic and pharmacologic[J]. J Steroid Biochem Mol Biol, 2017, 165(Pt A): 71–78. DOI:10.1016/j.jsbmb.2016.02.002 |
| [8] | Kim YM, Kang M, Choi JH, et al. A review of the literature on common CYP17A1 mutations in adults with 17-hydroxylase/17, 20-lyase deficiency, a case series of such mutations among Koreans and functional characteristics of a novel mutation[J]. Metabolism, 2014, 63(1): 42–49. DOI:10.1016/j.metabol.2013.08.015 |
| [9] | Zhang M, Sun S, Liu Y, et al. New, recurrent, and prevalent mutations:Clinical and molecular characterization of 26 Chinese patients with 17alpha-hydroxylase/17, 20-lyase deficiency[J]. J Steroid Biochem Mol Biol, 2015, 150: 11–16. DOI:10.1016/j.jsbmb.2015.02.007 |
| [10] | Yang J, Cui B, Sun S, et al. Phenotype-genotype correlation in eight Chinese 17alpha-hydroxylase/17, 20 lyase-deficiency patients with five novel mutations of CYP17A1 gene[J]. J Clin Endocrinol Metab, 2006, 91(9): 3619–3625. DOI:10.1210/jc.2005-2283 |
| [11] | 吴庆华, 信艳萍, 张毅, 等. 17α-羟化酶/17, 20-裂解酶缺陷症的诊断及治疗效果探讨[J]. 中华妇产科杂志, 2015(2): 140–143. DOI:10.3760/cma.j.issn.0529-567x.2015.02.011 |
| [12] | Yanase T, Simpson ER, Waterman MR. 17 alpha-hydroxylase/17, 20-lyase deficiency:from clinical investigation to molecular definition[J]. Endocr Rev, 1991, 12(1): 91–108. DOI:10.1210/edrv-12-1-91 |
| [13] | Aydin Z, Ozturk S, Gursu M, et al. Male pseudohermaphroditism as a cause of secondary hypertension:a case report[J]. Endocrine, 2010, 38(1): 100–103. DOI:10.1007/s12020-010-9357-x |
| [14] | 徐平, 李路, 方烈奎, 等. 男性假两性畸形的临床特点:附病例报道[J]. 中国全科医学, 2011, 14(29): 3372–3373, 3376. DOI:10.3969/j.issn.1007-9572.2011.29.024 |
| [15] | 郑瑞芝, 赵志刚, 汪艳芳, 等. 先天性肾上腺皮质增生症6例临床分析[J]. 中华实用诊断与治疗杂志, 2010, 24(4): 399–402. |
| [16] | Salyer SA, Parks J, Barati MT, et al. Aldosterone regulates Na(+), K(+)ATPase activity in human renal proximal tubule cells through mineralocorticoid receptor[J]. Biochim Biophys Acta, 2013, 1833(10): 2143–2152. DOI:10.1016/j.bbamcr.2013.05.009 |
| [17] | 曹彩霞, 王鸥, 聂敏, 等. 1例17α-羟化酶/17, 20碳链裂解酶缺陷症的临床和分子遗传分析[J]. 基础医学与临床, 2009(3): 225–228. |
| [18] | 许一新, 孙辉, 彭丽, 等. 1例17α-羟化酶缺乏症患者CY17A1基因突变分析[J]. 中华男科学杂志, 2014, 20(12): 1146–1148. |



