流式细胞仪技术(flow cytometry,FCM),是应用流式细胞仪,结合单克隆抗体技术、免疫荧光染色技术,对快速流动液体中的单细胞进行多种参数测量和分析,检测速度快、精确性高,已经广泛应用于细胞生物学、免疫学、肿瘤学等领域[1]。流式微球捕获芯片技术(cytometrin bead array, CBA)微量样本多重蛋白定量技术,是用流式细胞仪对多重蛋白进行定量检测的方法,能够同时对样本中的多个指标进行定性、定量检测。血清、细胞培养上清、积液中的细胞因子,由于这些细胞因子含量低,不容易检测,加上样本数量少,传统的方法无法满足多因子检测[2]。
CBA检测系统采用聚苯乙烯荧光微球连结特定的捕获抗体,捕捉待测物,同时再加入待测物的荧光抗体,三者形成夹心复合物,通过流式细胞仪进行检测[3-4]。小鼠血清Th1/Th2/Th17相关细胞因子是实验中经常会用到的检测指标,由于血清量少很难运用传统的方法如ELISA法进行多因子检测,而CBA法正好能解决这一问题,它能够一次性对血清中的IL-2、IL-4、IL-6、IFN-Υ、TNF、IL-10、IL-17A进行定量检测。但是由于CBA操作过程繁琐,从样本处理、上机检测到数据处理都对实验者要求较高,每一步操作出现失误都会影响到结果。故此本文结合之前的实验案例,将实验操作中常出现的问题及解决方法进行分析和总结。
1 材料与方法 1.1 材料BD Cytometric Bead Array(CBA)Mouse Th1/Th2/Th17 Cytokine Kit(Catalog No.560485);BD FACSCantoⅡ流式细胞仪;华支睾吸虫感染小鼠血清;FCAP分析软件;流式上样管;15ml离心管。
1.2 方法 1.2.1 检测样本制备主要步骤制备小鼠Th1/Th2/Th17细胞因子标准品;混合人Th1/Th2/Th17细胞因子捕获微球;标准品管及样本管分别加入微球及相应的样本,加Th1/Th2/Th17 PE检测试剂,2h后洗涤,上机检测。
1.2.2 流式细胞仪调整从BD官网下载CBA仪器调整模板,将模板通过Diva软件导入到机器中。打开模板,运用Cytometer Setup Beads(CBA试剂盒配备)调整机器参数包括调整P1细胞群,调节FITC、PE、APC电压等,参照说明书进行,在此不再赘述。
1.2.3 FCAP软件分析从Diva软件中导出数据,其格式为FCS2.0文件。打开FCAP软件,导入相应的FCS2.0文件进行分析,包括制作标准曲线,计算样本浓度等。
2 标准品上机检测流式图正常的CBA标准品检测流式图,表现为在FSC-A /SSC-A图上显示一群微球位于门P1之内,见图 1A;在PE-A/APC-A散点图表现为7群,从上到下依次为IL-2、IL-4、IL-6、IFN-Υ、TNF、IL-10、IL-17A,群之间清晰无连接,无聚集成团,无多群现象,见图 1B;APC-A通道上也显示为清晰的7群,见图 1C。

|
图 1 正常CBA流式检测图 |
在检测小鼠血清样本的时候,正常流式散点图上显示为7群,见图 2A;但是有时会显示多群,甚至聚集成团,见图 2B。微球由聚苯乙烯材料制作而成,血清加入微球之后如果没有充分涡旋,容易沉淀聚集,细胞因子不能充分跟微球结合,导致多群甚至聚集现象发生,检测结果将是无效的。从制备混合微球开始到加入实验管,直到上机检测前每一步都必须充分涡旋,以避免微球发生聚集。

|
图 2 微球聚集现象 |
CBA实验上机检测后需要用到FACP软件进行分析,但是此软件严格要求在APC通道上显示为7群,多群,少群将无法检测。在检测血清时候,由于血清成分比较复杂,血清中含有各种血浆蛋白、多肽、脂肪、碳水化合物、生长因子、激素、无机物等;同时在小鼠取血过程中都会有部分溶血,血细胞中的成分如红细胞碎片,血红蛋白等释放到血清中;这些物质会影响到微球与细胞因子的结合,影响到整个体系中的组分,所以经常会出现多群现象,这样的检测结果将无法分析,见图 3。如何处理这样的数据直接影响到实验结果。

|
图 3 APC通道显示多群微球 |
我们在PE-A/APC-A散点图上重新设一个门P2,见图 4A;其逻辑关系如图 4C所示,与模板自带的门P1并行同属于“All Events”。门P2将所需要的目的微球群圈选在内,非目的微球群排除在外,此时在APC-A通道上可清晰显示出7个微球群,如图 4B所示。门设置完成后,将数据导出时,一定要选择导出目标数据为“P2”,这样我们检测的数据就够在FACP软件进行分析,7种细胞因子的数值也能依次计算出来。

|
图 4 设门选中目标微球群 |
在检测血清样本时FSC/SSC的检测图中经常会出现碎片过多,见图 5;影响到结果的准确性,此时应调整机器的状态,上调FSC/SSC的阈值,如果问题仍然存在,重复样本洗涤步骤,或者稀释血清,尽量减少血清中的杂质成分如红细胞碎片。
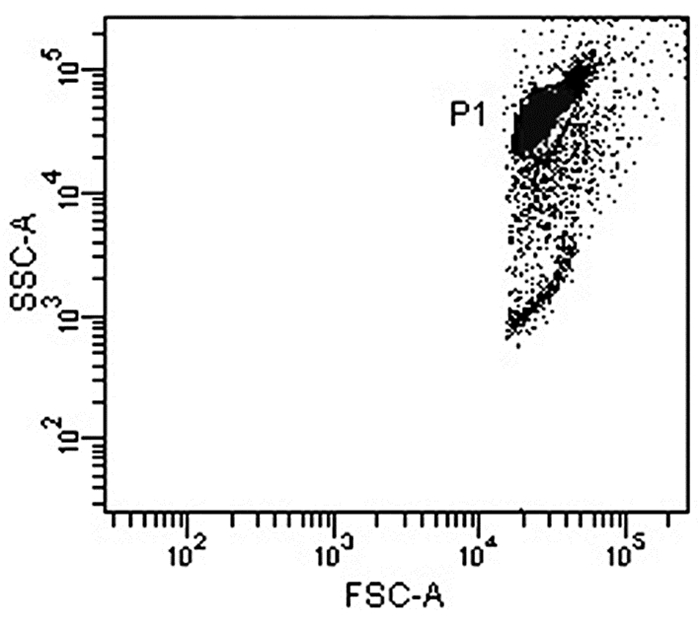
|
图 5 FSC/SSC的检测图出现大量碎片 |
当样本中待测细胞因子浓度很低的时候经常会出现样本值位于标准曲线之外,导致检测结果不准确或者无结果,此时我们在制作标准曲线时候,增加额外的稀释浓度点如10、5、2.5、1.25pg/ml。此时样本值就能被检测出来,并且结果是可信的。
4 讨论流式细胞仪以其检测速度快、检测手段灵活、多指标、多参数、灵敏度(可达0.3pg/ml)等特点已成为基础科研,临床检测等必不可少的技术手段[5-6]。CBA是流式细胞术的一个新技术,整合了免疫微球、激光检测、信号处理及计算机运算等功能。CBA将近似于细胞大小的微珠作为捕获载体,使其携带已知荧光抗原或抗体,来捕获检测物中的相关抗体或抗原。由于遮蔽效应可以使荧光微球的发散光减弱,应用不同大小的荧光微球,可同时检测同一标本的多种抗原或抗体。这种方法能同时检测单一液相样本中多个目的蛋白(如同时测定多种细胞因子、多种自身抗体等),检测需用标本量少,灵敏度高,重复性好,直接荧光标记易于使用,检测线性范围宽,避免酶联反应所致的人工假象,可用于单细胞分子水平的多参数检验,也可用于真菌、寄生虫、病毒或混合感染的检测。较传统的ELISA有较大的优势,CBA检测所需样本体积为传统ELISA的1/6,对于稀有样本,CBA是目前最好的选择,少量样本即可检测细胞因子、抗体、抗原等多个指标;同时CBA稳定性好,可重复性高,能避免酶联免疫放大技术使信号失真导致的假阳性[7-8]。
CBA法能够对样本包括血清、细胞培养上清、渗出液等可溶性细胞因子进行定量检测,此方法已经广泛应用于免疫学领域、干细胞领域、肿瘤研究及疾病的治疗等。CBA检测速度快,灵敏度高,样本使用量少,50μl体积即可对多种细胞因子进行快速定量检测,但是由于操作过程繁琐,对实验人员技术要求高,从一定程度上限制了其广泛使用[9-10]。在检测血清时,由于血清成分复杂,细胞因子含量差距大,实验中经常会出现分群不明显,微球聚集,浓度太低等现象,对实验结果造成很大影响;CBA试剂盒说明书上虽然有相关步骤及问题处理方法,但是过于笼统,没有具体的案例,操作人员往往要经过多次摸索才能够做出较为满意的结果,本文主要结合实验过程中常见到的问题,对其进行分析,并找出解决问题的方法,为实验人员提供参考,避免实验中一些技术问题的出现,及遇到相似的问题能够尽快得到解决,从而提高实验的有效性和准确性。
| [1] | 陈朱波, 曹雪涛. 流式细胞术原理、操作及应用[M]. 北京: 科学出版社, 2010: 1-216. |
| [2] | Du L, Grover A, Ramanan S, et al. The evolution of guidelines for the validation of flow cytometric methods[J]. Int J Lab Hematol, 2015, 37(Suppl 1): 3–10. DOI:10.1111/ijlh.12344 |
| [3] | 赵春兰, 于华凤, 韩玉玲, 等. 流式CBA法检测哮喘患儿Th1/Th2和Treg/Th17细胞因子失衡情况[J]. 医学检验与临床, 2017(4): 1–5. DOI:10.3969/j.issn.1673-5013.2017.04.001 |
| [4] | Lawrence JG, Butela K, Atzinger A. A likelihood approach to classifying fluorescent events collected by multicolor flow cytometry[J]. J Microbiol Methods, 2013, 94(1): 1–12. DOI:10.1016/j.mimet.2013.04.001 |
| [5] | Khan SS, Smith MS, Reda D, et al. Multiplex bead array assays for detection of soluble cytokines:comparisons of sensitivity and quantitative values among kits from multiple manufacturers[J]. Cytometry B Clin Cytom, 2004, 61(1): 35–39. DOI:10.1002/cyto.b.20021 |
| [6] | Njemini R, Onyema OO, Renmans W, et al. Shortcomings in the application of multicolour flow cytometry in lymphocyte subsets enumeration[J]. Scand J Immunol, 2014, 79(2): 75–89. DOI:10.1111/sji.12142 |
| [7] | 高赟, 许沈华, 朱赤红, 等. CBA技术检测胃肠癌患者Th/1Th2细胞因子表达水平的研究[J]. 中国卫生检验杂志, 2011, 21(2): 280–283. |
| [8] | Ren W, Liu H, Yang W, et al. A cytometric bead assay for sensitive DNA detection based on enzyme-free signal amplification of hybridization chain reaction[J]. Biosens Bioelectron, 2013, 49: 380–386. DOI:10.1016/j.bios.2013.05.055 |
| [9] | 刘波. 流式细胞仪及其临床应用[J]. 中国医疗设备, 2013, 28(7): 66–69. |
| [10] | Aghaeepour N, Finak G, et al. Critical assessment of automated flow cytometry data analysis techniques[J]. Nat Methods, 2013, 10(3): 228–238. DOI:10.1038/nmeth.2365 |



