2. 西安航天总医院, 西安 710100;
3. 济宁医学院附属医院, 济宁 272029
2. Xi'an Aerospace General Hospital, Xi'an 710100, China;
3. The Affiliated of Jining Medical University, Jining 272029, China
胃癌是全球常见的消化系统恶性肿瘤,我国每年新发病例约40万,占世界总发病例约42%[1]。基于胃癌的组织结构和生物学行为的不同,将其分为肠型胃癌、弥漫型胃癌及混合型胃癌[2]。早期胃癌主要通过内镜下治疗或手术治疗,但多数患者在确诊时已发生远处转移,总体疗效并不理想。胃癌患者一旦发生转移不仅预后差,而且严重影响其生活质量。近年来对于胃癌转移机制的研究结果显示,肿瘤的浸润及转移是一个多步骤的涉及多种因素的复杂过程,如肿瘤细胞微环境中基质的降解、免疫逃逸、细胞间黏附作用的丧失、细胞迁移能力的增强等。
高迁移率族蛋白(high mobility group box-1 protein, HMGB1)是细胞内广泛存在的非组蛋白结合蛋白,作为损伤相关分子模式(DAMPs)中的一员,当分泌到细胞外时,主要发挥致炎作用,参与脓毒症及自身免疫性疾病的致病过程[3]。研究发现HMGB1在胰腺癌、结直肠癌等多种肿瘤组织中高表达[4-5],在肿瘤的发生发展过程中起到了关键作用,既往研究认为其作用机制可能通过促进肿瘤细胞的增殖、侵袭和转移,从而促进肿瘤的发生发展;近期研究发现HMGB1也可通过增强机体的免疫反应,诱导肿瘤细胞凋亡,进而抑制肿瘤的发生发展[6]。有研究发现HMGB1的血清学水平可作为早期诊断胃癌的标志物[7],其可促进胃癌的侵袭和转移;但也有研究发现高水平表达HMGB1的胃癌患者比低水平表达的胃癌患者预后较好[8]。因此本实验拟联合Oncomine数据库和Kaplan-Meier Plotter数据库分析HMGB1在胃癌中的表达及其对预后的影响,为进一步研究HMGB1在胃癌发生发展过程中的作用机制提供线索和思路。
1 资料与方法 1.1 一般资料Oncomine数据库分析:Oncomine数据库(https://www.oncomine.org)既是一个基于基因芯片的数据库,也是一个整合多个肿瘤基因数据库的挖掘平台,我们可以根据课题需要在此数据库中设定筛选数据和挖掘数据的条件。本研究中我们为明确HMGB1在胃癌组织及癌旁正常组织中的表达水平,故设定的筛选条件为:1)“Cancer Type:Gastric Cancer”; 2)“Gene:HMGB1”; 3)“DataType:mRNA”; 4)“Sample Type:Clinical Specimen”; 5)“Analysis Type:Cancer vs Normal Analysis”; 6)临界值设定条件(P value < 1E-4,fold change>2, gene rank=top 10%)选择柱状图展示结果。
1.2 方法Kaplan-Meier Plotter数据库进行患者生存周期分析:利用Kaplan-Meier Plotter数据库(http://kmplot.com/analysis/)中的胃癌数据资料,在线分析HMGB1对胃癌患者预后的影响。筛选条件如下:1)“Cancer:Gastric Cancer”; 2)“Gene:HMGB1”; 3)“Survival:OS”; 4)“Lauren classification:all/intstestinal/diffuse/mixed”。
1.3 统计学方法胃癌组织和癌旁正常组织之间的HMGB1表达水平的差异采用t检验。HMGB1的表达水平与胃癌患者预后的关系采用Kaplan-Meier模型分析。所用数据采用Oncomine数据库和Kaplan-Meier Plotter数据库在线统计学分析,P < 0.05认为差异有统计学意义。
2 结果 2.1 HMGB1在所有肿瘤类型中的表达结果在Oncomine数据库中共收集了443项不同类型的研究结果,其中关于HMGB1表达有统计学差异的研究结果有20项,HMGB1表达增高的研究有17项,表达降低的研究有3项。在消化系统肿瘤组织中,结肠癌组织中,HMGB1高水平表达的研究有5项,低水平表达的研究有0项;胃癌组织中,HMGB1高水平表达的研究有1项,低水平表达的研究有0项;食管癌组织中,HMGB1的表达没有差异。见图 1。
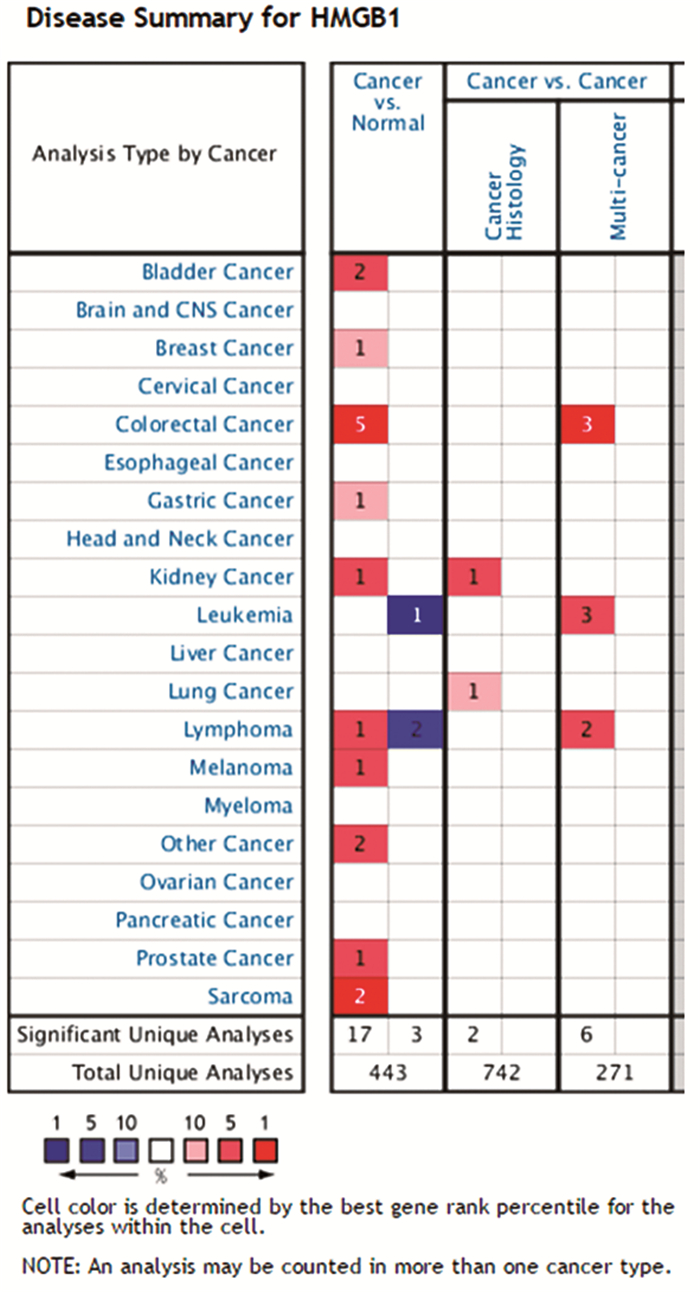
|
图 1 Oncomine数据库中HMGB1在所有肿瘤研究中的表达 |
Oncomine数据库分析结果显示,共有11项研究涉及HMGB1在胃癌组织和癌旁正常组织中的表达,共包括318个样本,荟萃11项研究结果发现与癌旁正常组织相比,HMGB1在胃癌组织中高水平表达(P=0.002)。见图 2。

|
图 2 HMBG1在Oncomine数据库中胃癌中的表达 |
Oncomine数据库中HMGB1在不同胃癌组织芯片中的表达结果显示,在4项研究中HMGB1在胃癌组织中的表达量高于癌旁正常组织(P均 < 0.05), 但是在肠型、弥漫性及混合型胃癌组织之间,HMGB1的表达量并无显著性差别。见图 3。

|
图 3 Oncomine数据库中HMGB1在不同胃癌研究芯片中的表达(P均<0.05) |
我们利用Kaplan-Meier Plotter数据库的胃癌数据集进行在线生存分析。Kaplan-Meier Plotter数据结果显示:HMGB1表达水平对患者的总生存时间有较大的影响。与低表达组相比,HMGB1高表达组胃癌患者的总存活时间有所延长(P=1.8E-05),同样HMGB1的表达水平对肠型胃癌患者(P=6.6E-08)也具有同样的影响;但是对于弥漫型胃癌和混合型胃癌,HMGB1的表达水平与胃癌患者的预后并无统计学相关性(P=0.16和P=0.075)。见图 4。
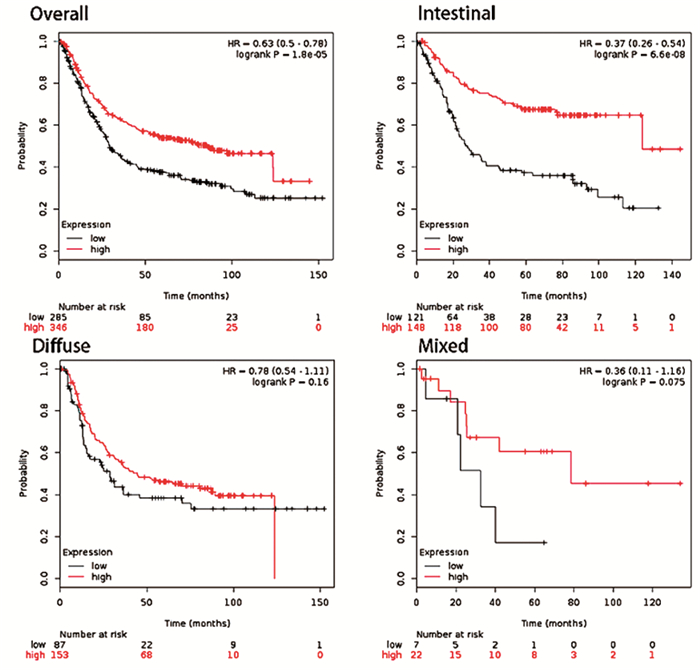
|
图 4 Kaplan-Meier Plotter数据库分析HMBG1对胃癌患者预后的影响 |
胃癌由于起病隐匿、病情发展迅速、较高的手术复发率和转移率高等特点,中晚期胃癌的治疗效果并不理想。流行学调查发现,全球胃癌新发病例约67.9万例,胃癌死亡病例约49.8万例,超过70%的胃癌新发病例发生在发展中国家,约50%的病例发生在东亚地区,主要集中在日本、中国和韩国[1]。我国作为胃癌高发国家,每年发病人数和死亡人数约占世界的50%,疾病负担严重,故现在迫切需要探索新的有效治疗途径和方法。
HMGB1因其在聚丙烯酰胺凝胶中迁移速率快而得名[3, 9]。HMGB1广泛存在于细胞内,同染色体DNA非特异结合,它属于HMG家族一员,在细胞内,HMGB1自由穿梭于细胞核和细胞质之间,在线粒体、溶酶体、细胞膜以及细胞外基质中均可见HMGB1分布。在细胞核内,HMGB1参与调控DNA的复制、重组及修复过程。HMGB1通过A box和B box和不同构象的DNA结合,而且这种结合是结构特异性而非序列特异性[10]。HMGB1广泛存在于各组织,生理情况下在脾脏和胸腺中含量较高,随着年龄的增长,HMGB1的水平呈下降趋势。近些年来研究发现HMGBl在胰腺癌、结直肠癌、肝癌、乳腺癌等多种肿瘤中存在高表达,HMGBl可能与部分肿瘤侵袭、转移密切相关[4-5, 7],也有研究发现HMGBl可能通过诱导肿瘤细胞凋亡,抑制肿瘤的发生发展[8],这提示我们HMGB1在肿瘤的发生发展中扮演着“双刃剑”的角色。
HMBG1影响肿瘤的生物学机制目前尚未明确,其分子机制可能是肿瘤炎性微环境中的白细胞主动分泌到细胞外的HMBG1和坏死的肿瘤细胞被动释放的HMBG1可能通过与受体RAGE(receptor for advanced glycation end products)结合激活ERK-1/2等信号通路,继而引起基质金属蛋白酶MMP2和MMP9激活,直接诱导细胞运动和间接促进细胞外基质降解,参与肿瘤的侵袭和转移[11];而且HMGB1与肿瘤血管生成有关,HMGB1及其受体RAGE的结合会导致NF-κB的激活,进而使白细胞黏附分子和前炎症反应分子及血管生成因子表达上调[12-13];HMGB1与肝素形成的复合物也能促进血管生成,在体内外实验中,人们利用抗体封闭HMGB1后,发现血管生成受到抑制[4],这些研究均提示HMGBl参与了肿瘤侵袭和转移。但是研究发现HMGB1也有诱导肿瘤细胞凋亡的可能性,其机制可能与其诱导的抗肿瘤免疫有关,HMGB1可诱导树突状细胞成熟,通过改变其表面分子的表达,促进细胞因子的分泌;也可以通过成熟的树突状细胞诱导T细胞向Th1分化,增强T细胞免疫应答反应;这些作用均有望增强机体的免疫反应,诱导肿瘤细胞凋亡,抑制肿瘤的发生发展[6, 8]。
在本文中,我们用Oncomine数据库提取HMGB1基因在胃癌组织及正常组织中的转录数据,结果显示HMGB1表达在胃癌组织中高于正常组织。而且通过对Kaplan-Meier Plotter数据库的胃癌数据集进行在线生存分析,我们发现HMGB1高表达可延长胃癌患者的存活时间,提示HMBG1的表达升高可能是胃癌患者预后良好的因素,但是本文只针对mRNA的表达水平进行了分析,缺乏对蛋白水平的进一步分析,而且本文只是采用数据库进行大样本分析,缺乏对相关生物学机制的基础研究,仍需要更多基于HMBG1表达与胃癌预后的研究进一步验证二者关系。
综上所述,我们通过对胃癌组织中HMBG1相关信息的深入挖掘,提出HMBG1在胃癌组织中高表达,且与胃癌预后相关,HMBG1的表达在一定程度上可用作反映胃癌预后的重要生物学指标。本文结果为探索HMBG1在胃癌中的作用提供基础,对今后胃癌的临床治疗和预后研究提供重要理论依据。
| [1] | Ferlay J, Soerjomataram I, Dikshit R, et al. Cancer incidence and mortality worldwide:sources, methods and major patterns in GLOBOCAN 2012[J]. Int J Cancer, 2015, 136(5): E359–E386. DOI:10.1002/ijc.29210 |
| [2] | Ua Cidón E. Gastric cancer and the search for a good prognostic classification:a challenge[J]. Clinical and Experimental Gastroenterology, 2010: 113. DOI:10.2147/ceg.s11929 |
| [3] | Goodwin GH, Johns EW. Isolation and characterisation of two calf-thymus chromatin non-histone proteins with high contents of acidic and basic amino acids[J]. Eur J Biochem, 1973, 40(1): 215–219. DOI:10.1111/j.1432-1033.1973.tb03188.x |
| [4] | van Beijnum JR, Dings RP, van der Linden E, et al. Gene expression of tumor angiogenesis dissected:specific targeting of colon cancer angiogenic vasculature[J]. Blood, 2006, 108(7): 2339–2348. DOI:10.1182/blood-2006-02-004291 |
| [5] | Breikers G, van Breda SG, Bouwman FG, et al. Potential protein markers for nutritional health effects on colorectal cancer in the mouse as revealed by proteomics analysis[J]. Proteomics, 2006, 6(9): 2844–2852. DOI:10.1002/pmic.200500067 |
| [6] | Dumitriu IE, Bianchi ME, Bacci M, et al. The secretion of HMGB1 is required for the migration of maturing dendritic cells[J]. J Leukoc Biol, 2007, 81(1): 84–91. DOI:10.1189/jlb.0306171 |
| [7] | Chung HW, Lee SG, Kim H, et al. Serum high mobility group box-1(HMGB1) is closely associated with the clinical and pathologic features of gastric cancer[J]. J Transl Med, 2009, 7: 38. DOI:10.1186/1479-5876-7-38 |
| [8] | Bao G, Qiao Q, Zhao H, et al. Prognostic value of HMGB1 overexpression in resectable gastric adenocarcinomas[J]. World J Surg Oncol, 2010, 8: 52. DOI:10.1186/1477-7819-8-52 |
| [9] | Yu SH, Spring TG. The interaction of nonhistone chromosomal proteins HMG1 and HMG2 with subfractions of H1 histone immobilized on agarose[J]. Biochim Biophys Acta, 1977, 492(1): 20–28. DOI:10.1016/0005-2795(77)90210-0 |
| [10] | Bustin M, Lehn DA, Landsman D. Structural features of the HMG chromosomal proteins and their genes[J]. Biochim Biophys Acta, 1990, 1049(3): 231–243. DOI:10.1016/0167-4781(90)90092-g |
| [11] | Riuzzi F, Sorci G, Donato R. The amphoterin (HMGB1)/receptor for advanced glycation end products (RAGE) pair modulates myoblast proliferation, apoptosis, adhesiveness, migration, and invasiveness.Functional inactivation of RAGE in L6 myoblasts results in tumor formation in vivo[J]. J Biol Chem, 2006, 281(12): 8242–8253. DOI:10.1074/jbc.M509436200 |
| [12] | Zhang Z, Wang M, Zhou L, et al. Increased HMGB1 and cleaved caspase-3 stimulate the proliferation of tumor cells and are correlated with the poor prognosis in colorectal cancer[J]. J Exp Clin Cancer Res, 2015, 34: 51. DOI:10.1186/s13046-015-0166-1 |
| [13] | van Beijnum JR, Buurman WA, Griffioen AW. Convergence and amplification of toll-like receptor (TLR) and receptor for advanced glycation end products (RAGE) signaling pathways via high mobility group B1(HMGB1)[J]. Angiogenesis, 2008, 11(1): 91–99. DOI:10.1007/s10456-008-9093-5 |



