抑郁症(depressive disorder)是一种常见的心境障碍疾病,患者表现为严重而持续的沮丧和绝望、快感缺乏、注意力难以集中、失眠等症状。它是一种以情绪障碍为主要特征的综合征,影响着全球约20%的人群,严重干扰了人们的日常生活和工作。世界卫生组织预测,到2020年,抑郁症将成为仅次于心血管疾病的第二大疾患[1]。
心理障碍的神经生物学通常集中于单胺神经递质:5-羟色胺(serotonin,5-HT)和去甲肾上腺素(norepinephrine,NE)。基于对5-HT或NE抗抑郁作用的分析,认为这些胺能神经递质突触水平的降低可能是抑郁症的主要原因,但是,目前在临床实践中使用的抗抑郁药物在许多患者中治疗无效,三分之一的患者表现出耐受性,并且对可用的抗抑郁治疗没有反应。
近年来,GPCRs二聚化已成为抑郁症研究的新热点,受体的异源二聚化对于胺能神经递质,即5-HT、NE和多巴胺(dopamine)的作用开辟了一种新的方法来理解神经传递的机制,同时可以作为药物开发的新策略。只有当受体在相同的细胞中表达时,二聚体才能形成。因此,二聚体可以显示独特的药理学和功能性质,可能会成为药物开发策略的新目标,会在很大程度上改善临床治疗效果并降低药物副作用。本综述阐述了主要的GPCRs二聚化及其对抑郁症的影响,以便更好地理解受体异源二聚体相互作用分子机制,并为抑郁症的治疗提供更有效的方法。
1 G蛋白偶联受体的异源二聚化G蛋白偶联受体(G protein-coupled receptors,GPCRs)代表最大的细胞膜蛋白家族,它们主要参与生理过程的调节,是目前市场上治疗药物的关键靶标。多年来,人们一致认为GPCRs是以单体的形式存在并发挥相应的功能作用,然而,目前大量的生化、结构和功能证据表明:GPCRs可以形成二聚体或高价寡聚体,这种相互作用扩大了GPCRs的功能性质,事实表明受体的二聚化是受体超家族的一般现象。二聚化可以发生在相同的受体类型(同源二聚化)之间或不同受体之间(异源二聚化),这种二聚化的两个受体可以是相同或不同的GPCRs家族类型,异源二聚化也可以是限于GPCRs的某些亚型的特异性现象;而GPCRs的一些同型不具有相互作用的能力。例如生长抑素受体SST5能够与SSTR1而非SSTR4异源二聚化[2]。
GPCRs的异源二聚化在GPCRs功能中发挥了必不可少的作用,GPCRs二聚化不仅在它们之间存在正和负协同相互作用(图 1),同时也在GPCRs的配体结合,信号转导和运输等方面中扮演着重要角色。因此,异源二聚化具有与相应单体不同的功能性质。GPCRs异源二聚化对受体激活和正常功能至关重要的直接证据来自于用代谢型G-氨基丁酸(GABA)B受体的研究,由GABA B1和GABA B2受体组成的异源二聚体中的每个受体单独表达时是无功能的,只有GABA B1和GABA B2受体的异源二聚化导致功能性GABA B受体在细胞表面的表达[3]。apelin受体(APJ)和缓激肽B1受体(Bradykinin B1 receptor, B1R)的两种完全功能性受体的异源二聚化形成新的APJ-B1R异源聚体,其显示与单独的受体具有不同的功能特性[4]。相比之下,异源二聚化也已显示抑制或失活受体功能。生长抑素SST2A和SST3受体之间的相互作用导致SSTR2A介导的SST3受体的失活[5]。

|
图 1 GPCRs二聚化中的正、负协同性 注:a)激动剂A结合一个GPCRs(浅色)导致另一个GPCRs的部分激活(深色)。b)当两种激动剂A和B同时结合于GPCRs时,将存在增强型的激活,发挥协同作用。c)在阴性协同性中,A与一个GPCRs(浅色)结合抑制B与另一GPCRs(深色)的结合,导致配体B相关信号传导的抑制。d)A的结合导致另一GPCRs(深色)信号转导的抑制。 |
近年来的研究表明,GPCRs同源或异源二聚体具有疾病特异性,参与多种病理过程[6],使它们成为重要的药物靶点。如缓激肽B2受体(bradykinin B2 receptor, B2R)和血管紧张素Ⅱ型受体(angiotensin Ⅱ type 1 receptor,AT1R)对于先兆子痫综合征(Preeclampsia)的发生起关键作用[7]。除此之外,GPCRs二聚体还与神经系统疾病,代谢性疾病、肿瘤、心血管疾病等有关。见图 2。
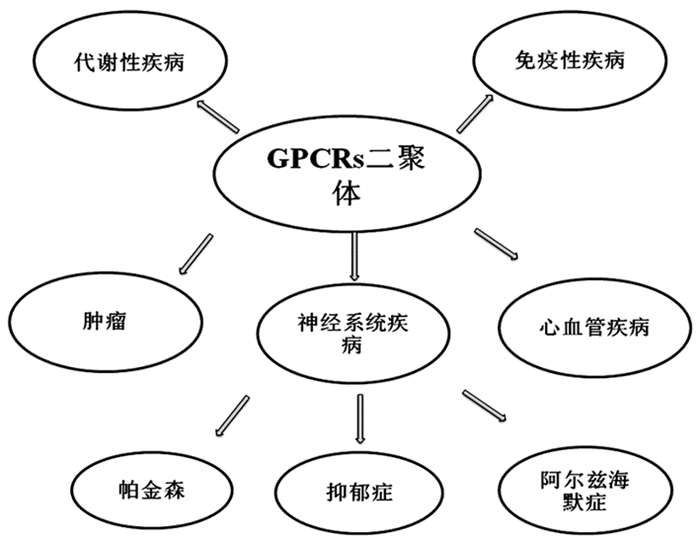
|
图 2 GPCRs二聚化在疾病中的应用 |
尽管GPCRs受体二聚化的概念现在已经确立,异源二聚体的形成显著扩展了药理学单元(作为具有改善选择性的潜在药物靶点)的组成,但在受体的信号转导和运输过程中,异源二聚体的形成、调节和作用机制还有待进一步的研究。
2 G蛋白偶联受体异源二聚化与抑郁症证据表明GPCRs异源二聚体可能在精神障碍疾病中发挥关键作用。Gonzales-Maeso等[8-9]研究表明5-HT2A-mGlu2异聚体可能参与改变精神分裂症患者的皮质功能,5-HT2A-mGlu2二聚体可以整合5-HT和mGlu信号转导以及调节G蛋白偶联。放射性配体结合测定显示,激活mGlu2受体的药物增加了5-HT2A受体对激动剂的亲和性,同时,选择性5-HT2A受体的激动剂降低了mGlu2受体对激动剂的亲和性。GPCRs异源二聚化在精神疾病中的另一个实例是在精神分裂症患者中,多巴胺D1-D2受体的异源二聚体敏感性和功能活性明显上调[10]。
目前,没有好的模型来解释抑郁症的分子基础或抗抑郁药多样性的药物学机制。通过增强单胺能传递起作用的抗抑郁药约在30%的患者中具有有限的治疗功效,并且通常引起很大的副作用。一种新的策略是寻找涉及疾病病理生理学的特定途径,其由受体-受体相互作用而不是受体本身介导,能够增强或阻断特异性受体对分子的发展,可潜在的改善抑郁症的治疗[11]。
2.1 甘丙肽(Gal-5)-HT1A受体二聚体甘丙肽(Galanin)是与5-HT共表达的神经肽,并且涉及其释放的调节。在海马的背侧细胞体中发现Gal和5-HT的共存。脑室内注射Gal减少腹侧边缘皮层、海马结构和额叶顶叶皮质中的5-HT代谢,通过对背侧5-HT的直接抑制作用,减少它们在上升途径中传递的细胞。已显示在边缘系统中,Gal降低突触后5-HT1A激动剂结合的亲和力,而突触后5-HT1A受体活化会提高情绪反应,这表明Gal可以导致抑郁症的发展。突触后5-HT1A的识别和甘丙肽(GalR)信号调节,显示了Gal-5-HT1A受体异聚体存在于脑中。拮抗性的Gal-5-HT1A受体的相互作用,代表血清素产生神经传递中新的整合机制。其他的研究表明,GalR1和GalR3的刺激导致抑郁样行为,而GalR2的激活导致抗抑郁样效应。鉴于这些发现,Gal-5-HT1A受体异聚体可能代表一个新的抗抑郁药物[12]。
2.2 D1-D2受体二聚体虽然5-HT和NE被认为是参与抑郁症病理生理学的关键神经递质,但多巴胺系统亦在心境障碍的病因中发挥重要作用。抑郁症患者通常表现出快感缺乏和运动活性减弱的症状,所有这些都与多巴胺相关。因此,当用于抑郁症的新疗法时,靶向多巴胺系统也非常重要。
D1-D2二聚体激活Gαq导致磷脂酶C(PLC)依赖的细胞内Ca2+的释放,并且通过甲基CpG结合蛋白2(MeCP2)的磷酸化激活钙调蛋白激(CaMKII),增加脑源性神经营养因子(BDNF)(图 3)。由D1-D2异源二聚体介导的钙信号的异常调节,导致中枢功能失调,发生抑郁症。

|
图 3 多巴胺D1-D2受体二聚体活化信号通路[13] |
最近报告的证据表明抑郁症中的多巴胺D1和D2受体二聚体[14]。使用免疫沉淀技术检测抑郁症病人脑组织纹状体发现D1-D2二聚体呈明显的上升趋势,他们同样还设计了破坏D1-D2受体的相互作用而不破坏单个受体功能的干扰肽,这种干扰肽施用于大鼠的前额皮质中,导致大鼠的强迫游泳实验中不动时间显著减少,说明抗抑郁样行为与D1-D2二聚体水平的降低相关。D1-D2二聚体通过干扰肽干扰之后导致逃避率降低,而不影响运动行为。这些结果为受体异源二聚化在抗抑郁药物的作用机制中的作用以及多巴胺能神经传递在抑郁症中的作用提供了有利的证据。
2.3 D2-SST受体二聚体多巴胺和生长激素释放系统之间的相互作用,早在多年以前通过解剖、行为和生化研究证明,考虑在情绪调节中的潜在作用,多巴胺和生长抑素也参与抑郁症的病理生理学。在抑郁患者的脑脊液中显示生长抑素和多巴胺代谢物的水平降低[15]。侧脑室内注射生长抑素的大鼠在强迫游泳中表现出抗抑郁的症状,也显示抗抑郁药与多巴胺和生长抑素途径相互作用。在大鼠的纹状体和伏隔核中地昔帕明慢性治疗选择性增强生长抑素诱导多巴胺释放,研究表明,大鼠脑中,抗抑郁药的长期使用影响生长抑素水平和生长抑素与多巴胺受体密度。丙咪嗪上调小鼠下丘脑中生长抑素释放,并在悬尾试验中引发抗抑郁样效应[16]。通过暴露于短链诱导的神经元中多巴胺和生长抑素之间的转换器转换长日光周期[17]。生长激素抑制剂和多巴胺能系统之间的这种功能相互作用的分子基础可能来源于生长抑素和多巴胺受体的相互作用。
最近的研究表明,尽管抗抑郁药对多巴胺或生长抑素受体缺乏亲和力,却促进多巴胺2和生长抑素SST5受体的异源二聚化,这些结果可以被认为是影响多巴胺介导行为反应的生长抑素抗抑郁样效应潜在分子机制的证据[18]。
2.4 5HT1A-5HT7受体二聚体血清素5-HT1A和5-HT7受体在涉及抑郁症的脑区域高度共表达。已经报道异源二聚化减少了5-HT1A受体介导的Gαi蛋白的激活而不影响5-HT7受体介导的Gαs蛋白的激活。5-HT1A-5HT7二聚体在配体刺激下其内化不断升高[19]。5-HT1A受体在中缝核的5-HT能神经元中作为突触前自身受体表达,在包括海马和皮层在内的多个脑区域中作为突触后受体表达。5-HT7受体的脑区域分布的分析揭示了该受体在背侧静脉神经元的5-HT能神经元中高度表达。与突触后神经元相比,存在于突触前神经元中的5-HT1A-5-HT7二聚体的高水平表达代表了5-HT1A受体差异脱敏的机制,已经报道,慢性受体刺激导致仅5-HT1A自身受体的功能性脱敏而不影响突触后5-HT1A受体。因为单独表达的5-HT1A受体对激动剂介导的内化具有抗性,所以在海马或皮层中释放的5-HT不会减少细胞表面突触后5-HT1A受体的量。因此,突触前和突触后神经元异源二聚化的平衡比可能参与抑郁症治疗[20]。
2.5 OXR-KOR受体二聚化食欲素(Orexin)与强啡肽(Dynorphin)均在大脑系统中表达,研究表明在大鼠下丘脑大约90%的食欲素神经元表达强啡肽前体mRNA,同时,在分子水平同样也证实二者在下丘脑高度表达。食欲素和强啡肽均对睡眠觉醒、焦虑、烦躁不安进行调节,因此,二者对抑郁症的调节受到很大的关注。食欲素通过激活多巴胺系统引起细胞内钙离子升高,强啡肽抑制细胞的活性,所以说二者相互拮抗。食欲素受体分为食欲素1型受体(OX1R)和食欲素2型受体(OX2R),OX1R数量减少使得实验大鼠的抑郁症状加重,强啡肽活化能够使人焦虑不安,cAMP反应链接蛋白(cAMP response element binding protein,CREB)能够使强啡肽的表达上调,KOR拮抗剂能够抑制CREB对KOR的调节,降低KOR的活性,从而达到抗抑郁的作用,OXR和KOR信号转导通路的下游分子在抑郁症中也具有重要作用,在GPCRs中,G蛋白偶联受体激酶(G protein-coupled receptor kinases,GRKs)和β-arrestins是与G蛋白结合的重要分子,OXR与KOR作为其配体,引起GPCRs信号脱敏、内化、再循环等,从而发挥一定的生物学作用。因此,OXR-KOR具有良好的抗抑郁效果[21-22]。本研究所应用荧光共振能量转移、生物发光共振能量转移、原位临近连接反应、光遗传学、化学遗传学、活体钙离子成像、电生理和细胞、分子生物学技术对抑郁症的发病机理以及潜在治疗手段,从分子、神经元突触、细胞、神经环路、系统行为学等多层面进行深入研究。
2.6 CRH1-V1b受体二聚化其他GPCRs受体相互作用与抑郁症有关。血管升压素V1b受体和促肾上腺皮质激素释放激素1型受体(CRHR1)主要在垂体中的皮质激素中共表达,并且形成功能性异源二聚体。V1bR和CRHR1异源二聚化介导加压素和促肾上腺皮质激素释放激素(CRH)的协同生物作用,它们是下丘脑-垂体-肾上腺(HPA)轴的关键调节物。血管加压素通过V1b受体刺激垂体前叶皮质激素ACTH的分泌,并加强CRH诱导的ACTH的释放。因此,V1bR和CRHR1之间的直接分子相互作用在焦虑症和抑郁症的发病机制中发挥重要作用[23]。
3 小结与展望本文主要集中在GPCRs之间的相互作用以及对抑郁症的影响,挖掘受体在治疗抑郁症中的潜力。受体二聚体中的分子间相互作用可以改变彼此受体的性质或是改变单体的信号转导通路,产生不同于单体的新的药理学作用,比如多巴胺受体,5-HT受体等单体都具有抗抑郁的作用,但其临床治疗效果并不理想,存在各种副作用;如果针对性的研发靶向于某特定GPCRs二聚体的药物,将会在很大程度上改善临床疗效并降低药物副作用。随着研究的不断深入,逐渐倾向于运用先进技术对内源性功能进行研究,例如,利用PLA这一先进技术可以在正常表达水平上, 对受体进行评价,研究内源性GPCRs的相互作用,以及抑郁模型组织病理学特征,将给理论和临床的获得提供更有力的证据。异聚化的研究代表了开发用于脑疾病新药物的挑战和机会,给抑郁症的治疗带来了新的契机。
| [1] | Murray CJ, Lopez AD. Evidence-based health policy——lessons from the Global Burden of Disease Study[J]. Science, 1996, 274(5288): 740–743. DOI:10.1126/science.274.5288.740 |
| [2] | Kiseljak-Vassiliades K, Xu M, Mills TS, et al. Differential somatostatin receptor(SSTR) 1-5 expression and downstream effectors in histologic subtypes of growth hormone pituitary tumors[J]. Mol Cell Endocrinol, 2015, 417: 73–83. DOI:10.1016/j.mce.2015.09.016 |
| [3] | Jones KA, Borowsky B, Tamm JA, et al. GABA(B) receptors function as a heteromeric assembly of the subunits GABA(B)R1 and GABA(B)R2[J]. Nature, 1998, 396(6712): 674–679. DOI:10.1038/25348 |
| [4] | Bai B, Liu L, Zhang N, et al. Heterodimerization of human apelin and bradykinin 1 receptors:novel signal transduction characteristics[J]. Cell Signal, 2014, 26(7): 1549–1559. DOI:10.1016/j.cellsig.2014.03.022 |
| [5] | Kiseljak-Vassiliades K, Xu M, Mills TS, et al. Differential somatostatin receptor(SSTR) 1-5 expression and downstream effectors in histologic subtypes of growth hormone pituitary tumors[J]. Mol Cell Endocrinol, 2015, 417: 73–83. DOI:10.1016/j.mce.2015.09.016 |
| [6] | Thompson MD, Cole DE, Jose PA. Pharmacogenomics of G protein-coupled receptor signaling:insights from health and disease[J]. Methods Mol Biol, 2008, 448: 77–107. DOI:10.1007/978-1-59745-205-2 |
| [7] | Quitterer U, AbdAlla S. Vasopressor meets vasodepressor:The AT1-B2 receptor heterodimer[J]. Biochem Pharmacol, 2014, 88(3): 284–290. DOI:10.1016/j.bcp.2014.01.019 |
| [8] | González-Maeso J, Ang RL, Yuen T, et al. Identification of a serotonin/glutamate receptor complex implicated in psychosis[J]. Nature, 2008, 452(7183): 93–97. DOI:10.1038/nature06612 |
| [9] | Costa L, Sardone L M, Lacivita E, et al. Novel agonists for serotonin 5-HT7 receptors reverse metabotropic glutamate receptor-mediated long-term depression in the hippocampus of wild-type and Fmr1 KO mice, a model of Fragile X Syndrome[J]. Frontiers in Behavioral Neuroscience, 2015: 9. |
| [10] | Frederick AL, Yano H, Trifilieff P, et al. Evidence against dopamine D1/D2 receptor heteromers[J]. Molecular Psychiatry, 2015, 20(11): 1373–1385. DOI:10.1038/mp.2014.166 |
| [11] | Cheng L. Antidepressants for the treatment of depression in people with cancer[J]. Cancer Nurs, 2017, 40(2): 168–169. DOI:10.1097/NCC.0000000000000472 |
| [12] | Millón C, Flores-Burgess A, Narváez M, et al. The neuropeptides Galanin and Galanin(1-15) in depression-like behaviours[J]. Neuropeptides, 2017, 64: 39–45. DOI:10.1016/j.npep.2017.01.004 |
| [13] | Perreault ML, Hasbi A, O'Dowd BF, et al. Heteromeric dopamine receptor signaling complexes:emerging neurobiology and disease relevance[J]. Neuropsychopharmacology, 2014, 39(1): 156–168. DOI:10.1038/npp.2013.148 |
| [14] | Pei L, Li S, Wang M, et al. Uncoupling the dopamine D1-D2 receptor complex exerts antidepressant-like effects[J]. Nat Med, 2010, 16(12): 1393–1395. DOI:10.1038/nm.2263 |
| [15] | Faron-Górecka A, Kumider M, Solich J, et al. Involvement of prolactin and somatostatin in depression and the mechanism of action of antidepressant drugs[J]. Pharmacol Rep, 2013, 65(6): 1640–1646. DOI:10.1016/S1734-1140(13)71525-1 |
| [16] | Nilsson A, Stroth N, Zhang X, et al. Neuropeptidomics of mouse hypothalamus after imipramine treatment reveal somatostatin as a potential mediator of antidepressant effects[J]. Neuropharmacology, 2012, 62(1): 347–357. DOI:10.1016/j.neuropharm.2011.08.004 |
| [17] | Dulcis D, Jamshidi P, Leutgeb S, et al. Neurotransmitter switching in the adult brain regulates behavior[J]. Science, 2013, 340(6131): 449–453. DOI:10.1126/science.1234152 |
| [18] | Szafran K, Lukasiewicz S, Faron-Górecka A, et al. Antidepressant drugs promote the heterodimerization of the dopamine D2 and somatostatin Sst5 receptors——fluorescence in vitro studies[J]. Pharmacol Rep, 2012, 64(5): 1253–1258. DOI:10.1016/S1734-1140(12)70921-0 |
| [19] | 魏晓楠, 白波, 陈京. 5-羟色胺1 A受体及其二聚化研究进展[J]. 济宁医学院学报, 2016, 39(1): 48–52, 57. |
| [20] | Naumenko VS, Popova NK, Lacivita E, et al. Interplay between serotonin 5-HT1A and 5-HT7 receptors in depressive disorders[J]. CNS Neurosci Ther, 2014, 20(7): 582–590. DOI:10.1111/cns.12247 |
| [21] | 张如敏, 王春梅, 潘衍有, 等. 食欲素和强啡肽在抑郁症病理机制中的研究进展[J]. 中华行为医学与脑科学杂志, 2013, 22(11): 1049–1050. DOI:10.3760/cma.j.issn.1674-6554.2013.11.029 |
| [22] | Chen J, Zhang R, Chen X, et al. Heterodimerization of human orexin receptor 1 and kappa opioid receptor promotes protein kinase A/cAMP-response element binding protein signaling via a Gαs-mediated mechanism[J]. Cell Signal, 2015, 27(7): 1426–1438. DOI:10.1016/j.cellsig.2015.03.027 |
| [23] | Young SF, Griffante C, Aguilera G. Dimerization between vasopressin V1b and corticotropin releasing hormone type 1 receptors[J]. Cell Mol Neurobiol, 2007, 27(4): 439–461. DOI:10.1007/s10571-006-9135-8 |



