2. 济宁医学院神经生物学研究所, 济宁 272067
2. Institute of Neurobiology, Jining Medical University, Jining 272067, China
食欲素位于下丘脑、具有促进摄食功能的兴奋性神经肽,由前体食欲素加工修饰形成两个单体(Orexin A和Orexin B)。食欲素受体分为两种亚型(OX1R和OX2R)[1],OX1R广泛分布于大脑中的下丘脑腹内侧核及海马等区域,OX2R广泛分布于皮层、海马、下丘脑室旁核等区域[2]。1999年,Lin等[3]通过对杜宾犬发作性睡病的研究,发现了OX2R的基因变化,同时,另一小组在OX2R基因敲除小鼠中发现发作性睡病的特点[4],两项研究均证明食欲素在发作性睡病中发挥着重要的作用。食欲素信号通路在哺乳动物的自我调节系统方面扮演着重要的角色,Orexin不仅在食欲方面发挥着重要作用,而且在睡眠与觉醒、注意力、奖赏与寻求、应激、心血管疾病等方面亦发挥着重要作用。
OX2R是机体功能调节的重要受体,很多种疾病的发生发展与其氨基酸突变关系密切。有研究报道,偏头痛、焦虑等症状与OX2R 1246G>A单核苷酸的突变有关[5-6],单核苷酸突变后干扰OX2R二聚化使OX2R的功能下降[7],从而导致疾病的发生。迄今为止已知的OX2R多态性还有OX2R(Cys193Ser)、OX2R(Ile293Val)、OX2R(Thr401Ile)等位点突变,这些突变位点在一定程度上改变了受体的结构,从而直接或间接地影响着受体与G蛋白相互作用之间的特异性[8]。我们前期实验发现,当Orexin A刺激后,OX2R的223及243位酪氨酸突变为丙氨酸(Tyr223/243Ala),Orexin B刺激后,231位苏氨酸突变为丙氨酸(Thr231Ala),结果显示这几个氨基酸在发挥OX2R的功能方面起到重要作用。为进一步明确这几个位点的作用,本实验我们利用分子生物学方法构建含有这3个位点的突变体,为下一步明确OX2R功能及作用机制奠定基础。
1 材料和方法 1.1 材料载体pEGFP-OX2R和pVenus-N1由英国华威大学陈京博士馈赠。dNTP mixture、5×ps buffer、Prime STAR Ploymerase、Bam HI、Hind Ⅲ、T4-DNA连接酶、T4-Buffer均购自大连TakaRa公司。感受态大肠杆菌E.coli DH5ɑ、琼脂糖凝胶回收试剂盒、质粒小提试剂盒,均购买自北京天根生物公司。引物均由上海生物工程有限公司合成。HEK293T细胞系购买于ATCC公司,DMEM培养基购自Gibco公司,转染试剂Lipofectamine2000、opti均购自Invitrogen公司。
1.2 方法 1.2.1 引物设计在Pubmed-GeneBank中获取人OX2R的cDNA序列,并根据该序列特点及pVenus-N1的序列特点,利用Primer 3.0设计引物,引物两端含有内切酶酶切位点。见表 1。
| 表 1 引物序列 |
以pEGFP-OX2R为模板,进行两步PCR扩增,扩增体系为50μl:模板4 μl,dNTP 8μl,5×buffer 10μl,DNA酶1μl,上下游引物各1μl,ddH2O 5μl。PCR反应程序:95℃ 5min;95℃ 30s,55℃ 30s,72℃ 30s,32个循环;72℃ 10min;4℃保存。通过琼脂糖凝胶电泳回收PCR产物。第一步PCR是以pEGFP-OX2R为模板,OX2R-F分别与OX2R223-R、OX2R243-R、OX2R231-R为引物和以OX2R223-F、OX2R243-F、OX2R231-F与OX2R-R为引物进行PCR反应,命名为第一组和第二组反应,产物回收后用紫外分光光度计测浓度和纯度。第二步PCR是以第一组和第二组反应得到的PCR产物同时作为扩增模板,OX2R-F与OX2R-R为引物进行PCR反应,回收后检测浓度和纯度。Bam HI、Hind Ⅲ双酶切PCR产物及载体pVenus-N1。酶切体系:10×K 2μl,Bam HI 2μl,Hind Ⅲ 2μl,PCR产物或载体10μl,ddH2O 4μl。酶切产物经琼脂糖凝胶回收,T4-DNA连接酶连接。连接体系为:T4-buffer 2μl,T4-DNA连接酶2μl,PCR产物8μl,载体6μl;4℃放置2h,16℃过夜。连接产物转化至大肠杆菌DH5ɑ,37℃恒温培养过夜,挑取单克隆菌体,进行PCR菌落鉴定。鉴定正确的菌落过夜摇菌,提取质粒。将提取质粒用Bam HI及Hind Ⅲ进行双酶切鉴定。酶切正确的质粒送上海生工测序部测序。
1.2.3 转染突变体至HEK293T细胞将状态良好、处于对数生长期的HEK293T细胞用胰酶消化传到24孔板,保持细胞生长达到约90%的浓度时,将2μl lip与50μl opti混合5min作为A液,1μɡ构建的突变质粒与50μl opti混合作为B液,将A、B液混合均匀,静止30min后,将混合液加到24孔板内的细胞中,同时转染野生型质粒作为对照。待细胞生长12h后将其按照1 :20的比例传到铺有盖玻片的12孔板内,当细胞舒展后开始做片,0.1%的Triton X-100打孔,DAPI染细胞核,利用超高分分辨率显微镜观察黄色荧光蛋白,检测OX2R野生型及突变体在HEK293T细胞中的表达。
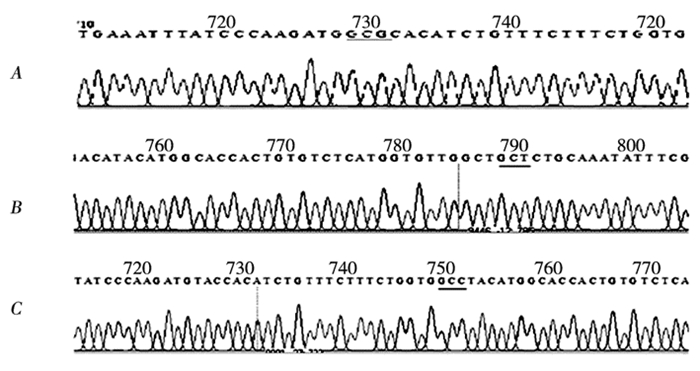
2 结果 2.1 突变体的构建以pEGFP-OX2R为模板,第一步PCR扩增后,经琼脂糖凝胶电泳得到特异性条带(图 1)。第二步PCR扩增后,经琼脂糖凝胶电泳得到特异性条带,与OX2R已知长度相符(图 2)。重组突变体双酶切后,电泳结果显示两条DNA条带,一条较大的条带和一条长度约为1400bp的条带,与理论相符,初步证明突变体构建成功(图 3)。突变体测序图谱和测序结果显示,除突变位点按预期发生碱基突变外,其余序列均与OX2R序列完全一致,证明突变体构建成功。见图 4。

|
图 1 第一步PCR扩增产物 |
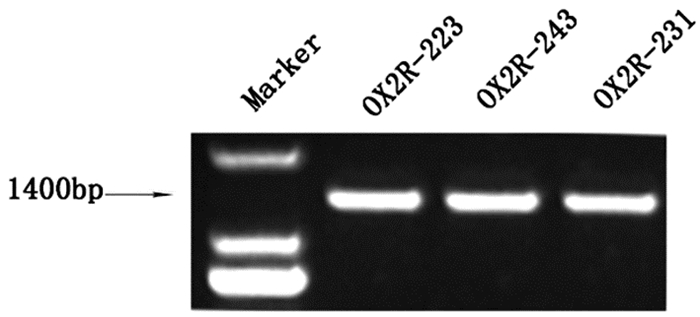
|
图 2 第二步PCR扩增产物 |
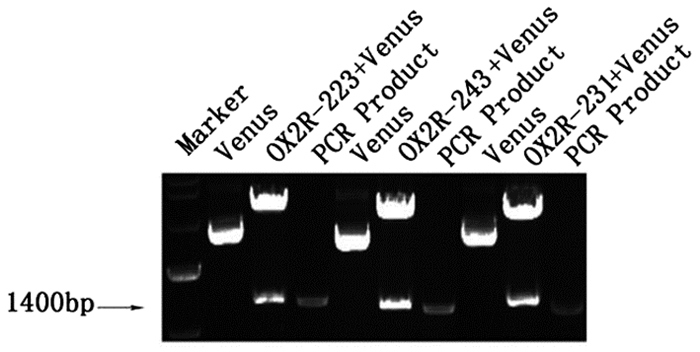
|
图 3 双酶切电泳图 |
|
图 4
OX2R点突变体的测序图谱
注:A下划线标注意为TAC变为GCG; B下划线标注意为TAT变为GCT; C下划线标注意为ACA变为GCC |
利用超高分分辨率显微镜观察突变体的表达,图 5(A)为野生OX2R在HEK293T细胞中的表达,可知OX2R主要在细胞膜上表达,与前期研究结果一致。图 5(B)为223点突变体的表达,图 5(C)为243点突变体的表达,图 5(D)为231点突变体的表达,结果均显示突变受体均在HEK293T细胞膜上表达,同时也表明这3个突变位点不影响受体在细胞膜上的表达,均可以用于下游实验。

|
图 5
野生型与突变型质粒在HEK293T细胞中的表达
注:A.野生型质粒的表达; B.223位点突变体质粒的表达; C.243位点突变体质粒的表达; D.231位点突变体质粒的表达 |
GPCR是目前已知的膜受体中最大家族,由氨基端、羧基端、7个跨膜肽、3个胞内环及3个胞外环组成,故又称7次跨膜受体。当GPCR与其配体结合后引起受体的构象发生改变,从而激活胞内G蛋白,引起一系列的级联反应,启动细胞信号转导通路,介导生理功能,维持生物体稳态[9-10]。因此,当GPCR发生突变或者缺失后,就会引起机体功能失调导致疾病产生。OX2R属于G蛋白偶联受体(GPCR),通过G蛋白信号通路发挥生理作用,当OX2R在受环境因素或在病理条件下发生突变后,势必影响与食欲素的结合及下游的信号通路,从而直接或间接的影响食欲素的生物学作用,引起心血管及神经系统的疾病。
OX2R基因多态性对机体的影响研究相对较少。在我们的前期实验研究中,发现OX2R被Orexin A和Orexin B刺激后,223、243、231 3个位点的碱基发生了突变,造成编码不同的氨基酸,从而形成不同结构、序列的蛋白质。因此,本文利用了分子生物学技术,成功构建了3个突变体的质粒,为证明其是否正常表达,本实验选用HEK293T细胞作为模型细胞,此细胞为裸细胞,不影响质粒转染之后的任何表达,而且转染效率较高,常被选用作为转染的工具细胞来检测质粒的表达。此次实验将构建的pOX2R-Venus质粒成功转染至HEK293T细胞中,利用超高分分辨率显微镜观测到野生型与突变型受体均能够在该细胞质膜部位表达,同时此次构建的真核表达载体为下一步研究该受体的功能等机制奠定基础。
本文是我们进一步研究OX2R功能的基础,下一步我们将采用Western blotting技术、Q-RTPCR技术、生物发光共振能量转移等技术,研究OX2R突变受体与G蛋白之间的相互作用,阐明这3个突变位点的氨基酸分别在信号转导通路,生物学功能中发挥的重要作用。
| [1] | Gotter AL, Webber AL, Coleman PJ, et al. International uUnion of basic and clinical pharmacology[J]. Pharmacol Rev, 2012, 64(3): 389–420. DOI:10.1124/pr.111.005546 |
| [2] | Trivedi P, Yu H, MacNeil DJ, et al. Distribution of orexin receptor mRNA in the rat brain[J]. FEBS Lett, 1998, 438(1-2): 71–75. DOI:10.1016/S0014-5793(98)01266-6 |
| [3] | Lin L, Faraco J, Li R, et al. The sleep disorder canine narcolepsy is caused by a mutation in the hypocretin(orexin) receptor 2 gene[J]. Cell, 1999, 98(3): 365–376. DOI:10.1016/S0092-8674(00)81965-0 |
| [4] | Chemelli RM, Willie JT, Sinton CM, et al. Narcolepsy in orexin knockout mice:molecular genetics of sleep regulation[J]. Cell, 1999, 98(4): 437–451. DOI:10.1016/S0092-8674(00)81973-X |
| [5] | Schürks M, Limmroth V, Geissler I, et al. Association between migraine and the G1246A polymorphism in the hypocretin receptor 2 gene[J]. Headache, 2007, 47(8): 1195–1199. DOI:10.1111/hed.2007.47.issue-8 |
| [6] | Annerbrink K, Westberg L, Olsson M, et al. Panic disorder is associated with the Val308Iso polymorphism in the hypocretin receptor gene[J]. Psychiatr Genet, 2011, 21(2): 85–89. DOI:10.1097/YPG.0b013e328341a3db |
| [7] | Rainero I, Gallone S, Rubino E, et al. Haplotype analysis confirms the association between the HCRTR2 gene and cluster headache[J]. Headache, 2008, 48(7): 1108–1114. DOI:10.1111/j.1526-4610.2008.01080.x.Epub2008Apr8 |
| [8] | 黄伟伟, 池恒, 唐吉友. Orexin受体基因多态性与神经精神疾病的研究进展[J]. 临床神经病学杂志, 2016, 29(2): 151–153. |
| [9] | Bockaert J. Molecular tinkering of G protein-coupled receptors:an evolutionary success[J]. EMBO J, 1999, 18(7): 1723–1729. DOI:10.1093/emboj/18.7.1723 |
| [10] | Pierce KL, Premont RT, Lefkowitz RJ. Seven-transmembrane receptors[J]. Nat Rev Mol Cell Biol, 2002, 3(9): 639–650. DOI:10.1038/nrm908 |
| [11] | Dryja TP. Doyne Lecture.Rhodopsin and autosomal dominant retinitis pigmentosa[J]. Eye(Lond), 1992, 6(Pt 1): 1–10. |
| [12] | Birnbaumer M, Seibold A, Gilbert S, et al. Molecular cloning of the receptor for human antidiuretic hormone[J]. Nature, 1992, 357(6376): 333–335. DOI:10.1038/357333a0 |
| [13] | Parma J, Duprez L, Van Sande J, et al. Somatic mutations in the thyrotropin receptor gene cause hyperfunctioning thyroid adenomas[J]. Nature, 1993, 365(6447): 649–651. DOI:10.1038/365649a0 |

